吐根碱结合PARP-1逆转肝癌细胞HepG2/DDP耐药的作用研究
2022-09-21任鹏飞王恒毅
任鹏飞,刘 晨,冉 翔,王恒毅
作者单位:1安徽医科大学第一附属医院普外科,合肥 2300322安徽医科大学附属阜阳医院急诊科,阜阳 2360003安徽医科大学药学院,合肥 230032
肝癌是恶性程度最大的肿瘤之一。化疗耐药是肝癌患者预后差的重要原因[1]。铂类药物是肝癌治疗的一线药物,但长期使用往往会出现耐药性[2]。DNA损伤修复是导致肝癌耐药最主要的机制[3-4]。研究[5-6]表明,DNA修复酶多聚 (ADP-核糖) 聚合酶-1[poly (ADP-ribose) polymerase-1, PARP-1]在耐药肝癌细胞中高度表达, 在临床上显著降低铂类药物对肝癌的治疗作用。吐根碱是一种异喹啉生物碱,近年来研究[7-8]发现吐根碱联合化疗药物能够增强肿瘤细胞对化疗药物的敏感性,但是机制尚不明确。因此,该研究构建了顺铂(cisplatin, DDP)耐药肝癌细胞株HepG2/DDP,评价吐根碱是否通过结合PARP-1而发挥增敏顺铂的抗肿瘤作用,希望为临床逆转肝癌耐药的研究提供一定的思路。
1 材料与方法
1.1 实验材料吐根碱(货号:E275439)、瑞卡帕布(货号:R288628)、DDP(货号:C295225)、3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑鎓溴化物(MTT,货号:T100896)购自上海阿拉丁试剂有限公司;PARP-1购自美国Sigma-Aldrich 公司。抗PAR抗体、抗γH2AX抗体、抗PARP-1抗体、抗β-actin抗体、抗BAX抗体、抗Bcl2抗体、抗Caspase-3抗体购自美国Cell Signaling Technology公司;PARP-1 siRNA、NC siRNA购自广州市锐博生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京建成生物工程研究所;HepG2细胞来源于安徽医科大学药学院细胞存储中心。
1.2 反向虚拟筛选与分子对接采用Discovery studio 2017软件进行反向筛选和分子对接。用Chemdraw 2010绘制吐根碱结构,Discovery studio 2017优化加氢,Libdock程序与Discovery studio 2017软件蛋白数据库组件对接,选取排名前十的蛋白进行分析,选择目标蛋白,再次利用Libdock程序与目标蛋白进行对接,获得三维(合)二维结合模式图,分析小分子与配体间的键合作用。蛋白质晶体结构来源于Protein Data Bank数据库。
1.3 表面等离子体共振实验将PARP-1蛋白标记在芯片上,6种浓度的吐根碱(500、250、125、62.5、31.25、15.625 nmol/L)通过6个通道以20 μl/min 的速度流过芯片,持续5 min,再用磷酸盐缓冲液冲洗10 min,Biacore T200 2.1软件分析结果,实验采用GE Biacore T200 生物大分子相互作用分析仪(Cytiva,美国)进行操作。
1.4 DDP耐药细胞HepG2/DDP的构建采用药物大剂量冲击和低剂量持续诱导相结合的方法诱导细胞产生耐药性。将HepG2细胞置于含有10%胎牛血清、100 U/ml青-链双抗的DMEM培养基中培养,待HepG2细胞细胞融合度超过60%以后加入5 g/ml的DDP培养,24 h后洗去死细胞,继续培养,待再次融合度超过60%后加入5 g/ml的DDP培养,24 h后洗去死细胞,依次反复传代10次。随后将得到的细胞加入0.5 g/ml的DDP适应性培养,培养10代之后检测DDP的IC50,检测细胞的耐药性,备用,并将细胞命名为HepG2/DDP。
1.5 细胞毒实验将处于对数生长期的HepG2或HepG2/DDP接种到96孔板中(密度为5 000个细胞/孔)。培养24 h后加入DDP(0、0.25、0.5、1、2、4、8、16、32、64 μg/ml)或吐根碱(1、2、4、8、16、32、64 μmol/L)或吐根碱(16 μmol/L)+DDP(0、0.25、0.5、1、2、4、8、16、32、64 μg/ml)后继续培养24 h,吸去培养基后每孔加入20 μl浓度为5 mg/ml的MTT,在37℃ 继续孵育4 h,每孔再加入100 μl DMSO,混匀,在490 nm波长处检测吸光度,所有实验重复3次,计算细胞生存率、IC50值及HepG2/DDP细胞的耐药指数(RI)。RI=耐药株IC50/非耐药株IC50。
1.6 转染实验siRNA由广州市锐博生物科技有限公司合成。PARP-1 siRNA序列为5′-GGAUGAUCUUCGACGUGGA-3′;阴性对照NC siRNA序列为5′-UUCUCCGAACGUGUCACGU-3′。根据LipofectamineTM 2000说明书进行转染。转染后进行免疫荧光实验、蛋白印迹实验及细胞毒实验(设为空白组、4 μg/ml DDP组、16 μmol/L吐根碱+4 μg/ml DDP组)。
1.7 免疫荧光实验取转染后的细胞,加入到24孔板中预包被多聚赖氨酸的玻片上,37℃孵育5 h,待贴壁后吸干液体,多聚甲醛固定,30 min后加入羊血清封闭,孵育40 min,吸弃液体加入一抗后4℃孵育过夜,PBS洗涤3次,加入二抗进行荧光染色,作用1 h后用荧光显微镜下观察结果。
1.8 蛋白印迹实验将浓度分别为0、4、8、16 μmol/L的吐根碱与HepG2/DDP细胞孵育24 h或单独培养HepG2、HepG2/DDP和HepG2/DDP (PARP-1 siRNA) 细胞24 h后收集细胞,蛋白定量后SDS-PAGE电泳分离蛋白转膜,用TBS-T配制的含5%脱脂牛奶的缓冲液封闭,1 h后用TBS-T 缓冲液洗膜3 次,加入1 ∶1 000 稀释比例的一抗(抗PAR抗体、抗γH2AX抗体、抗PARP-1抗体、抗BAX抗体、抗Bcl2抗体、抗Cleaved-caspase-3抗体、抗β-actin抗体), 4℃孵育过夜。过夜后待膜恢复至室温,TBS-T缓冲液洗膜3次,加入1 ∶3 000稀释的对应二抗,孵育1 h,取出膜后TBS-T 缓冲液洗膜3次,吸干,加入化学发光剂进行凝胶成像检测,计算吸光度,分析结果。
1.9 流式细胞检测将对数生长期的HepG2/DDP细胞调整浓度为1×105个/ml,接种到6孔板中。分别设空白组、DDP组(4 g/ml)和吐根碱(16 μmol/L)+DDP(4 g/ml)组,培养24 h后收集细胞,1 000 r/min、4 ℃下离心5 min,并用预冷PBS冲洗两次。随后将细胞重新悬浮在100 μl PBS缓冲液中,加入5 μl Annexin V-FITC混合。冰上避光15 min,然后添加400 μl PBS。流式细胞仪检测前加入5 μl碘化丙碇溶液,混匀后快速检测细胞凋亡率。
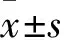
2 结果
2.1 吐根碱体外与PARP-1的相互作用反向虚拟筛选结果显示吐根碱对多个药物靶点有良好的结合作用。取契合值打分排名前十的靶点分析显示,吐根碱与降低化疗药物敏感性相关的DNA修复酶PARP-1 (PDB ID: 4und)有较高的契合值打分,提示吐根碱可能通过结合PARP-1增强化疗药物的敏感性。见表1。
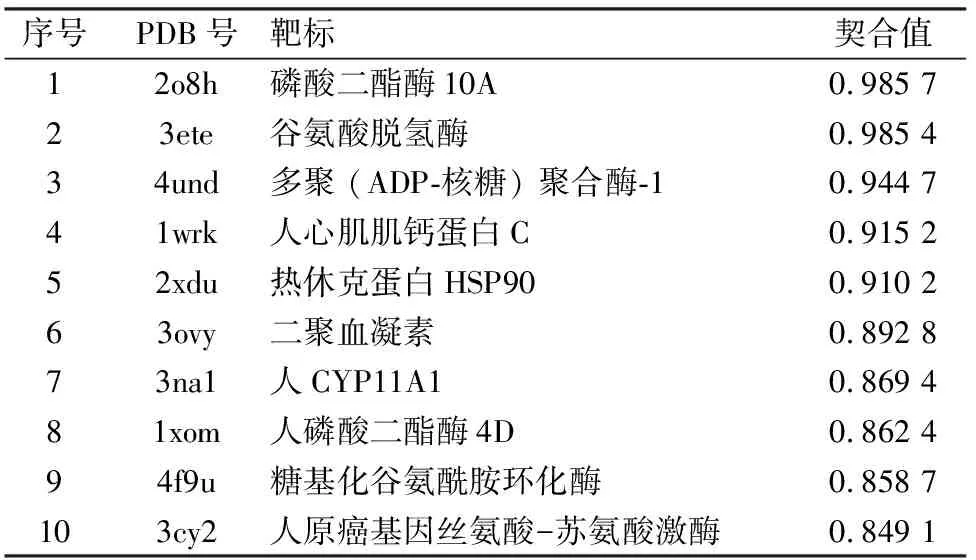
表1 Discovery Studio 2017预测的排名前十位的蛋白质晶体靶标
对已报道的PARP-1的活性位点进行对接,结果显示吐根碱能够通过多种模式结合到PARP-1活性位点中,包括:一个形成于氨基酸GLY863和异喹啉环上的羟基的氢键;一个形成于氨基酸GLU988和异喹啉环上质子化N的离子键;芳香族氨基酸TYR806、TYR889、TYR907分别与吐根碱结构中的苯环产生的π-π堆积作用;多个疏水氨基酸与吐根碱通过范德华力和和多个弱的碳氢键相互作用。见图1。
SPR实验在分子水平观察吐根碱与PARP-1的相互作用,采用瑞卡帕布作为阳性对照。结果如图2所示,各种浓度(化合物浓度依次为500、250、125、62.5、31.25、15.625 nmol/L)的吐根碱和瑞卡帕布通过标记PARP-1蛋白的芯片后,芯片表面偏振光折射率发生不同程度的变化,表明小分子与PARP-1蛋白发生结合作用。对结合曲线进行拟合的到解离动力学常数KD值,两者分别为5.73×10-6mol/L(吐根碱)和4.26×10-6mol/L(瑞卡帕布),说明吐根碱与PARP-1有良好的结合作用。
2.2 HepG2/DDP细胞耐药性鉴定及PARP-1的表达分析MTT法检测了DDP对HepG2和HepG2/DDP耐药株的IC50值。结果如图3A所示,DDP对HepG2细胞增殖有显著的抑制作用,各组间差异有统计学意义(F=61.14,P<0.01),IC50值为(4.27±0.34) μg/ml;HepG2/DDP细胞株对各个浓度的DDP均显示出一定的耐药性(F=73.96,P<0.01),IC50值增至(15.76±0.84) μg/ml,RI值为3.69。这一结果说明HepG2/DDP细胞对DDP产生了显著的耐药性。蛋白印迹实验显示 (图3B、C),PARP-1在HepG2/DDP细胞中的表达量较HepG2显著提高,差异有统计学意义(t=13.68,P<0.01)。
2.3 吐根碱对HepG2/DDP细胞耐药性的逆转分析如图4A所示,吐根碱在1~16 μmol/L浓度区间内对HepG2/DDP细胞的增殖无明显抑制作用,当浓度达到32 μmol/L时,HepG2/DDP细胞的增殖显著受到抑制,抑制率达到(21.86±1.78) %,故选择16 μmol/L作为吐根碱的无毒阈值研究其对HepG2/DDP细胞的增敏作用。进一步研究显示吐根碱(16 μmol/L)联合不同浓度DDP与HepG2/DDP细胞共培养后,细胞生存率较DDP单用组下降,差异有统计学意义(F=98.49,P<0.01)。计算吐根碱和DDP联合用药的IC50值,结果显示较DDP单独使用组,IC50值显著下降[IC50值为(3.95 ±0.43) g/ml],RI值为0.93。这一结果提示吐根碱对HepG2/DDP细胞DDP的耐药性有显著的逆转作用。见图4B。

图1 吐根碱与PARP-1(PDB号:4und)的结合模式图

图2 SPR检测吐根碱与PARP-1结合作用

图3 HepG2/DDP细胞耐药性鉴定及细胞株中PARP-1的表达
2.4 吐根碱在细胞内对PARP-1酶活性的影响为进一步评价吐根碱对PARP-1的抑制作用,采用免疫印迹法检测了细胞内反映PARP-1 酶活性PAR表达水平及反映DNA 损伤的γH2AX表达水平。结果显示,吐根碱处理HepG2/DDP细胞24 h后,细胞内PAR的表达量明显降低,γH2AX的表达量增加(FPAR=519.0,P<0.01;FH2AX=794.3,P<0.01),提示吐根碱可抑制HepG2/DDP细胞中的 PARP-1活性,进而阻断细胞内 DNA 损伤修复,增强化疗药物对肿瘤细胞的敏感性。见图5。
2.5 吐根碱联合DDP对沉默PARP-1 的HEPG2/DDP细胞增殖的影响如图6所示,免疫荧光和蛋白印迹实验显示PARP-1 siRNA转染后HEPG2/DDP细胞中的PARP-1生成量显著降低;在吐根碱存在的条件下,与阴性对照组相比,DDP对PARP-1 siRNA转染的HEPG2/DDP细胞的增殖没有明显的影响。这一结果进一步证实了吐根碱通过抑制肿瘤细胞中的 PARP1活性,增强化疗药物的敏感性。
2.6 吐根碱联合DDP对HepG2/DDP细胞凋亡的影响结果如图7所示,空白组、DDP组和吐根碱+DDP组细胞凋亡率分别为(2.84±1.02)%、(11.87±2.41)%和(39.77±4.66)%。与DDP组比较,吐根碱+DDP组HepG2/DDP细胞凋亡率显著升高,差异有统计学差异(t=11.22,P<0.01)。蛋白印迹实验显示(图7B、C),DDP降低Bcl2表达,同时增加BAX和切割的Caspase-3的表达水平,吐根碱则显著增强了DDP调控这些凋亡相关蛋白的作用,差异有统计学差异(F=84.27,P<0.01)。
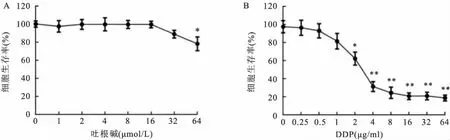
图4 吐根碱对HepG2/DDP细胞耐药性的逆转作用
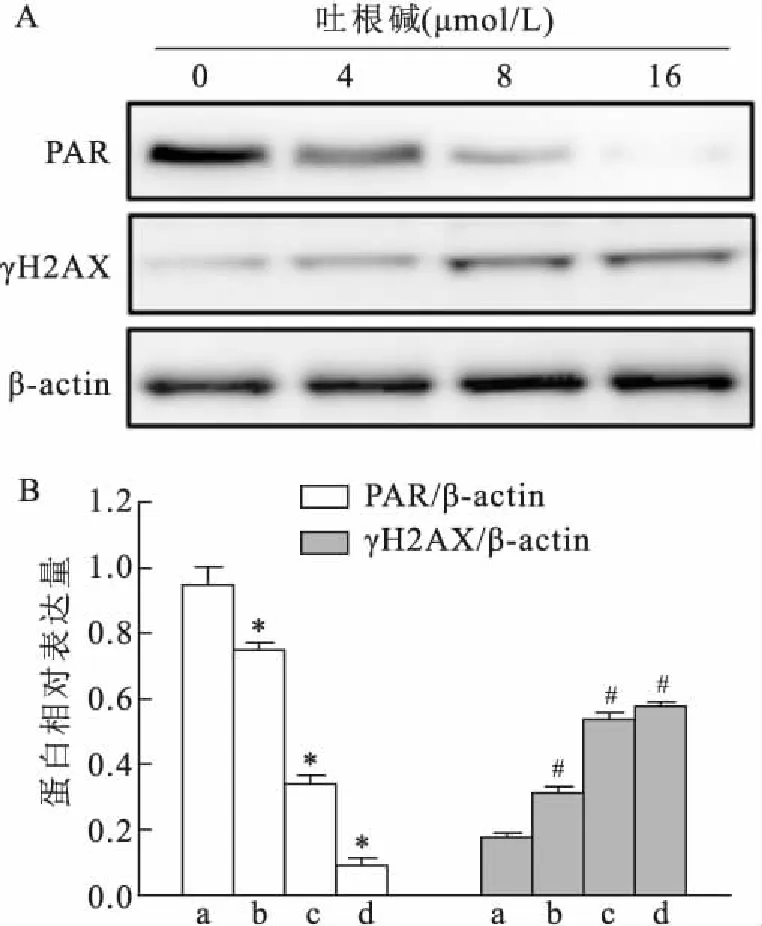
图5 吐根碱在细胞内对PARP-1酶活性的影响
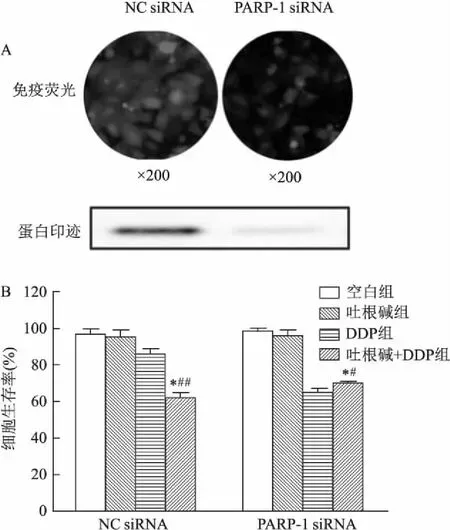
图6 吐根碱联合DDP对沉默PARP-1的HEPG2/DDP细胞增殖的影响
3 讨论
化疗耐药是导致肝癌综合治疗失败、病死率居高不下的一个主要因素。因此,研究肝癌的化疗耐药机制,寻找逆转化疗耐药的方法显得尤为重要。肿瘤细胞中PARP1 蛋白响应于 DNA 损伤反应,在被 DNA 链断裂激活后,PARP1 以 NAD+依赖性方式催化PAR的合成,进行DNA损伤修复,这一过程在几秒钟内即可发生,是最快的 DNA 损伤反应之一[3-4]。近年来,多种结构的PARP-1抑制剂陆续被开发出来,其中一些抑制剂目前作为单一药物或与DNA损伤药物联合已进入临床试验的不同阶段[9-10]。目前已有2 个PARP-1抑制剂获批上市,包括奥拉帕瑞布和拉卡帕瑞[11]。多项研究[12]表明,这些PAPR-1抑制剂能提高肝癌细胞对DNA损伤药物敏感性,但是部分药物仍然存在如药代动力学差、潜在毒性的缺陷。因此,仍然需要努力寻找具高效低毒的新型骨架的PARP-1抑制剂。
天然产物是新药发现的巨大宝库,本研究显示来源于天然产物茜草科植物吐根单体成分吐根碱具有潜在的增敏DDP对肝癌细胞HEPG2/DDP的毒性作用,这一结果提示在临床治疗中吐根碱具有成为化疗药物增敏剂的潜力。计算机反向虚拟筛选的过程表明吐根碱与PARP-1有良好的结合作用,提示吐根碱可能是通过结合PARP-1、抑制PARP-1活性而发挥增敏化疗药物的作用。分子对接实验分析了吐根碱与PARP-1的结合模式,显示吐根碱能通过多重作用与PARP-1的活性位点的多个氨基酸残基键合,在这些氨基酸中,GLY 863和TYR 907已被证实是PARP-1抑制剂键合的关键氨基酸[13]。SPR实验在体外分析了吐根碱与PARP-1的相互作用,结果显示其结合PARP-1的能力与阳性药物瑞卡帕布相当。在细胞水平上,免疫印迹实验显示吐根碱可显著抑制PARP-1的活性,表现为抑制酶活标志物PAR表达,增强DNA损伤标志物γH2AX的表达。此外,siRNA转染实验评价了沉默PARP-1基因后吐根碱联合DDP对的HEPG2/DDP细胞增殖的影响。结果显示沉默PARP-1基因的HEPG2/DDP细胞联合使用吐根碱的DDP与单独使用DDP相比,病死率没有明显变化,进一步证实了吐根碱对DDP的增敏作用是通过靶向结合PARP-1。

图7 吐根碱(16 μmol/L)联合DDP(4 μg/ml)对HepG2/DDP细胞凋亡的影响
与DNA发生烷基化反应,损伤肿瘤细胞DNA是铂类药物诱导肿瘤细胞凋亡的主要机制[14]。PARP-1与凋亡蛋白P53关系密切,其不仅参与P53蛋白活化途径,而且能够促进P53与细胞内损伤DNA缺口相结合,进而修复铂类药物导致的DNA损伤[15]。因此,PARP-1作为DNA修复酶,阻碍其激活对铂类药物诱导肿瘤细胞凋亡非常重要。在本研究中,Annexinv-PI双染实验结果显示,与DDP单独使用组相比,吐根碱可显著增加DDP诱导的HepG2/DDP细胞后期凋亡,凋亡相关蛋白Bcl2表达显著降低,Bax、Caspase-3的表达明显增加。结合先前实验结果,进一步表明吐根碱可以通过抑制PARP-1活性,增强HepG2/DDP细胞对DDP敏感性,促进DDP诱导肿瘤细胞的凋亡。
综上所述, 本研究表明吐根碱对DNA修复酶PARP-1具有较强的抑制作用,能够增强铂类化疗药物对耐药肝癌细胞株的敏感性,为进一步开发治疗肿瘤的新型PARP-1 抑制剂提供了基础。本研究尚存在着一些不足,如选取的肿瘤细胞种类单一、未开展动物体内实验、化合物药代动力学信息不足等,后续的研究将针对这些缺陷开展工作以提供更多吐根碱作为肿瘤治疗药物先导化合物的数据。
