探讨小剂量氯胺酮抑制癌痛大鼠吗啡耐受机制
2022-09-20张俊霞梁艳芳张秀宁徐贯杰李志华刘春晓
张俊霞,梁艳芳,张秀宁,徐贯杰,李志华,刘春晓
(1.内蒙古自治区人民医院手术麻醉二科,内蒙古 呼和浩特 010017;2.内蒙古医科大学研究生学院;3.河北医科大学第三医院手术麻醉一科)
绝大多数癌症患者到中晚期后,最难以忍受的临床症状即无法缓解的重度疼痛,重度癌痛具备长期性、渐进性及复杂性等特征,不仅对病人生理、心理及人际关系产生不良影响,而且对机体免疫功能也产生重要影响,其中以骨癌疼痛为著[1]。目前临床上多采用手术、放化疗、阿片类止痛药物来缓解中重度骨转移性癌痛。但绝大数患者不能得到满意的镇痛效果,这促使最大限度地帮助晚期癌症患者缓解疼痛、解除疼痛带来副作用逐渐成为临床医生的首要任务。
阿片类止痛药物被世界卫生组织指定作为抗击晚期癌痛治疗的“第三阶梯”用药,通过与不同脑区阿片受体结合抑制P物质释放干扰中枢系统发挥镇痛作用,鞘内给药长效治疗效果广受临床医生认可[2]。但最新研究指出长期应用吗啡抗击癌痛除产生的耐药性及毒副作用外,其亦参与癌细胞的扩散与发展,因此限制了其在临床中的使用[3]。
氯胺酮是一种N-甲基D-天氨酸受体选择性拮抗药,作为短效镇痛剂,早有报道指出小剂量鞘内注射可以辅助增加吗啡等阿片类镇痛药物的镇痛效果,同时一定程度逆转吗啡长期应用产生机体耐受性[4]。国内外临床医生及学者推荐可鞘内注射小剂量氯胺酮联合吗啡协同参与镇痛的治疗,减轻吗啡耐药性及毒性作用[5]。本研究拟通过观察小剂量氯胺酮鞘内注射吗啡癌耐受小鼠模型影响并进行相关机制探讨。
1 材料与方法
1.1 细胞及动物
MADB-106乳腺癌细胞(购于拜力生物科技有限公司,上海)。SPF级健康雌性SD大鼠,体质量为230~250 g(购于河北医科大学动物实验中心)。饲养环境:室温(25±0.5)℃,混合饲料和纯净水喂养,自由饮食饮水。
1.2 药物和试剂
盐酸吗啡注射液(购自沈阳第一制药厂,东北制药厂批号081105-1,国药准字H21022436);盐酸氯胺酮注射液(购自恒瑞医药股份有限公司,江苏,批号KH090501);DMEM高糖(购自GIBCO公司);胎牛血清(购自CLARK公司);二甲基亚砜(购自勃盛化学试剂有限公司);胰蛋白酶-EDTA(购自宏瑞特生物技术有限公司);缓激肽检测试剂盒(购自R&D公司,美国);兔Substance-P抗体(购自博士德生物工程有限公司);浓缩型DAB试剂盒(购自中杉金桥公司,北京);SP免疫细胞化学试剂盒(购自博海生物工程有限公司);Poly-L-LysineSolution(多聚赖氨酸,购自博海生物工程有限公司,河北)。
1.3 动物模型的制备
1.3.1 在癌痛大鼠模型基础上制作本研究所用胫骨癌痛模型。将10%水合氯醛350 mg/kg注射入大鼠腹腔麻醉后,将大鼠仰卧位捆绑固定于操作板,使用有齿镊夹脚趾,直到大鼠对钳夹无反应,同时均匀自主呼吸,判定为麻醉满意。穿刺部位统一选为大鼠左侧胫骨上段,与膝关节距离1 cm处,模型组(B组)将乳腺癌细胞3μl(大约4.8×106/mL)注入大鼠胫骨骨髓腔,注射完毕后5 min将针头拔出,并用骨蜡迅速封孔,逐层缝合。空白对照组(A组)以同样操作规范注射相同容积的生理盐水,假手术组(C组)进行手术操作,不进行药物注射。分别于术后8 d、14 d以大鼠自由行走痛行为、辐射热痛阈、X线影像学及患肢胫骨HE染色验证癌痛模型建立成功与否。
1.3.2 慢性吗啡镇痛耐受模型的制备 建模成功的胫骨癌痛大鼠于手术后21 d连续皮下注射盐酸吗啡注射液(10 mg/kg,2次/d,间隔12 h,共9 d),制做吗啡镇痛耐受模型;隔天测定痛阈,以监测大鼠痛阈的变化和有无吗啡镇痛耐受发生。
1.4 分组及给药
对癌痛吗啡耐受大鼠(即手术后30 d)进行鞘内置管,将上述癌痛大鼠模型随机分为4组,对照组(F组):鞘内注射0.9%生理盐水10μL,1次/d;氯胺酮组(G组):鞘内注射氯胺酮注射液25μg(10μL),1次/d;吗啡组(H组):皮下注射吗啡10 mg/kg,2次/d;氯胺酮联合吗啡组(I组):皮下注射吗啡10 mg/kg,2次/d,鞘内注射氯胺酮25μg(10μL),1次/d。
1.5 监测指标及方法
癌痛模型术前1日至实验37日通过间断监测辐射热痛阈观察疼痛行为学的变化。
免疫组织化学染色方法和固相夹心法酶联免疫吸附方法—实验进行到第37 d时,最后一次给大鼠注药后,等待1 h,以断头法立即处死大鼠,摘取大鼠腰4到腰6脊髓节段,取下约2 cm长脊髓,取1 cm脊髓将上述组织即刻浸泡于浓度为4%多聚甲醛液固定24 h,用免疫细胞化学(IH)染色法检测SP含量。将余留1 cm脊髓组织置于液氮中保存,取材结束后将其余脊髓标本放置于温度为-80℃冰箱保存,用ELISA法检测脊髓BK含量。
1.6 统计学方法
2 结果
2.1 组织病理学改变
癌痛模型建立成功的大鼠8 d后,经HE染色可见左侧胫骨骨髓腔内及骨小梁间出现较多形状改变、多个细胞核的肿瘤细胞,骨小梁组织结构未出现改变;14 d观察到骨髓腔上述肿瘤细胞有所增加,并且癌细胞绝大多数表现活跃,X线显示骨小梁遭到广泛侵袭,骨皮质受破坏后变薄,其周围可见较多编织骨;37 d经HE染色后,大量肿瘤细胞充斥在骨髓腔内,中央大部分组织已退变坏死,骨髓腔边缘肿瘤细胞表现活跃。肿瘤组织表现为向外生长造成更大范围的骨皮质侵袭、破坏(见图1)。

图1
2.2 癌痛大鼠模型X线检查
患肢X线显示骨质破坏明显,并且随时间延长骨破坏程度增加。建模后10 d注射部位松质骨表现为局限的低密度缺如影像;第20 d骨损害逐渐严重,骨皮质完全破坏,出现更大面积的病损,2只大鼠已发生病理性骨折(见图2)。
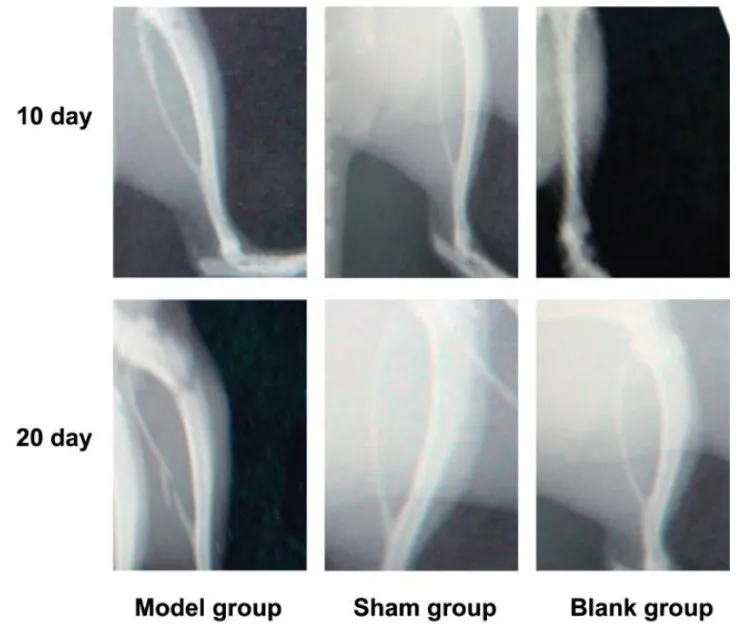
图2
2.3 大鼠痛阈值比较
癌痛大鼠模型(B组)痛阈值与空白对照组(A组)大鼠和假手术组(C组)大鼠比较差异有统计学意义(P<0.05),即癌痛大鼠模型痛阈值低于正常大鼠和假手术组大鼠(见图3)。用药处理前C组、G组、H组及I组间痛阈值差异无显著统计学意义(P>0.05),用药7 d后痛阈比较差异有统计学意义(P<0.05)。其中I组痛阈显著低于F组、H组和G组(P<0.05)(见图4)。
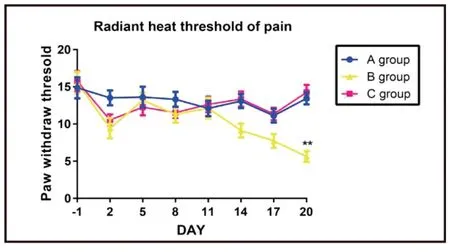
图3

图4
2.4 缓激肽表达影响
F组、H组、G组及I组与A组缓激肽表达水平比较差异均有统计学意义(P<0.05)。F组与G组缓激肽表达水平比较差异无统计学意义(P>0.05);F组与H组缓激肽水平比较差异无统计学意义(P>0.05);I组和H组比较,缓激肽表达水平显著下降,差异有统计学意义(P<0.05)(见图5)。
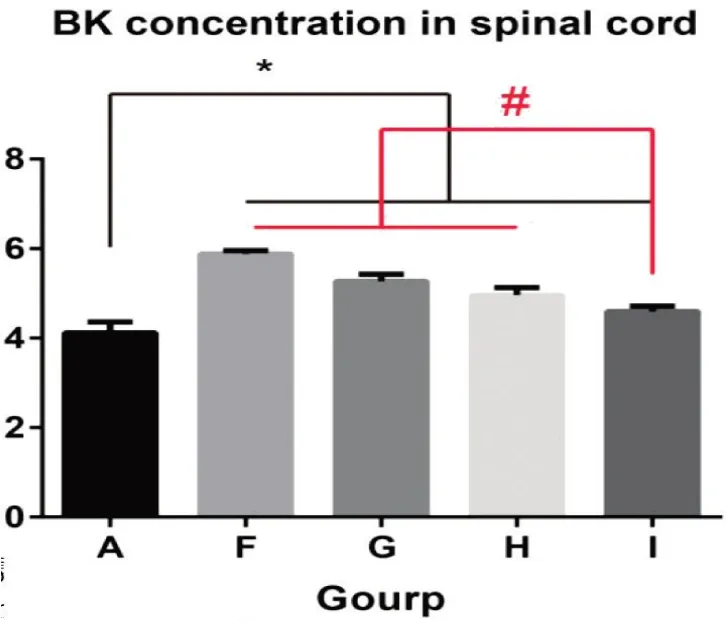
图5
2.5 大鼠脊髓SP表达变化
F组在3个实验动物组中的阳性反应最大,阳性指征的黄色颗粒呈密集分布。I组脊髓背角Ⅰ-Ⅱ层突触素免疫阳性产物表达比H组明显减少。用IPP图像分析软件检测,结果显示I组脊髓背角SP平均光密度值明显低于其他3组[I组(0.02±0.03)、F组(0.25±0.02)、G组(0.21±0.02)、H组(0.22±0.03),P<0.05](见图6)。

图6
3 讨论
癌痛多指癌症本身、因癌症引发的其他病变以及治疗癌症所引起的疼痛,作为癌症患者最常见晚期并发症,约38%~56%患者终末期发生中重度癌痛,其中10%~20%发生难治性癌痛。晚期的骨转移性癌痛不仅在生理上给患者带来痛苦,而且在心理上给患者带来极大的不良影响,使患者在癌症晚期极其痛苦,丧失对生活的希望和信心。阿片类止痛药是“第三阶梯”缓解癌痛的首选药物,也是WHO推荐控制中重度癌痛的主要用药。吗啡一直被公认为是最有效的、最基础的抗癌止痛剂。但无论是口服、静脉还是其他方式给药,单一、长期应用可引起机体耐受,甚至部分患者产生依赖等一系列不良反应[6]。近年来有临床报道指出,常规给予阿片类镇痛药的同时复合低剂量氯胺酮可有效减低阿片类药物耐药性的发生。同时证实小剂量氯胺酮可以有效降低吗啡耐受性的产生,但至今具体机制尚未明确定论[7,8]。本实验通过给予吗啡耐受癌痛大鼠模型鞘内注射低剂量氯胺酮,并观察产生的效果影响,并对其可能存在的机制进行研究,希望可以更好地指导临床上对于骨癌痛的治疗。
癌痛中骨癌痛最常见、显著、典型;其次,骨癌痛大鼠模型也是成功率最高、疼痛部位最为稳定、行为学改变最接近人类改变的动物模型[9,10]。因此,本研究拟定骨转移性癌痛大鼠模型作为研究对象。参照既往癌痛大鼠模型制备基础上,我们选用与本研究实验动物同源的MADB-106乳腺癌细胞进行胫骨癌痛大鼠模型制备。造模成功后分别从病理组织、X线影像表现及疼痛阈值等几个角度进行骨癌模型评价。证实MADB-106乳腺癌细胞具备大鼠胫骨建立骨癌痛模型可行性且造模成功率也得到了显著的提高。
氯胺酮(Ketamine)是苯环己哌啶(Phencyclidine)的衍生物,作为临床常用静脉麻醉药物代表,不同剂量下亲和多种受体(阿片受体)与离子通道(钠钾离子通道),对不同脑区多种关键分子、多种基本神经活动功能存在广泛影响而产生多样药理作用[11]。鞘内给药的优势是使得药物迅速在脑脊液中扩散开来以获得有效的血药浓度[12]。Borgbjerg等[13]证实小剂量鞘内给药不仅无组织学损伤亦可使其发挥有效作用,同时避免大剂量用药产生的分离麻醉、精神异常等氯胺酮副反应。Fisher等[14]亦提倡鞘内或硬膜外氯胺酮给药。因此,我们通过鞘内小剂量注射氯胺酮(<1 mg/kg)方式进行给药干预,以疼痛阈值及自由行走痛行为学指标作为研究观察指标。结果证实单纯鞘内给予小剂量氯胺酮虽然有止疼效果,但因其维持时间较短,故不建议以此方法给药。氯胺酮干预组吗啡耐受大鼠模型镇痛作用较慢性吗啡耐受模型组镇痛作用存在统计学意义,证实二者联合应用可增强镇痛作用且一定程度缓解了吗啡用药产生的耐受性。这一研究与Schmid等[15]的实验结果相同,即鞘内小剂量氯胺酮能够降低吗啡耐受,增强吗啡对躯体和内脏的止疼效果。众所周知,吗啡通过与阿片受体结合,对腺苷酸环化酶-环磷酸腺苷(AC-cA MP)信号转导通路产生抑制作用而发挥镇痛效应。长期吗啡治疗使机体产生一系列适应性改变,如阿片类受体出现数量降低、内化、与Gi蛋白脱耦联及环磷酸腺苷(cAMP)信号转导系统的上调及超敏等磷酸化反应,最终引起参与疼痛通路传导中重要缓激肽与肿瘤细胞表面B2受体结合使胞质内产生高浓度Ca2+,激活NOS产生NO激活鸟苷酸环化酶,产生高浓度cGMP引起机体耐受[16,17]。氯胺酮作为少有的用于治疗复杂的区域性疼痛综合征(comp lex regional pain syndrome,CRPS)的有效药物,镇痛作用是广受临床认可的。但其缓解疼痛的机理较为复杂,目前报道较多的一方面通过与阿片受体相互作用实现镇痛作用[18]。因此可认为以上机制研究为氯胺酮增强吗啡耐受癌痛大鼠模型镇痛作用提供了理论依据。同时有研究指出长期应用吗啡cAMP/PKA通路上调使得NMDA受体磷酸化及表达量明显上调,氯胺酮本身为NMDA受体拮抗剂,因此,我们认为抑制NMDA受体发挥作用也是其吗啡耐受主要机制之一[19]。另一方面作为NMDAR阻断剂,有报道指出其可通过干预慢性痛中枢(即脊髓及更高级中枢神经系统)敏感化过程实现镇痛作用[20]。研究表明引发疼痛的关键是中枢神经系统敏化和外周神经系统的超敏反应[21]。我们通过观察氯胺酮干预组脊髓P物质及缓激肽含量表达发现明显低于单纯吗啡耐受癌痛大鼠模型。脊髓SP是主要的痛觉信号传递物质,由背根神经节中的神经元构成,终末端作用在脊髓后角及三叉神经脊束神经核尾侧亚核。氯胺酮作用于后激活NMDA受体拮抗剂对疼痛信息疼痛传递起到负性调控作用从而减缓吗啡耐受癌痛大鼠模型疼痛阈值及行为[22]。因此,我们推测氯胺酮通过调节脊髓P物质起到疼痛调节过程。同理,缓激肽释放也受NMDA激活通路影响。因此,我们有理由推测氯胺酮拮抗吗啡耐受可通过对脊髓P物质及缓激肽释放调节辅助吗啡镇痛作用。本研究实验结果显示,C组、K组、M组及K+M组与Control组的缓激肽水平比较,差异均有统计学意义。K+M组和M组比较,缓激肽表达水平表现为明显下调。相关分析软件检测表明K+M组脊髓背角SP平均光密度值显著低于其余组。以上结果表明,缓激肽和脊髓SP物质可以用来评价吗啡耐受癌痛大鼠模型鞘内氯胺酮联合吗啡的镇痛效果。
综上所述,吗啡耐受癌痛大鼠模型鞘内氯胺酮联合吗啡作用可以增强吗啡抗击癌痛作用,同时减轻吗啡引起耐受及戒断反应,其中,以脊髓P物质及缓激肽水平表达评价其镇痛效应具有可行性。
