柴胡皂苷A减轻大鼠自身免疫性甲状腺炎抑制NLRP3炎症小体激活
2022-09-18潘翱陈静赖舒
潘翱,陈静*,赖舒
(重庆市九龙坡区人民医院药剂科,重庆 400050)
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是获得性甲状腺功能减退的主要原因,占所有自身免疫性疾病的30%[1]。AIT的特征是淋巴细胞浸润导致甲状腺滤泡破坏。在临床实践中,AIT的治疗主要依赖于非特异性抗甲状腺药物、免疫抑制剂和抗炎剂,然而疗效不佳和副作用明显等缺点限制了这些药物的临床应用[2],因此,迫切需要新的治疗方法。
考虑到中药的疗效、低副作用和低成本的特点,中药是潜在的治疗AIT的一种替代疗法。柴胡皂苷A(saikosaponin A, SSa)来源于柴胡,具有抗炎、抗氧化和调节免疫的作用[3],可能也对AIT有治疗作用。几十年来,实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis, EAT)模型已被证明是研究AIT的理想模型,一直被用来模拟人类AIT[4]。因此,本研究通过注射佐剂乳化的猪甲状腺球蛋白(porcine thyroglobulin, pTG)和摄入过量碘建立EAT大鼠模型,然后给予SSa干预,研究SSa对AIT的影响并分析其初步的机制。
材料和方法
1 试剂
SSa(HPLC≥98%)购自成都普非德生物技术有限公司;pTG购自武汉纯度生物科技有限公司;弗氏完全佐剂(Freund’s complete adjuvant, FCA)和弗氏不完全佐剂(Freund’s incomplete adjuvant, FIA)购自德国MERCK公司;HE染色液和DAPI染色液(5 μg/mL)购自北京雷根生物技术有限公司;兔抗Nod样受体热蛋白结构域相关蛋白3(Nod-like receptor pyrin domain containing protein 3, NLRP3)、兔抗凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)、兔抗裂解胱天蛋白酶-1(Cleaved Caspase-1)(Ala317, p10)和兔抗白细胞介素‐1β(interleukin‐1β, IL‐1β)一抗购自美国Affinity公司;羊抗兔IgG-HRP和羊抗兔IgG-SAlexa Fluor 488购自北京索莱宝科技有限公司;生物素标记的羊抗兔IgG和链霉亲和素-过氧化物酶工作液购自北京中杉金桥生物技术有限公司;甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)、促甲状腺激素(thyroid stimulating hormone, TSH)、游离三碘甲腺原氨酸(triiodothyronine, T3)、肿瘤坏死因子α(tumor necrosis factor‐α, TNF‐α)和白细胞介素-6(interleukin-6, IL-6)等大鼠酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒购自江苏酶免实业有限公司。
2 实验动物和分组处理
24只6~7周龄雌性SD大鼠(体重180~200 g)购自重庆医科大学实验动物中心[SCXK(渝)2018-0003]。将大鼠置于特定的无病原体条件下饲养,并随机分为3组:对照组、EAT组、EAT+SSa组,每组8只。根据文献[5]所述方法进行诱导EAT大鼠模型,除对照组外,EAT+SSa组和EAT组的大鼠通过在多部位(背部、腹部、颈部和足垫部)皮下注射FCA乳化的pTG(100 μg/0.2 mL)进行免疫,第2~6周每周多部位皮下注射注射FIA乳化的pTG(100 μg/0.2 mL)加强免疫一次,期间饮用含0.05%碘化钠的饮用水;第7~10周每天腹腔注射20 mg/kg SSa[6]或等量生理盐水。对照组在第1~6周每周皮下注射0.2 mL生理盐水,第7~10周每天腹腔注射等量生理盐水。
3 ELISA分析
给药方案结束后,取次日空腹10 h的大鼠的尾静脉血,并分离血清。按照试剂盒说明书步骤,用ELISA法检测血清中TgAb、TPOAb、TSH和T3的水平。
同时,对大鼠进行深度麻醉后并处死,收集甲状腺组织。每只大鼠取0.1 g甲状腺组织,用1 mL无菌生理盐水匀浆后,收集匀浆液并按照试剂盒说明书步骤,用ELISA法检测甲状腺组织中TNF‐α和IL-6的水平。
4 HE染色
将甲状腺组织用4%多聚甲醛固定后,包埋在石蜡中,然后制备4 μm厚的切片。切片脱蜡至水后,用HE对甲状腺组织切片进行染色,并按照Chen等[7]方法对EAT严重程度进行定量评分,用1~5的等级评分来评估EAT的严重程度:1分,一个或几个浸润病灶,覆盖少于25%的腺体;2分,10-20个细胞浸润灶,覆盖25%的腺体;3分,25%~50%的腺体被浸润;4分,50%~75%的腺体被浸润的炎性细胞破坏;5分,甲状腺腺体完全破坏。
5 免疫组织化学染色
取4 µm厚的石蜡包埋的甲状腺组织切片,依次经脱蜡、再水化、3% H2O2处理10 min后,将组织切片浸入柠檬酸缓冲液并在微波炉中90 ℃至98 ℃下加热12 min来修复抗原。切片用10%山羊血清封闭30 min,然后用TNF‐α一抗(1:200)4℃孵育过夜,漂洗后加入生物素标记的羊抗兔IgG(1:200)二抗,37 ℃孵育30 min;漂洗后加入链霉亲和素-POD过氧化物酶(1:200)37 ℃孵育30 min。漂洗后进行DAB显色,然后用苏木精复染。切片在在光学显微镜(BX53,OLYMPUS,日本)下观察并拍照。
6 免疫荧光染色
取4 µm厚的石蜡包埋的甲状腺组织切片,依次经脱蜡、再水化、3% H2O2处理10 min后,抗原修复后,将切片与NLRP3一抗(1:500)在4 ℃孵育过夜,漂洗后,加入羊抗兔IgG-SAlexa Fluor 488(1:500)37 ℃避光孵育1 h。漂洗后,用DAPI复染并在荧光显微镜(TE2000-E,尼康,日本)下观察并拍照。
7 Western blot
用RIPA提取甲状腺组织中蛋白,然后用BCA法将蛋白定量后,取等量的蛋白(10 µL样品中含30 µg蛋白)在10% SDS-PAGE上分离并转移到聚偏氟乙烯膜上;用5%牛血清白蛋白封闭蛋白转移膜30 min,并在4 ℃下与NLRP3(1:1000)、ASC(1:1000)、Cleaved Caspase-1(1:1000)和IL‐1β(1:1000)和GAPDH(1:5000)分别孵育过夜;TBST漂洗膜,室温下与羊抗兔IgG-HRP(1:1000)孵育60 min;TBST漂洗膜,用化学发光底物试剂显色并通过化学发光蛋白印迹成像仪(上海易孛特光电技术有限公司)成像并测定条带光密度值。
8 统计学方法
所有数据均表示为均数±标准差(x±s)。用GraphPad Prism 9软件进行统计并输出统计柱状图。多组数据之间差异使用单向方差分析,组间均数两两比较用Bonferroni事后检验。P<0.05被认为差异具备统计学意义。
结 果
1 SSa降低EAT大鼠的自身免疫性甲状腺炎严重程度
HE染色显示,对照组甲状腺组织正常,甲状腺滤泡较大且滤泡腔内充满胶质,滤泡上皮和滤泡间未见单核细胞浸润;EAT组表现为中重度甲状腺炎,许多甲状腺滤泡破坏、萎缩、滤泡上皮细胞崩解成碎屑聚集在滤泡腔,部分滤泡上皮细胞和滤泡间可见明显的炎性细胞浸润,部分未见炎性细胞浸润的滤泡腔内胶质变少,另外部分间质间可见纤维组织增生,甲状腺炎严重程度评分显著高于对照组;EAT+SSa组大鼠甲状腺炎的严重程度评分较EAT组显著降低,组织学损伤也得到一定的改善(包括炎性细胞浸润减轻,滤泡形态转良,泡腔内胶质增多)(图1)。
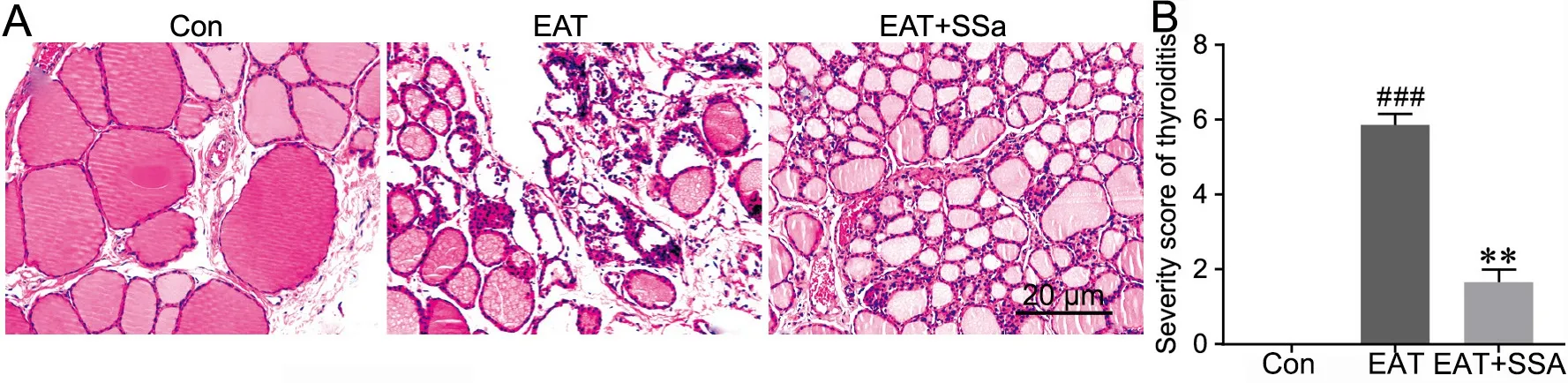
图1 SSa减轻EAT大鼠自身免疫性甲状腺炎的病理严重程度。A,HE染色观察大鼠甲状腺炎的组织学变化;B,甲状腺炎严重程度评分统计学分析:与Con组相比,###P<0.001;与Model组相比,**P<0.01;n=8Fig. 1 Alleviation effects of SSa on the severity of autoimmune thyroiditis in EAT rats. A, HE staining to observe the histological changes of rat thyroiditis; B, statistical analysis for severity score of thyroiditis. ###P<0.001 vs Con group; **P<0.01 vs Model group; n=8
2 SSa降低EAT大鼠血清TPOAb、TgAb和T3水平
ELISA检测显示:与甲状腺炎严重程度评分结果相似,与对照组相比,EAT组大鼠血清TPOAb、TgAb和T3显著升高,EAT+SSa组大鼠血清TPOAb、TgAb、T3水平较EAT组显著降低(图2)。

图2 SSa对EAT大鼠血清TPOAb(A)、TgAb(B)和T3(C)水平影响的ELISA检测与统计学分析。与Con组相比,###P<0.001;与EAT组相比,**P<0.01;n=8Fig. 2 ELISA detection and statistical analysis for the effect of SSa on the levels of TPOAb (A), TgAb (B) and T3 (C) in the serum of the EAT rats.###P<0.001 vs Con group; **P<0.01 vs EAT group; n=8
3 SSa降低EAT大鼠甲状腺组织中的炎性细胞因子水平
对甲状腺组织进行免疫组织化学染色显示:对照组大鼠的甲状腺组织无TNF‐α免疫反应性;EAT组TNF‐α主要表达于滤泡上皮,呈强阳性;EAT+SSa组大鼠甲状腺组织中TNF‐α免疫反应性强度和分布范围均较EAT组明显减少(图3A)。ELISA分析显示,EAT+SSa组大鼠的甲状腺组织中TNF‐α和IL-6水平均显著低于EAT组(图3B)。
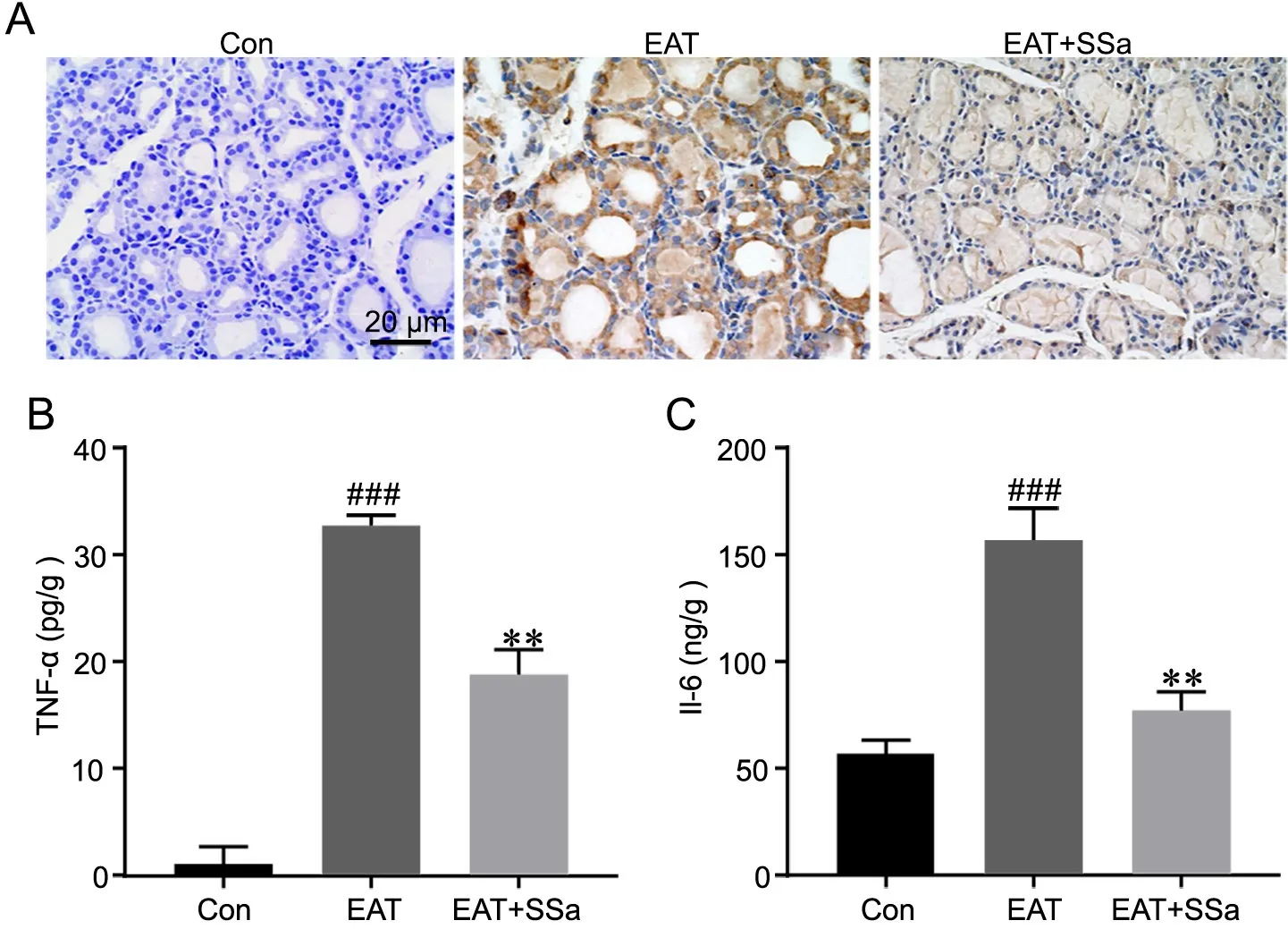
图3 SSa对EAT大鼠甲状腺组织中炎性因子表达的影响。A,甲状腺组织中TNF‐α表达水平的免疫组织化学检测。B,甲状腺组织中TNF‐α水平ELISA检测与统计学分析;C,甲状腺组织中IL-6水平的ELISA检测与统计学分析;与Con组相比,###P<0.001;与EAT组相比,**P<0.01;n=8Fig. 3 Effect of SSa on the expression levels of inflammatory factors in the thyroid tissues of EAT rats. A, immunohistochemical examination of TNF‐α expression in the thyroid tissues; B,ELISA detection and statistical analysis for the TNF‐α level in rat thyroid tissues; C, ELISA detection and statistical analysis for the IL-6 level in rat thyroid tissues; ###P<0.001 vs Con group; **P<0.01 vs EAT group; n=8
4 SSa抑制EAT大鼠甲状腺NLRP3炎症小体激活
免疫荧光染色和Western blot检测SSa对炎症体激活的作用显示:与对照组相比,EAT组大鼠甲状腺中NLRP3的免疫染色信号增加,NLRP3、ASC、Cleaved caspase-1和IL‐1β水平显著升高,而EAT+SSa组上述蛋白表达显著低于EAT组(图4),表明提示EAT大鼠甲状腺中NLRP3炎症小体被激活,SSa能抑制EAT大鼠甲状腺中NLRP3炎症小体的激活。
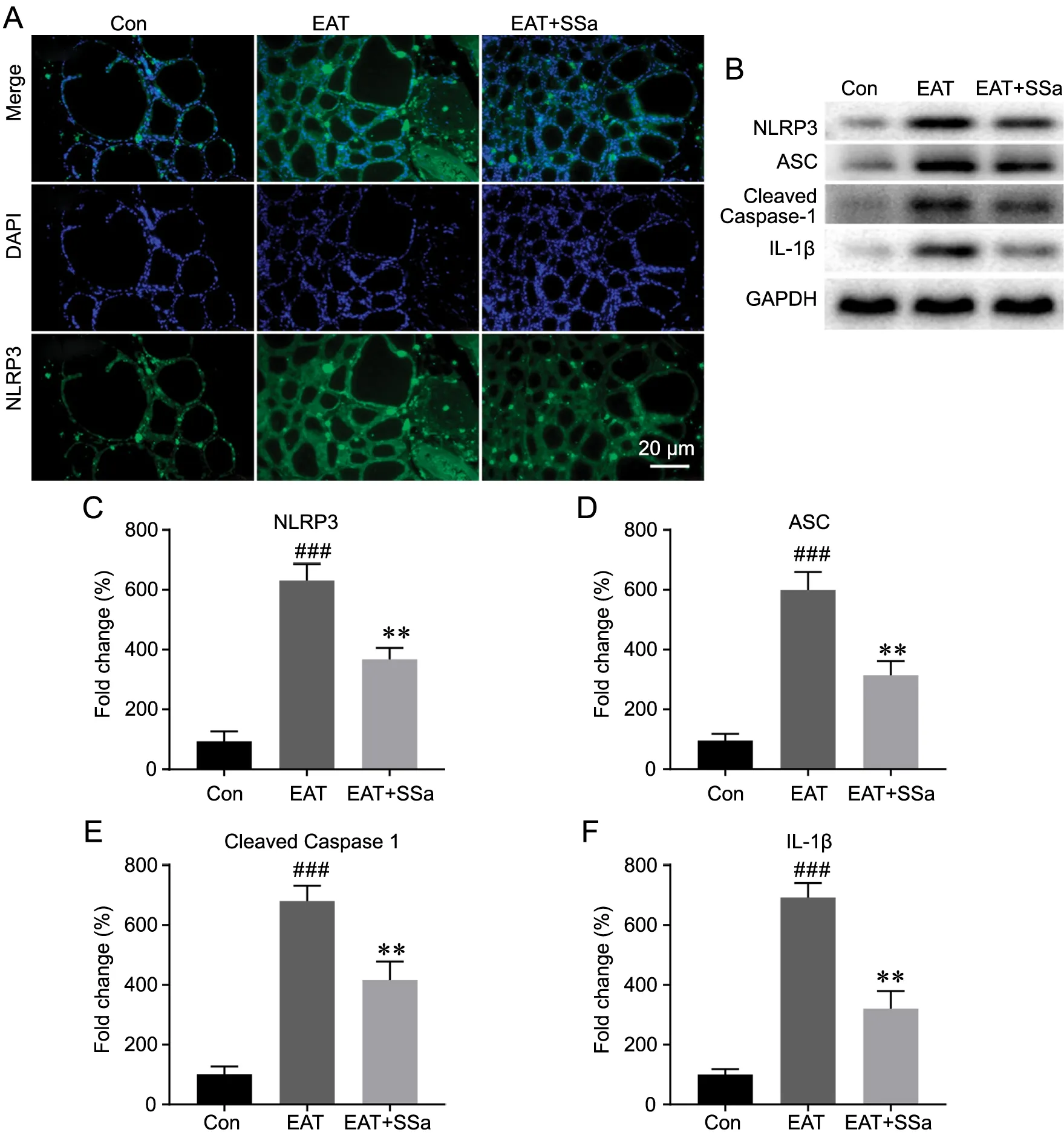
图4 SSa对EAT大鼠甲状腺组织中NLRP3炎症小体相关蛋白表达的影响。A,甲状腺组织NLRP3免疫荧光染色代表性图像。B,甲状腺组织中NLRP3、ASC、Cleaved Caspase-1和IL‐1β表达水平的代表性Western blot检测结果;C—F,甲状腺组织中NLRP3(C)、ASC(D)、Cleaved Caspase-1(E)和IL‐1β(F)相对表达水平的统计学分析;与Con组相比,###P<0.001;与EAT组相比,**P<0.01;n=8Fig. 4 Effect of SSa on the expression of NLRP3 inflammasome associated proteins in the thyroid tissues of the EAT rats. A, representative images of thyroid NLRP3 immunofluorescence staining; B, Western blotting to detect the expression levels of NLRP3, ASC, Cleaved Caspase‐1 and IL‐1β in the thyroid tissues; C to F, statistical analysis for the relative expression levels of NLRP3 (C), ASC (D), Cleaved Caspase‐1 (E) and IL‐1β (F) in the thyroid tissue. ###P<0.001 vs Con group; **P<0.01 vs EAT group; n=8
讨 论
AIT也称为桥本氏甲状腺炎,是最常见的自身免疫疾病之一,是成人甲状腺功能减退的头号病因[1]。EAT模型已被证明是研究AIT的理想模型[4]。本研究通过皮下注射佐剂乳化的pTG联合过量碘摄入建立EAT大鼠模型,证明了SSa能减轻EAT大鼠的甲状腺滤泡损伤并降低血清中的TgAb、TPOAb、TSH和T3浓度,提示SSa在治疗AIT的潜在有效性。
越来越多的研究显示NLRP3炎症小体在AIT的发病和发展中起着至关重要的作用。在AIT患者甲状腺组织中中观察到NLRP3、ASC、Caspase-1、IL‐1β和IL-18的mRNA和蛋白表达上调[8,9]。过量碘摄入通过激活甲状腺滤泡细胞中的NLRP3炎症体而促进AIT的发展[9]。一项研究探讨了炎症小体与AIT之间的联系,并揭示了AIT患者甲状腺组织中NLRP3和IL‐1β水平与血清TPOAb和TgAb水平呈正相关[10]。另外,已有研究表明下调NLRP3/Caspase-1通路可改善大鼠的EAT[11]。因此,本研究中关注NLRP3炎症体的作用,发现EAT大鼠甲状腺中NLRP3、ASC、Cleaved Caspase1和IL‐1β蛋白表达增加,提示NLRP3炎症的激活,而SSa成功地逆转了这些蛋白质的表达,反映出SSa在EAT中的有益效果至少部分归因于抑制了甲状腺中的NLRP3炎症。
总之,目前的研究表明,SSa治疗对EAT大鼠的自身免疫性甲状腺炎有显著的有益作用,这可能是由于其抑制了EAT大鼠甲状腺肿NLRP3炎症小体的激活。另外,本研究为SSa治疗自身免疫性甲状腺炎提供了临床前证据。
