2型糖尿病小鼠模型建立影响因素研究
2022-09-17代振振张义堡崔伟豪袁海峰刘颖徐宏伟
代振振,张义堡,崔伟豪,袁海峰,刘颖,徐宏伟
(1 青岛大学医学部基础医学院,山东 青岛 266021; 2 上海交通大学医学院附属新华医院儿童骨科)
近年来,随着人口老龄化及人们生活水平的提高,糖尿病的患病率逐年升高[1-2]。国际糖尿病联合会(IDF)的统计数据显示,2014年我国糖尿病病人达到9 629万,我国已成为全球糖尿病患病人数最多的国家,其中2型糖尿病占93.7%[3]。2型糖尿病发病机制复杂,至今仍未完全阐明。因此,建立理想的2型糖尿病动物模型,已经成为深入研究2型糖尿病发病机制、药物治疗、预防及其并发症转归等的重要途径和手段[4]。鼠类因具有经济易得、便于饲养等优势,成为制备糖尿病动物模型的优先选择。高糖高脂饮食联合链脲佐菌素(STZ)或四氧嘧啶注射,是国内外学者建立2型糖尿病鼠类模型广泛采用的方法,但对于高脂饮食饲喂时间、STZ使用剂量等目前尚无统一的操作标准,这将对2型糖尿病的深入研究产生不利影响[5-6]。本研究采用高糖高脂饮食联合STZ腹腔注射方法建立2型糖尿病小鼠模型,并对模型建立影响因素进行系统观察。
1 材料与方法
1.1 主要试剂和仪器
血清胰岛素酶联免疫吸附试验(ELISA)检测试剂盒和STZ均购自北京Solarbio科技有限公司,肝糖原检测试剂盒购自南京建成生物工程研究所,柠檬酸和柠檬酸钠均为国产分析纯;高糖高脂饲料为自行配制(猪油10.0%,蔗糖20.0%,蛋黄粉15.0%,胆固醇1.2%,猪胆盐0.2%,鼠维持饲料53.6%,均为国产);Accu-Chek Performa罗氏卓越血糖仪和血糖检测试纸(上海罗氏检测产品有限公司),ELx 808型酶标仪(美国BioTek公司),7600型全自动生化分析仪(日本日立公司)。
1.2 10 g/L STZ溶液配制
称取柠檬酸2.10 g,加入双蒸水100 mL中配成A液;称取柠檬酸钠2.94 g,加入双蒸水100 mL中配成B液。将A液与B液以1∶1混合制备柠檬酸缓冲液,调节pH值至4.2~4.4。称取1.0 g STZ,加入柠檬酸缓冲液至100 mL溶解。配好的溶液置冰上保存,在30 min内注射完毕。
1.3 模型建立与分组
取昆明种小鼠60只,体质量(26±2)g,购自山东鲁抗医药股份有限公司,动物合格证号为SCXK(鲁)20130001。其中雄性40只,随机分为4组,包括正常对照组(A组)和低、中、高剂量STZ(60、90、120 mg/kg)组(B~D组);雌性20只,随机分为2组,包括正常对照组(E组)和高剂量STZ(120 mg/kg)组(F组)。普通饲料适应性喂养3 d后,每笼随机取5只小鼠,禁食不禁水12 h,尾静脉取血检测空腹血糖,作为该批次小鼠的基础血糖值。正常对照组(A、E组)小鼠继续饲喂普通饲料,不同剂量STZ组(B、C、D、F组)小鼠改为饲喂高糖高脂饲料,喂养30 d后,不同剂量STZ组小鼠腹腔注射相应剂量的STZ溶液,正常对照组小鼠腹腔注射柠檬酸缓冲液。继续喂养1周后,禁食不禁水12 h,再次检测尾血血糖,血糖值≥16.7 mmol/L即为建模成功。对未成模小鼠再次注射同剂量的STZ,1周后测定空腹血糖,注射3次STZ仍未成模者视为未成模。统计各组小鼠成模率及死亡率。
1.4 观察指标及其检测方法
对成模小鼠(模型组)持续观察6周,分别于第2、4、6周末测定空腹血糖水平,并于第6周末进行糖耐量分析。模型组小鼠喂养6周后,禁食12 h,摘取眼球取眼眶血,检测血清脂质代谢、胰岛素、糖化血红蛋白(HbA1c)水平;迅速摘取肝脏,检测肝糖原含量。正常对照组小鼠于相同时间检测上述生化指标。
1.4.1空腹血糖检测 采集尾血,采用罗氏血糖仪测定各组小鼠空腹血糖水平。
1.4.2糖耐量实验 各组小鼠禁食12 h,测定给葡萄糖前(0 h)血糖值,灌胃给予2.5 g/kg葡萄糖,检测小鼠给葡萄糖后0.5、2.0 h血糖值,计算血糖曲线下面积。血糖曲线下面积=[(0 h血糖+0.5 h血糖)×0.5]/2+[(2.0 h血糖+0.5 h血糖)×1.5]/2。
1.4.3血清脂质代谢水平检测 采用全自动生化分析仪检测各组小鼠血清三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)水平,严格按照试剂盒说明进行操作。
1.4.4血清HbA1c和胰岛素水平检测 采用全自动生化分析仪检测各组小鼠血清HbA1c含量,采用ELISA法检测血清胰岛素水平,严格按照试剂盒说明进行操作。计算胰岛素敏感指数(ISI),ISI=Ln 1/(血糖×胰岛素)。
1.4.5肝糖原含量检测 摘取肝脏后制备100 g/L肝组织匀浆,采用比色法检测肝糖原含量,严格按试剂盒说明进行操作。
1.5 统计学分析
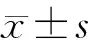
2 结 果
2.1 一般情况
正常对照组小鼠精神状态良好,皮毛顺滑有光泽;模型组小鼠观察6周显示,其皮毛暗淡无光且杂乱,进食进水量及尿量逐渐增多,体质量增长速度较正常对照组有稍微减缓的趋势。
2.2 STZ注射后小鼠成模率及死亡率
雄性小鼠给予剂量60 mg/kg STZ注射3次均未有成模者,亦未见小鼠死亡;雄性小鼠给予剂量90 mg/kg STZ初次注射成模率达到30%,再次注射成模率略有增高,同时出现了小鼠死亡情况;雄性小鼠给予剂量120 mg/kg STZ初次注射成模率即达到80%,但也出现小鼠死亡情况;雌性小鼠给予剂量120 mg/kg STZ初次注射成模率达到40%,再次注射成模率略有增高,同时小鼠死亡率明显升高,达到70%。初次注射时,注射120 mg/kg STZ雄性小鼠成模率明显高于注射120 mg/kg STZ的雌性小鼠(χ2=27.47,P<0.05);第2次及第3次注射时,注射120 mg/kg STZ雌性小鼠死亡率均明显上升,明显高于其他组小鼠(χ2=15.56、26.88,P<0.05),最终累计成模率明显低于注射120 mg/kg STZ的雄性小鼠(χ2=27.99、27.47,P<0.05)。见表1~3。
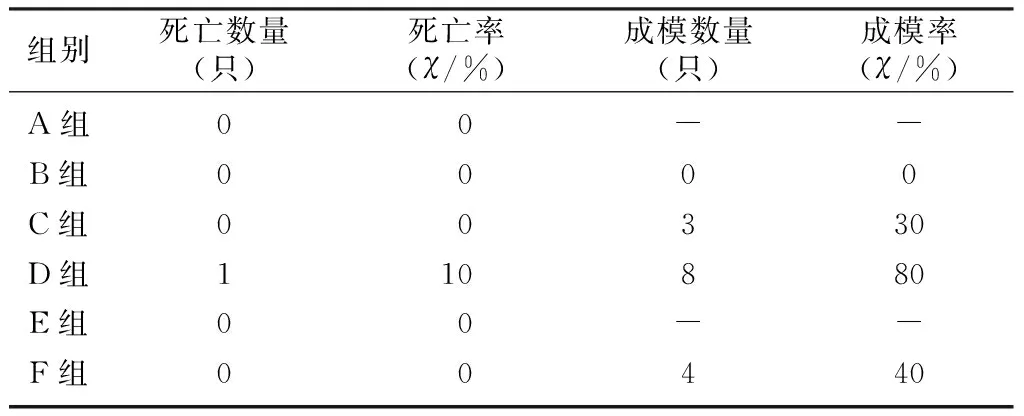
表1 初次注射STZ各组小鼠成模率及死亡率(n=10)
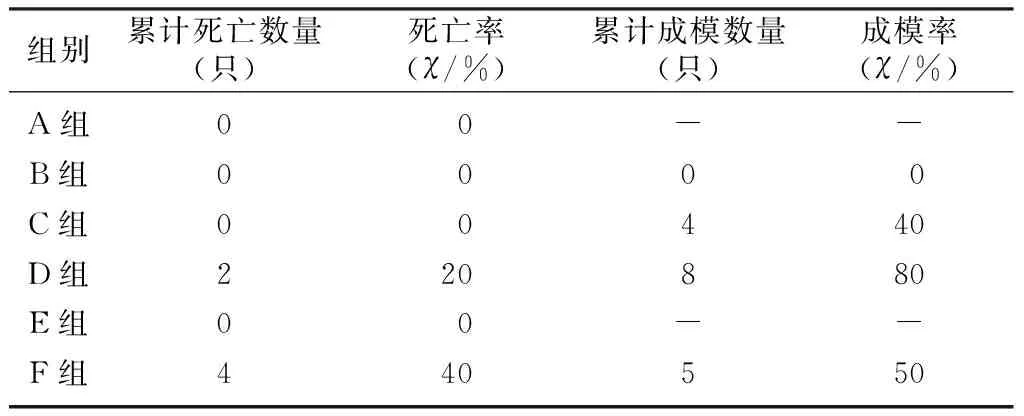
表2 第2次注射STZ各组小鼠累计成模率及死亡率(n=10)
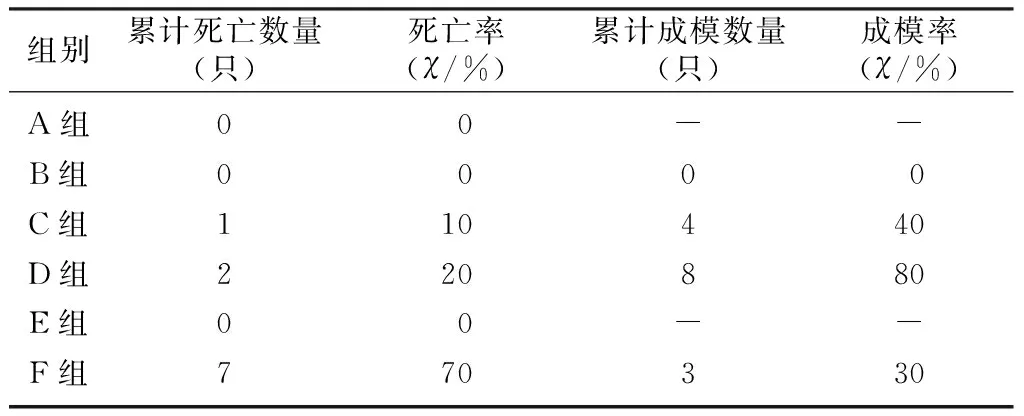
表3 第3次注射STZ各组小鼠累计成模率及死亡率(n=10)
2.3 糖尿病模型小鼠血糖稳定性
雄性及雌性模型小鼠在成模后2、4、6周时的血糖值均稳定在16.7 mmol/L以上,且无明显波动(P>0.05),无自愈情况出现。与同性别正常对照组相比,模型组小鼠在0、2、4、6周时的血糖值明显增高(F=186.31~716.37,P<0.05)。见表4。
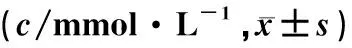
表4 对照组和模型组小鼠血糖水平比较
2.4 糖尿病模型小鼠糖耐量变化
补充葡萄糖0.5、2.0 h后,与正常对照组比较,模型组小鼠血糖峰值显著增高,且下降缓慢,血糖曲线下面积显著增加,糖耐量明显降低,差异具有显著性(F=298.81~600.40,P<0.05)。见表5。
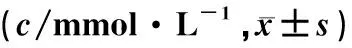
表5 对照组和模型组小鼠糖耐量比较
2.5 糖尿病模型小鼠血清脂质代谢水平变化
与正常对照组比较,模型组小鼠血清TG、TC及LDL-C含量均明显升高,差异均具有显著性(t=4.58~18.16,P<0.05);两组小鼠血清HDL-C水平比较差异无显著性(P>0.05)。见表6。
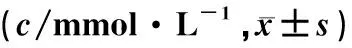
表6 对照组和模型组小鼠的脂质代谢水平比较
2.6 糖尿病模型小鼠血清HbA1c和胰岛素水平以及ISI变化
与正常对照组比较,模型组小鼠血清HbA1c含量明显升高,ISI明显降低,差异均有统计学意义(t=3.79~6.87,P<0.05);而两组胰岛素水平比较差异无显著性(P>0.05)。见表7。
2.7 糖尿病模型小鼠肝糖原含量变化
与正常对照组相比较,模型组小鼠肝糖原含量明显降低,差异有统计学意义(t=6.63、3.79,P<0.05)。见表7。
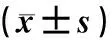
表7 对照组和模型组小鼠HbA1c、胰岛素、ISI和肝糖原水平比较
3 讨 论
2型糖尿病又称为非胰岛素依赖型糖尿病,该病以胰岛素分泌绝对或相对不足及胰岛素抵抗为主要特征,在此基础上建立的诱发性2型糖尿病动物模型得到研究者广泛应用[7]。有研究者利用沙鼠、C57BL/6J小鼠,通过单纯高脂高糖饮食诱导的方法成功建立了2型糖尿病模型,但这类模型由于来源困难、价格昂贵、饲养环境要求高或成模时间长等原因,尚未在国内普及[8-9]。部分学者采用一次大剂量或多次小剂量注射四氧嘧啶及STZ等化学诱导剂的方法,亦成功建立了2型糖尿病动物模型,但由于该类模型发病机制更接近1型糖尿病,近年来已少见应用。目前,高糖高脂饮食联合化学药物诱导成为建立2型糖尿病动物模型的常用方法[4-6]。该类模型不仅具备了人类2型糖尿病的两大特点(胰岛素抵抗及胰岛素分泌障碍),而且大大缩短了成模周期,更有利于2型糖尿病相关研究工作的开展。
本实验采用先喂食高糖高脂饲料再进行STZ腹腔注射的方法成功建立2型糖尿病小鼠模型。为了深入探讨2型糖尿病小鼠模型建立影响因素,本实验对STZ作用剂量、作用次数、作用时间及小鼠不同性别等因素对成模率及模型稳定性的影响进行了系统观察。
2型糖尿病的发生与糖脂代谢紊乱密切相关,肥胖和高能量膳食摄入均可诱发胰岛素抵抗,将大大增加2型糖尿病发病风险[2]。本实验采用含糖量20%、脂肪含量10%的高糖高脂饲料喂食小鼠,结果显示,模型组小鼠血清TG、TC及LDL-C水平均显著高于正常对照组,符合人类2型糖尿病脂质代谢紊乱特点。
四氧嘧啶和STZ均作为特异性胰岛β细胞毒性药物用于2型糖尿病动物模型的建立。其中STZ是一种氨基葡萄糖-亚硝基脲,在结构上与葡萄糖分子具有较高的相似性,能被胰岛β细胞中葡萄糖转运蛋白2(GLUT2)特异性识别并转运至β细胞中。STZ是一种DNA烷化剂,可特异性诱导胰岛β细胞发生DNA损伤等毒性反应,导致胰岛素分泌不足或生物学活性受损[4]。与四氧嘧啶相比,STZ对β细胞的毒性作用更温和,在建立2型糖尿病动物模型过程中被广泛采用[10-11]。本实验在高糖高脂饲料喂食小鼠30 d后,分别给予60、90、120 mg/kg STZ腹腔注射,结果表明,60、90 mg/kg STZ注射不易形成2型糖尿病模型,而120 mg/kg STZ较为适宜用于2型糖尿病模型建立。各剂量STZ经多次注射,成模率均未见明显提高,但小鼠死亡率却有所增加,提示2型糖尿病模型建立可能主要与初次注射剂量有关。此外,在糖尿病模型实验动物性别的选择方面,本实验结果表明,雄性小鼠要优于雌性小鼠,与相关文献报道一致[12]。VITAL等[13]的研究结果显示,与雄性糖尿病小鼠相比,在相同的生长发育阶段,雌性糖尿病小鼠胰腺组织的紊乱更为明显,从而造成了更严重的机体功能学改变及代谢紊乱,这可能是在相同的造模条件下,雌性小鼠死亡率明显高于雄性小鼠的原因之一。本实验结果还表明,成模后糖尿病小鼠模型稳定且持久,不会出现自愈情况。
在2型糖尿病发病过程中,相关生化指标会出现一定变化,临床上以糖耐量明显降低、胰岛素敏感性下降为主,同时HbA1c及肝糖原水平亦发生异常改变[14-17]。其中,HbA1c在体内合成过程相对缓慢且不可逆,其合成速率与红细胞所处环境中糖的浓度呈正比[17]。而肝糖原对机体血糖具有调节作用,其合成和分解受胰岛素控制,当胰岛素分泌不足或发生胰岛素抵抗时,胰岛素对肝糖原的控制能力降低,可导致肝糖原分解增多、含量减少。胰岛素抵抗是2型糖尿病发病重要原因之一[18-19]。ISI是描述胰岛素抵抗程度的重要指标[20],ISI越低,则胰岛素抵抗程度越高。本实验结果显示,与正常对照组比较,成模小鼠糖耐量、ISI和肝糖原含量显著降低,血清HbA1c水平显著升高,均较符合2型糖尿病主要表型特征和发病过程,提示2型糖尿病小鼠模型建立成功。成模小鼠胰岛素水平与正常对照组比较稍有增高,分析原因可能为,喂食高糖高脂饲料后,胰岛素分泌量在基础水平之上,而STZ对胰岛β细胞的杀伤作用温和[11]。虽然成模小鼠胰岛素水平较正常对照组未有显著降低,但ISI却较正常对照组显著降低,表明胰岛素生物活性明显受损。
综上所述,STZ单次注射剂量和小鼠性别对2型糖尿病模型成功建立具有一定影响。选用雄性小鼠,通过高糖高脂饮食联合一次性120 mg/kg STZ腹腔注射方法建立的糖尿病模型,较为符合人类2型糖尿病特点,可用于2型糖尿病的相关研究。
