基于SSU rDNA序列的网状车轮虫群体遗传结构及多样性研究
2022-09-13许治祥唐发辉赵元莙
许治祥 唐发辉 赵元莙
(重庆师范大学生命科学学院,重庆市动物生物学重点实验室,重庆 401331)
车轮虫作为一类外寄生游走类纤毛虫,主要寄生于鱼类、贝类,少数寄生于两栖类和甲壳类等。当其大量感染寄生时,常可致鱼苗或鱼种大批量死亡,是水产养殖中重要病害生物之一[1—6]。车轮虫种类繁多、且广泛分布于世界各地,中国、北美、欧亚大陆、以色列、南非等地均有不同程度的报道[7,8]。早期的车轮虫研究主要集中于形态学描述、地理分布和宿主特异性等方面[9—11]。相较其他纤毛虫而言,车轮虫的分子生物学工作起步较晚,特别是作为寄生类群,且淡水鱼类感染车轮虫时大多为混合感染又无法单克隆培养等诸多因素,在一定程度抑制了车轮虫分子生物学研究往纵深方向发展。即使在组学已应用于诸多生物类群研究的今天,车轮虫的分子生物学研究仍相当滞后,可用分子序列在GenBank中屈指可数,且90%以上的序列集中于核糖体基因的部分序列。
当前,为了对各类动物种质资源的有效保护与利用,运用各种分子标记进行不同动物群体遗传结构及多样性的研究屡见不鲜,尤其在哺乳动物、鸟类、鱼类、昆虫、甲壳动物及贝类中开展工作较多[12—16]。然而对车轮虫而言,GenBank中匮乏的分子数据导致了该类群的群体遗传研究工作难以展开。在原生动物分类系统中,网状车轮虫隶属于纤毛门、寡膜纲、缘毛亚纲、游走目、车轮虫科、车轮虫属[17],是淡水车轮虫中极为常见的种类,也是淡水养殖病害中的高发病原之一,其分子生物学工作的开展仅始于21世纪初,且主要利用当时Gen-Bank中仅有的4条SSU rDNA的车轮虫分子序列聚焦于缘毛类纤毛虫分子系统学的探讨研究[18]。随后的工作则主要是结合形态和分子数据进行网状车轮虫物种的分子鉴定、系统进化及种内分化等相关研究[19—26]。迄今为止,有关网状车轮虫的群体遗传结构及遗传多样性等方面的研究资料几近空白。因此,本工作在现有基础之上,基于近年来对重庆地区不同宿主采集获取的网状车轮虫的所有样本,并结合当前NCBI中已有可用的相关分子数据,对我国分布的网状车轮虫群体的遗传结构,尤其是不同宿主的群体遗传多样性、群体分化、种群历史动态及宿主间的传播机制等方面进行相对深入地研究与探讨,以期补充与完善网状车轮虫遗传多样性的内容,同时为水产养殖中网状车轮虫的流行病学研究提供参考性资料。
1 材料与方法
1.1 样本采集与数据收集
本研究所涉及的网状车轮虫SSU rDNA分子数据共计20条,其中18条样本序列源自本实验室于2 0 1 8—2 0 2 0年分批次采集自重庆地区的鲫(Carassius auratus)与草鱼(Ctenopharyngodon idellus)鳃部,且均已上传GenBank数据库中,具体序列登录号详见表1;其余可用的两条车轮虫SSU rDNA序列(登录号为AY741784与MG198568)来自GenBank,其宿主分别为武汉地区的草鱼(Ctenopharyngodon idellus)与西藏地区的小黄黝鱼(Micropercops swinhonis)。需要说明的是,本研究涉及的分子序列涵盖了目前GenBank中所有可利用的网状车轮虫的SSU rDNA序列,所有网状车轮虫群体样本的具体采集相关信息详见表1。
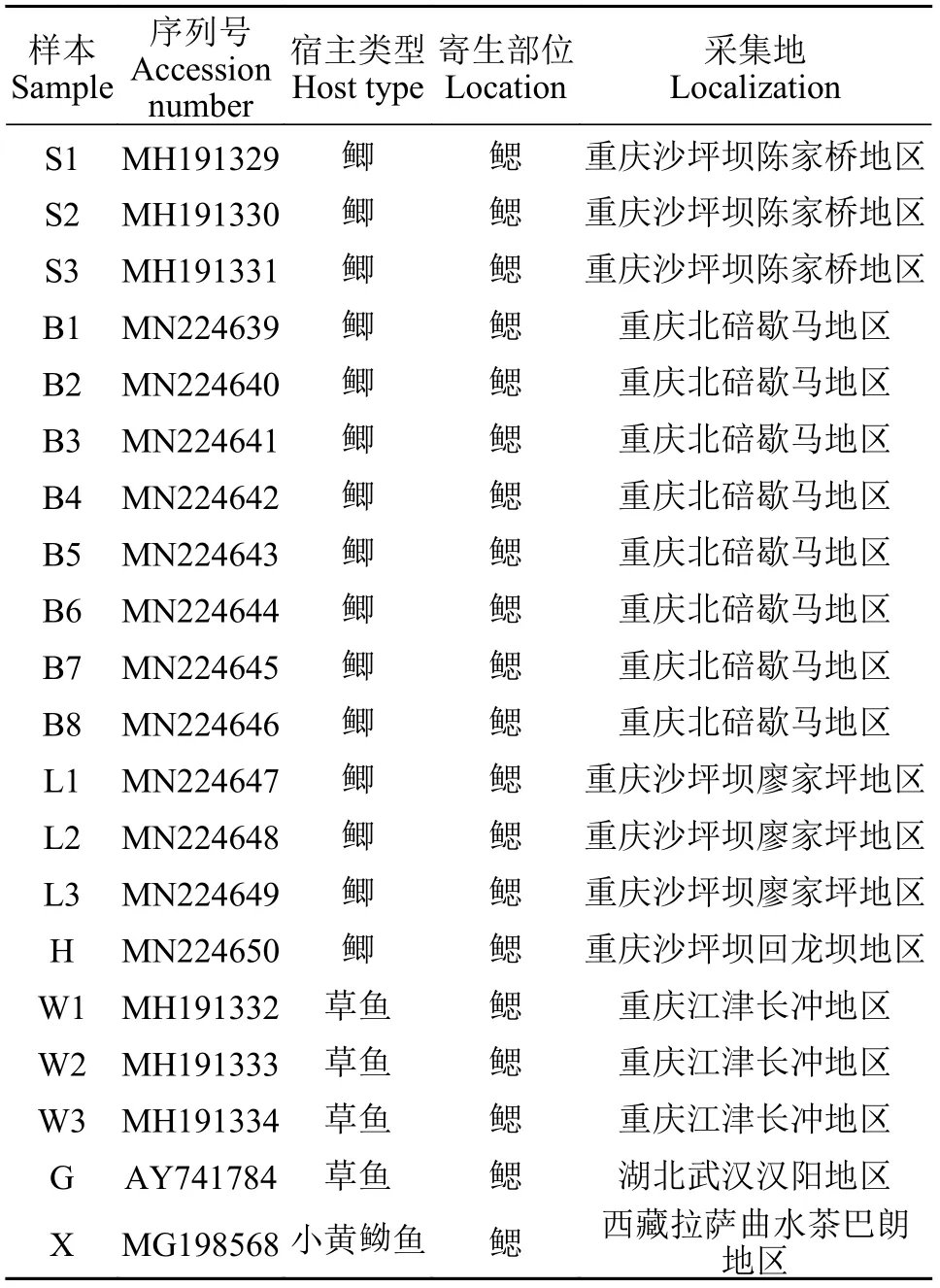
表1 网状车轮虫样本信息表Tab. 1 Sample information sheet of Trichodina reticulata
为了遗传多样性研究及统计分析的便利,本研究将所有群体样本(20份)进行了不同的分组,具体分为5组: 分别为Group A(鲫来源样本,15份)、Group B(草鱼来源样本,4份)、Group C(各地鲤科鱼类: 鲫+草鱼来源样本,19份)、Group D(重庆地区全部样本,18份)与Group E(全部样本,20份)。本文部分图表、相关结果描述及讨论均以此为基准。
1.2 系统发育树的构建
将本研究涉及的2 0条网状车轮虫的S S U rDNA样本序列,通过Bioedit软件进行多重序列比对,然后采用Dna SP软件进行单倍型基因的分析,并以适度车轮虫Trichodina modesta(登录号: GU 906245)为外群,采用PAUP4b10软件进行单倍型ML系统树的构建;使用TreeView软件检查树型的拓扑结构,并借助Photoshop CS6软件完成系统树的绘制。
1.3 核苷酸数据的处理与分析
应用MEGA6软件进行所有序列的多重比对,然后使用Dna SP软件计算分析核苷酸序列的单倍型数目、单倍型多样性、核苷酸多样性、遗传分化指数、基因流和核苷酸单倍型错配分布等数据[27];同时采用Arlequin软件获取Tajima’sD值和Fu’sFs值进行中性检验分析[28];结合Dna SP与Network两个软件对所有样本进行中介网络图的构建及分析。
2 结果
2.1 单倍型组成及中介网络结构分析
本研究所涉及的20个网状车轮虫样本基因序列共有9个单倍型,其中共享单倍型4个,分别为Hap1、Hap2、Hap3和Hap7,其余5个为特有单倍型(表2)。在4个单倍型中,Hap3是最大的共享单倍型,在群体中所占比例达25%;特有单倍型占全部单倍型总数的55.56%;Hap8和Hap9单倍型分别出现在湖北武汉汉阳和西藏茶巴朗地区(表2),所以就目前现有数据来说,Hap8和Hap9暂被视为湖北武汉和西藏地区特有的单倍型。

表2 网状车轮虫单倍型分布情况表Tab. 2 Haplotype distribution table of Trichodina reticulata
单倍型中介网络图整体呈辐射状,单倍型Hap1(重庆地区: 鲫)明显位于网络中央位置而成为主体单倍型,整体网络图明显围绕主体单倍型Hap1向四周辐射。在中介网络图中,共享单倍型Hap7距离Hap1最远,且其宿主为草鱼,显然与其他在重庆地区鲫获得的单倍型不同;Hap4、Hap5、Hap8和Hap9距离Hap1较远,Hap6、Hap2、Hap3与Hap1的距离最近。Hap5、Hap8和Hap9来自假想共同祖先单倍型MV2,且3个单倍型来自不同地区(重庆、武汉、西藏)的不同宿主,即鲫、草鱼和小黄黝鱼(图1)。
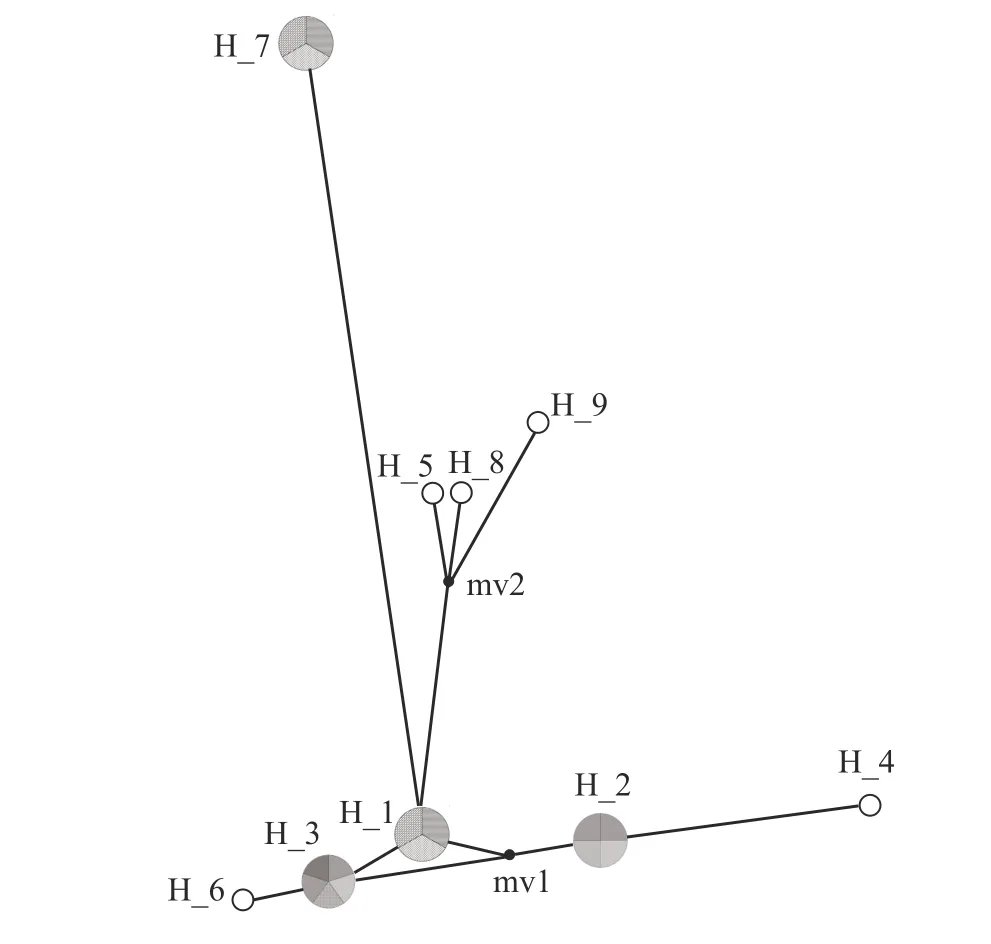
图1 基于网状车轮虫SSU rDNA的单倍型中介网络图Fig. 1 Haplotype mediated network diagram based on SSU rDNA of Trichodina reticulata
2.2 单倍型系统发育树分析
为了更好地了解网状车轮虫不同单倍型群体之间的关系,以适度车轮虫为外群,构建单倍型ML系统发育树。基于ML系统发育树显示(图2):整个系统树聚为两支,Hap2和Hap4单独聚为一支,而其他所有单倍型则另聚为一大支。在大支中,Hap8和Hap9首先聚支,然后与Hap5再聚支,且该支与Hap1和Hap7形成的小支构成姐妹支;然后再与Hap2和Hap4形成的小支再行聚支 (图2)。上述ML系统树结构总体体现出两大特点: 支系的形成既未按地区聚支,也未按宿主进行聚支;树型整体聚支与中介网络图的结构极为一致,即中介网络结构中,距离近的在系统树中几乎聚在一起,如Hap2和Hap4,Hap3和Hap6,Hap1和Hap7,Hap5、Hap8和Hap9。
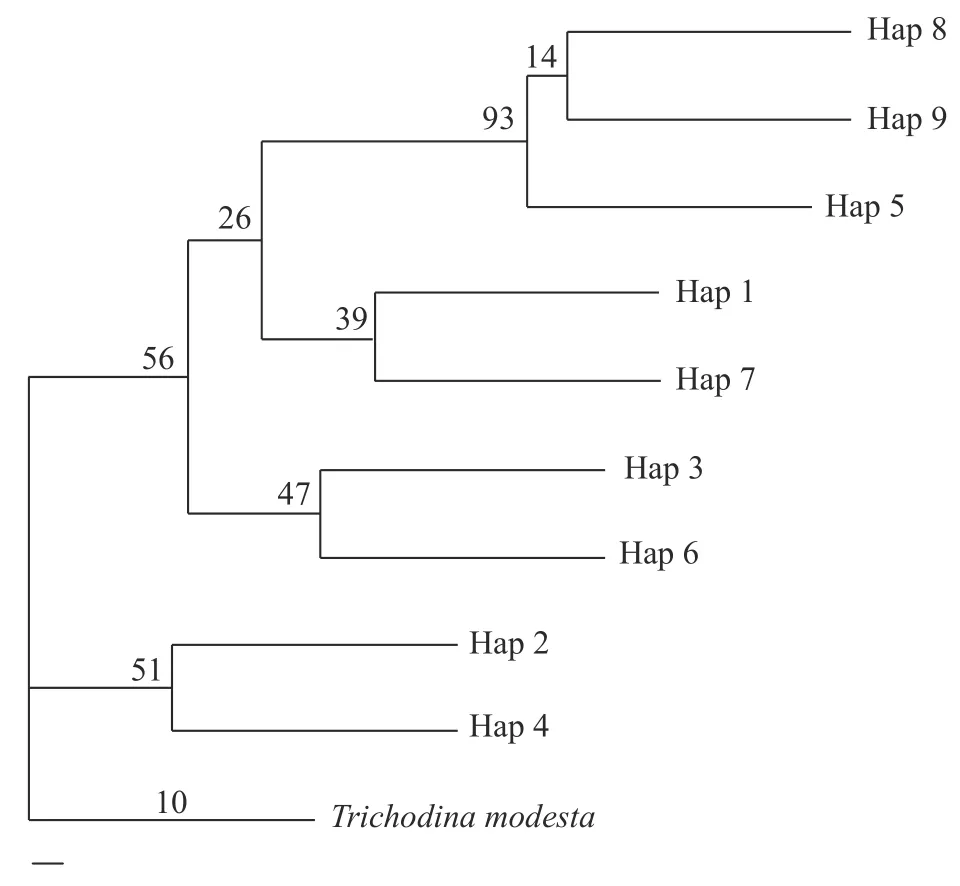
图2 基于网状车轮虫SSU rDNA的单倍型ML系统发育树Fig. 2 Phylogenetic tree of haplotype ML based on SSU rDNA of Trichodina reticulata
2.3 遗传多样性及遗传分化分析
根据表3提供的相关信息,上述5组群体均呈现较高的单倍型多样性(Hd≥0.5)与较低的核苷酸多样性(Pi<0.005): 其中单倍型多样性指数(Hd)最高的是Group E(全部群体),其Hd值高达为0.884,该群体包含三大地区(重庆+武汉+西藏)及三大宿主(鲫+草鱼+小黄黝鱼)的所有样本,其次为Group A(鲫来源群体),其Hd值均处于0.85以上,最低的是Group B(草鱼来源群体)的Hd=0.5;然而核苷酸多样性最高的却是Group B(Pi=0.00498),最低则是Group A(Pi=0.00199),其余群体核苷酸多样性指数则介于二者之间(表3)。通过进一步比较两种不同宿主(鲫与草鱼)寄生网状车轮虫群体的核苷酸多样性差异,亦明显发现Group B(草鱼来源群体)显著高于Group A(鲫来源群体;图3和表3)。
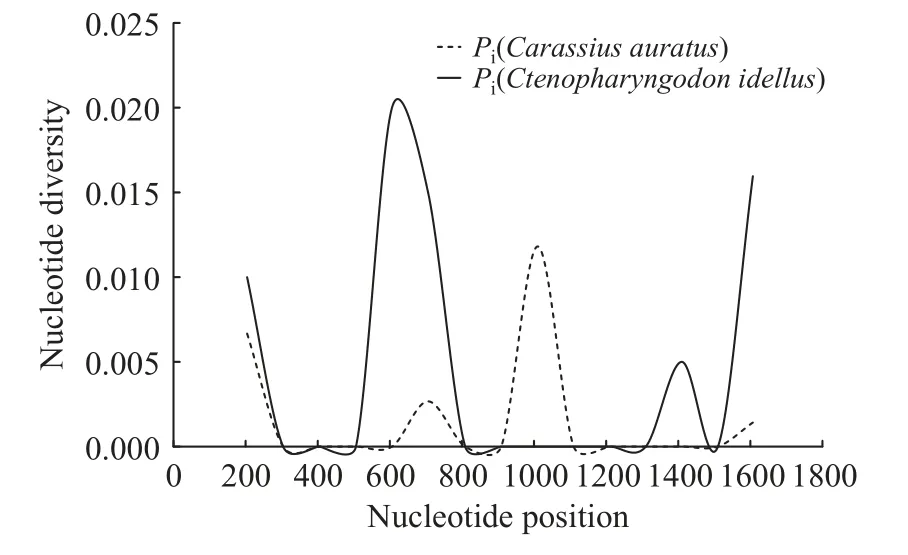
图3 基于网状车轮虫SSU rDNA的核苷酸多样性比较Fig. 3 Comparison of nucleotide diversity based on SSU rDNA of Trichodina reticulata
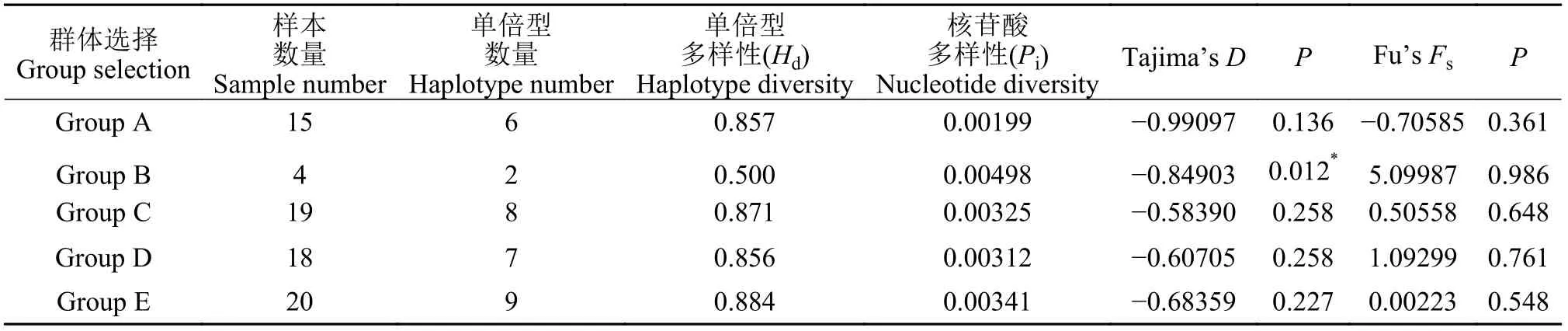
表3 网状车轮虫遗传多样性分析及中性检验Tab. 3 Genetic diversity analysis and neutral test of Trichodina reticulata
此外,本研究重点对来自不同宿主的网状车轮虫群体,即Group A(鲫来源群体)与Group B(草鱼来源群体)进行了遗传分化程度与基因流动程度的研究,具体采用遗传分化指数(Fst)及基因流(Nm)来度量。研究结果显示(表4),Group A与Group B群体间的遗传分化指数(Fst)为0.52716(显著大于0.25),而二者间的基因流(Nm)则为0.45(显著小于1)。

表4 网状车轮虫群体间遗传分化指数(Fst)与基因流(Nm)分析Tab. 4 Analysis of genetic differentiation index (Fst) and gene flow (Nm) among populations of Trichodina reticulata
2.4 遗传多样性中性检验及核苷酸错配分析
通过对5个网状车轮虫群体遗传多样性的中性检验,其结果显示(表3): 全部群体的Tajima’sD值均为负值,除草鱼寄生群体P<0.05(P=0.014)外,其余群体P>0.05;而Fu’sFs值除了鲫寄生群体为负值外(Fu’sFs= -0.70585),其余均为正值。另重点对Group A(鲫来源群体)与Group B(草鱼来源群体)进行比较,其中Group A的中性检验结果为: Tajima’sD检验结果表现为不显著负值(Tajima’sD= -0.99097,P=0.136);Fu’sFs对Group A的中性检测结果也为不显著负值(Fu’sFs= -0.70585,P=0.361),与Tajima’sD检验结果一致。而Group B的中性检验结果为:Tajima’sD检验结果表现为显著负值(Tajima’sD=-0.84903,P=0.014);Fu’sFs对Group B的中性检测结果为不显著正值(Fu’sFs=5.09987,P=0.986)。
同时,结合核苷酸的错配分析(图4): 在 5个群体中,除草鱼来源的群体外,其余群体均呈3—4个锯齿型下降的多峰曲线(图4A,C—E);而草鱼来源的群体的核苷酸错配分布图,呈现一个特殊且明显的单峰,即一条陡峭的快速下滑线之后,形成一个显著的单峰(图4B)。
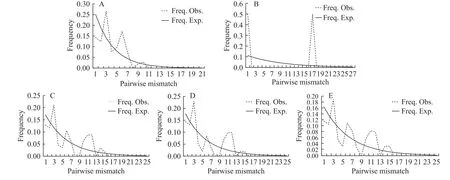
图4 网状车轮虫不同群体的SSU rDNA核苷酸的错配分布图Fig. 4 Map of SSU rDNA nucleotide mismatch for different populations of Trichodina reticulata
3 讨论
3.1 网状车轮虫的遗传结构及多样性
在动物遗传多样性研究中,中介网络图的引入及其结构分析至关重要,尤其是中介网络结构中的祖先单倍型的判断对于群体的分化意义重大,类似的研究在部分甲壳动物,如中华绒螯蟹(Eriocheir sinensis)、近亲拟相手蟹(Parasesarma affine)的群体遗传多样性中较为多见[16,29]。本研究的中介网络图显示(图1),整个网络结构是明显围绕主体单倍型Hap1(鲫来源)向四周辐射。由于与主体单倍型Hap1直接或间接相连接的单倍型数量最多,且其他单倍型与其仅保留一步或两步突变,因此推测主体单倍型Hap1为祖先单倍型[30]。进一步结合系统发育树发现,以草鱼为宿主的网状车轮虫(Hap7和Hap8)支系始终巢居于以鲫为宿主的网状车轮虫支系中(图2),由此推测,本研究涉及的三大宿主(鲫、草鱼与小黄黝鱼)中,寄生鲫的网状车轮虫可能属于所有群体中分化最早的种群,同时寄生草鱼的网状车轮虫在最早起源上很可能是从鲫传播而来。此外,共享单倍型Hap7(重庆草鱼来源)不仅距离祖先单倍型Hap1最远,同时也远离其他单倍型,包括相同宿主来源的Hap8单倍型。该研究结果在一定程度上也阐明了单倍型Hap7的网状车轮虫种群在其形态上不同于其他网状车轮虫种群的特征,即缺乏中央颗粒(中央颗粒曾被视为网状车轮虫典型形态学特征之一),故该研究也支持了先前关于网状车轮虫形态分化的研究论点[25]。另外,本研究检测到9个单倍型,其中4个为共享单倍型,5个为特有单倍型。比较有趣的是,在所有共享单倍型中,几乎没有不同宿主(鲫、草鱼或小黄黝鱼)或地理种群(重庆、武汉或西藏)的共享,换言之,所有共享单倍型均由相同的宿主来源的种群共享。基于此,可进一步推测不同宿主的网状车轮虫群体间相对独立,群体内基因层面的交流较少。
单倍型多样性指数(Hd)和核苷酸多样性指数(Pi)是群体遗传多样性衡量的一项重要指标,遗传多样性是物种进化的基础,通常与种群的生存能力、适应能力及进化能力呈正相关[31]。根据 Grant和Bowen(1998)提出的标准[32],单倍型多样性(Hd)通常以 0.5 为临界值,核苷酸多样性(Pi)则以 0.005 为临界值,二者的值越大,群体的多样性程度越高。本研究结果显示: 所有网状车轮虫群体(5组)的Hd值均大于或等于0.5(Hd≥0.5),最高达0.884(全部群体),说明网状车轮虫整体的单倍型多样性高;而所有群体的Pi<0.005,最高0.00498(草鱼来源群体),说明网状车轮虫整体的核苷酸多样性较低。本研究还进一步通过比较发现(表3),Group A (鲫来源群体)的Hd值为0.857,显著高于Group B (草鱼来源群体)的Hd值(0.500),而鲫来源群体的核苷酸多样性(Pi)明显低于后者(表3和图3),则可说明鲫来源的群体核苷酸多样性显著低于草鱼来源群体,推测可能是由于宿主鲫的大面积人工定向选育或基因改造在一定程度上也抑制了寄生网状车轮虫群体的核苷酸多样性。然而类似于网状车轮虫的这种高Hd与低Pi的遗传多样性状况也存在于其他真菌、鱼类和鸟类中,如牛肝菌(Phlebopus portentosus)、褐斑鲬(Platycephalussp.1)与家鸡(Gallus domesticus)等[33—35]。
3.2 网状车轮虫的遗传分化与历史动态分析
遗传分化指数(Fst)通常被用于判断族群间遗传分化情况。一般认为,当Fst值小于0时,说明群体间基因流交流频繁;当Fst值介于0—0.05时,群体间遗传分化很低;当Fst值介于0.05—0.15时,群体间存在中度程度的分化;当Fst值介于0.15—0.25时,群体间高度分化;当Fst值大于0.25时,群体间极度分化[36]。本研究中鲫来源群体(Group A)与草鱼来源群体(Group B)间的Fst值达到0.52716(表4),且群体统计学差异显著(P<0.05)。根据上述分化标准,由于两者间的Fst显著大于0.25,表明两群体间已经达到了极度分化程度。
基因流(Nm)也是衡量群体分化的另一重要特征。研究认为,群体间Nm<1,表示群体可能由于遗传漂变而发生分化,而Nm>1,表示群体间Nm水平较高,群体间遗传分化较小;当Nm>4时,种群间的基因交流更充分,遗传分化更小[37]。鲫来源群体(Group A)与草鱼来源群体(Group B)间的Nm值仅为0.45,明显小于1,表明这两个不同群体由于遗传漂变已经发生了分化,且该分化现象至少在形态学的中央颗粒特征方面已有所体现[25,26]。
Tajima[38]认为,如果Tajima’sD与Fu’sFs值呈负值,且在统计学上达到显著标准,则说明序列中含有比中性进化模型更多的核苷酸位点变化,可能预示被研究种群曾经历过种群扩张。Group A(鲫来源群体)的中性检验中,Tajima’sD检验结果表现为不显著负值(Tajima’sD= -0.99097,P=0.136);Fu’sFs对Group A的中性检测结果也为不显著负值(Fu’sFs= -0.70585,P=0.361),与Tajima’sD检验结果一致,故两种检测结果在一定程度上说明了Group A历史上存在种群扩张的可能性极小,但结合Group A的多峰错配分析图(图4A),便直接否定了Group A存在历史上种群扩张的可能性,所以综合分析认为,Group A未发生过种群扩张。
对于Group B(草鱼来源群体)的中性检验,Tajima’sD检验结果表现为显著负值(Tajima’sD=-0.84903,P=0.014),此结果有力地支持Group B存在过历史扩张的可能;但Fu’sFs对Group B的中性检测结果为不显著正值(Fu’sFs=5.09987,P=0.986),说明Group B未经历过历史的种群扩张,该结果与Tajima’sD检验结果相悖。然而有研究认为,Fu’sFs检验对群体的近期扩张比较敏感[39],所以以此推测Group B早期历史上经历过种群扩张但近期未再经历。结合Group B的单峰错配分析图(图4B),也进一步证明了Group B经历过历史的种群扩张事件。综上,Group B存在过早期的种群扩张历史。
