草鱼呼肠孤病毒VP7蛋白单克隆抗体的制备与应用
2022-09-13郭家鸿王俊亚李耀国肖调义
季 宁 魏 伟 郭家鸿 王俊亚 李耀国 肖调义 邹 钧,
(1. 上海海洋大学水产与生命学院,上海 201306;2. 湖南农业大学,湖南省特色水产资源利用工程技术研究中心,长沙 410128)
草鱼病毒性出血病是草鱼(Ctenopharyngodon idella)常见病中危害最大的传染病,草鱼呼肠孤病毒(Grass carp reovirus,GCRV)是导致该病的主要病原[1]。草鱼出血病流行广、致死率高、发病季节长,造成巨大的养殖损失,严重威胁渔业生产[2,3]。
GCRV是一种双链RNA(Double-stranded RNA,dsRNA)病毒,属于水生呼肠孤病毒属(Aquareovirus),是水生呼肠孤病毒中毒性最强的病毒[4]。根据基因组差异,我国流行的GCRV可以分为3种基因型[5],其中GCRV-873[6]、GCRV-HZ08[7]和GCRV-104[8]毒株分别为基因Ⅰ、Ⅱ和Ⅲ型的代表株。在报道的40多株GCRV毒株中[9],GCRV 873株是第一株完成全基因组序列分析的草鱼呼肠孤病毒[10]。GCRV粒子为正二十面体对称的球形颗粒,不具囊膜,直径约为75 nm,其双层衣壳主要保护核酸免受外界的影响和破坏。GCRV-I是水生动物呼肠孤病毒的模式毒株,其基因组由11条分节段dsRNA构成,病毒编码的7个结构蛋白根据分子量大小依次定义为VP1—VP7[11],其中VP5和VP7是主要的外衣壳蛋白,病毒外衣壳含有2 0 0个由VP5/VP7异二聚体组成的三聚体[12]。
VP7蛋白是GCRV-I特有的外衣壳蛋白,由S10片段编码,在GCRV感染及致病过程中发挥重要作用[13]。VP7可以结合dsRNA,与病毒的细胞吸附有关[14],尤其在病毒与宿主互作及病毒入胞过程中发挥关键作用,外衣壳上的三聚体作为受体识别位点存在[15],故推测VP7蛋白参与GCRV入侵草鱼细胞过程[16]。Chen等[17]的研究发现感染GCRV草鱼产生的抗血清只能识别GCRV-I的外衣壳蛋白VP7,表明VP7是GCRV-I的主要抗原蛋白,可较其他结构蛋白诱导更强的免疫应答,提示VP7蛋白可以作为疫苗设计的首选免疫原。He等[18]体外中和试验显示VP7克隆抗体具有中和活性,表明VP7具有研制GCRV亚单位疫苗的潜力。Luo等[19]的抗体中和试验结果也证实,VP7是Ⅰ型GCRV的主要抗原表位,为研制GCRV基因疫苗提供了参考资料。徐诗英等[20]成功构建了vp7基因核酸疫苗,发现其对草鱼病毒性出血病有较好的免疫保护效果,为草鱼呼肠孤病毒核酸疫苗的研发与生产应用奠定了基础。刘世旭等[21]制备了基因I型草鱼呼肠孤病毒VP7蛋白合成肽抗体。Hao等[22]研究发现将GCRV-873的VP7蛋白在大肠杆菌表面表达作为对草鱼的免疫保护作用疫苗也具有良好的免疫效果。由此可见,高效的VP7蛋白抗体的开发与鉴定,有助于研发草鱼出血病的疫苗。
该实验利用原核表达系统制备GCRV-I VP7蛋白及其单克隆抗体,并利用感染GCRV-873的草鱼肾细胞系(Ctenopharyngodon idelluskidney cell,CIK)开展VP7单抗的鉴定,为GCRV-I病毒快速诊断试剂盒的研发和VP7功能研究提供技术基础。
1 材料与方法
1.1 细胞系和病毒株
草鱼肾细胞系(CIK)培养温度为28℃,用含10%血清和1%双抗的M199培养液进行传代培养,在5% CO2培养箱中培养;BL21 (DE3)感受态细胞由本实验室制备并保存。GCRV-873毒株由湖南农业大学肖调义老师惠赠。
1.2 主要试剂
包涵体洗涤液(Inclusion body washing buffer)含50 mmol/L Tris-Cl(8.0)、300 mmol/L NaCl、10 mmol/L EDTA和0.5% Triton X-100;重悬缓冲液(Resuspension buffer)含50 mmol/L Tris-HCl(8.0)、100 mmol/L NaCl和10 mmol/L EDTA;溶解液(Dissolution buffer)含6 mol/L盐酸胍、10%甘油、50 mmol/L Tris-HCl(8.0)、100 mmol/L NaCl和10 mmol/L EDTA;蛋白复性液(Protein refolding buffer)含100 mmol/L Tris-HCl(8.0)、400 mmol/L L-Arg HCl、2 mmol/L EDTA、0.5 mmol/L GSH(Reduced glutathione)和0.5 mmol/L GSSG(Oxidized glutathione);分子筛柱层析缓冲液(Size exclusion buffer)含20 mmol/L Tris-HCl(8.0)和50 mmol/L NaCl。
1.3 VP7蛋白原核表达质粒的构建和诱导表达
VP7原核表达质粒由中国科学院武汉病毒研究所方勤研究员惠赠,VP7原核表达质粒的构建过程参考Zhang等[23]的研究,GCRV-I的vp7序列来自NCBI基因库(GenBank: AF403396),vp7片段扩增引物顺序如下: 正向引物,5′-CATGGATCCCCGATC ATCACCACGAT-3′;反向引物,5′-CGCTGAATTC GATGAAACGAGAGACC-3′,其中下划线部分分别为BamHΙ和EcoRI酶切位点。从已纯化的GCRVI病毒中提取RNA作为基因扩增模板,对vp7基因进行扩增。PCR产物经1.5%琼脂糖凝胶电泳,利用DNA片段纯化回收试剂盒进行回收。通过T4连接酶将PCR纯化产物与pRSET-A载体连接,构建VP7原核表达重组质粒pR/GCRV-VP7。
将pR/GCRV-VP7转化至大肠杆菌BL21和DE3进行原核表达,经含有氨苄西林抗生素的LB平板和PCR筛选获得阳性单克隆菌落。将挑取的阳性克隆菌液接种到1 mL的氨苄液体培养基中,放入37℃摇床培养8h,分装成两管,加到10 mL氨苄液体培养基中,培养至OD600达到0.4—0.6后,在一管中加入10 μL浓度为1 mmol/L的异丙基硫代-β-D-半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG),培养9h,离心弃上清,用PBS 缓冲液(Phosphate buffered saline,PBS)重悬菌体。加入蛋白上样缓冲液,金属浴100℃煮沸10min,8000×g离心3min,取上清用于SDS-PAGE检测。
1.4 原核表达蛋白的提取、复性和纯化
将挑选出来的阳性菌株进行大量诱导表达,提取包涵体。用超低温高压连续细胞破碎仪破碎菌体,离心弃上清,加入20 mL含有1%二硫苏糖醇(Dithiothreitol,DDT)的包涵体洗涤液洗涤包涵体。弃掉上清后,加入20 mL 重悬液重悬包涵体,吸取20 μL用作SDS-PAGE检测包涵体纯度,离心弃去上清,加入溶解液溶解包涵体,使其终浓度为20 mg/mL。取5 mL包涵体溶液逐滴加入复性液中,24h后开始浓缩,用300 mmol/L分子筛缓冲液置换后用AKTA Pure分子层析柱进行纯化,根据出峰位置收集目的蛋白,取收集到的峰尖和峰末位置的蛋白进行SDSPAGE电泳分析。
1.5 动物免疫和免疫效价测定
将纯化后的VP7重组蛋白共计5 mg提供给北京华大蛋白质研发有限公司制备单克隆抗体。用纯化后的蛋白免疫4只SPF级BALB/c雌性小鼠,进行4次免疫后,眼眶取血,测血清效价。用间接酶联免疫吸附测定法(Enzyme linked immunosorbent assay,ELISA)测定,抗原浓度为2 μg/mL,4℃包被过夜,用2%脱脂奶粉,37℃封闭2h,血清从200倍开始2倍梯度稀释,空白对照为磷酸缓冲液稀释,阴性对照为阴性血清200倍稀释。
1.6 单克隆抗体亚型鉴定
将筛选出来的阳性细胞株进行亚类鉴定,最后得到5株IgG类型阳性杂交瘤细胞株。用100 mmol/L PBS(pH7.4)稀释包被抗体至0.5 μg/mL,每孔加0.1 mL,4℃过夜后PBS-T洗2次,每孔加入200 μL封闭液,37℃孵育2h。PBS-T洗3次后每孔加入100 μL杂交瘤上清,37℃孵育1h。PBS-T洗3次后加入用封闭液1∶2000稀释的HRP标记的抗体(SBA Clonotyping System-HRP,Southern Biotech),每孔0.1 mL,37℃孵育1h。PBS-T洗3次;每孔加50 μL底物溶液,10—20min内于双波长(450 和630 nm)测吸光值。
1.7 单克隆抗体特异性分析
GCRV-873感染CIK细胞样品、设置未感染的CIK细胞为对照组。感染24h后提取蛋白进行Western Blot实验。采用电转法(25 V,25 mA,7min)将蛋白样品转至PVDF膜上,用5%脱脂牛奶4℃下封闭PVDF膜2h后,经一抗隔夜4℃孵育(VP7单抗1∶1000稀释)、IRDye-800CW羊抗鼠作为二抗(1∶10000稀释)4℃孵育1h后,用TBS-T缓冲液清洗3次,每次5min。将PVDF膜置于Odyssey CLx Imaging System拍照分析。
1.8 直接免疫荧光检测
将无菌载玻片置于6孔细胞培养板中,加入CIK细胞,待细胞达90%细胞覆盖度,感染GCRV-873,同时设正常CIK细胞作为对照。待出现明显细胞病变后,弃培养液,用PBS缓冲溶液清洗,再用4%多聚甲醛固定细胞。移去液体,用PBS缓冲溶液洗3次,每次5min。用0.5% Triton-X100室温通透细胞。加入足够量的5%牛血清白蛋白(Bovine albumin,BSA)封闭液,室温孵育1h。弃去封闭液,加入用5%BSA稀释异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的VP7单抗(1∶10000比例稀释抗体),室温孵育2h。PBS缓冲溶液洗3次后加入DAPI室温染色10min,PBS缓冲溶液洗3次,每次5min,加入封片剂后,在激光共聚焦显微镜下观察并拍照记录。
2 结果
2.1 VP7蛋白氨基酸序列分析
从NCBI数据库下载GCRV-873、JX01、JX02、GCRV-096、GZ1208、GCRV-991、GCRV-876和GCRV-875病毒株VP7蛋白的氨基酸序列,通过ClustalX软件进行多重序列比对,用GeneDoc绘制序列多重比对图后发现,除JX02病毒株以外,其他病毒株之间具有一些相似的氨基酸序列,通过SMART软件分析氨基酸结构域发现它们具有一定的结构保守性,同源性较高(图1)。除JX02以外,其他7株都具有ZZ型锌指结构域(ZZ-type zinc finger domain)和PSI(Domain found in Plexins,Semaphorins and Integrins)结构域,除JX02和GCRV-876以外,其他6株都具有UBX(Domain present in ubiquitin-regulatory proteins)结构域,同时GCRV-096、GCRV-991、GCRV-876和GCRV-873具有DWB(Domain B in dwarfin family proteins)结构域,JX01、GCRV-096、GZ1208和GCRV-873具有FU(Furinlike repeats)结构域。

图1 GCRV-I VP7不同株的氨基酸序列比对Fig. 1 Multiple alignment of VP7 amino acid sequences from GCRV-I strains
2.2 VP7的诱导表达及其纯化
含重组质粒的BL21和DE3大肠杆菌,经1 mmol/L IPTG诱导。离心收集诱导后的菌液,经超低温高压连续细胞破碎仪破碎菌体后,离心后弃上清,分析包涵体中VP7蛋白的表达情况,SDS-PAGE结果显示,VP7蛋白经IPTG诱导后可以在BL21和DE3大肠杆菌中高效表达,重组蛋白VP7大小约为40 kD,主要以包涵体形式存在。使用AKTA分子层析柱进行纯化,根据出峰位置收集目的蛋白(图2A),收集体积为68、69、70和71的VP7蛋白进行SDSPAGE分析(图2B)。结果显示,获得的VP7蛋白纯度较高。

图2 重组蛋白VP7的纯化Fig. 2 Purification of recombinant VP7 protein
2.3 免疫小鼠的血清效价测定以及单克隆抗体亚型鉴定
当免疫小鼠的血清效价高于10000时,进行细胞融合实验。第四次免疫后血清效价检测结果(图3),4只小鼠的抗体效价均较高,血清效价达到51200,选择1号小鼠进行细胞融合和单抗制备。
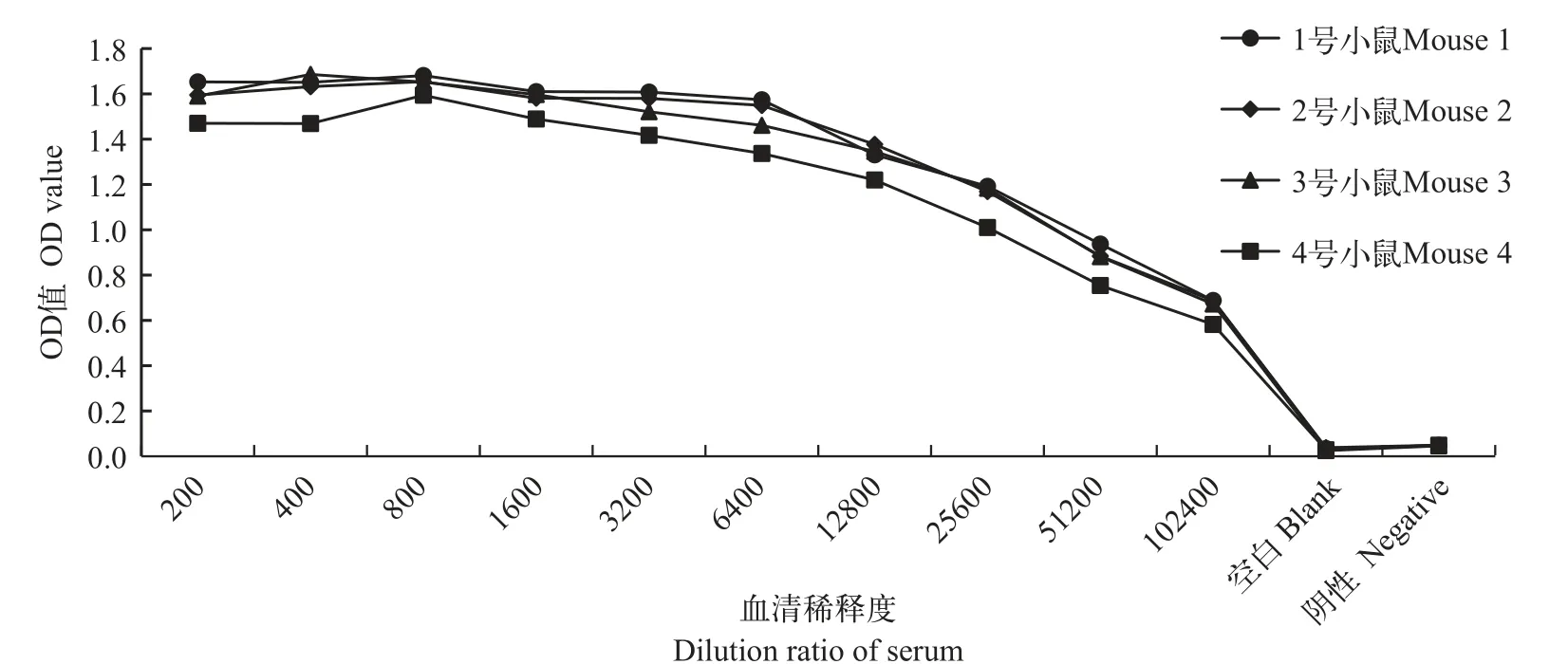
图3 第四次免疫小鼠血清效价测定Fig. 3 Detection of antibody serum titer of immunized mouse No. 4
将筛选出来的编号为3、8、9、11和12的阳性细胞株进行亚类鉴定,得到5株IgG类型阳性杂交瘤细胞株(表1)。其中3号、11号和12号的亚型为IgG1,8号和9号的亚型为IgG2a。
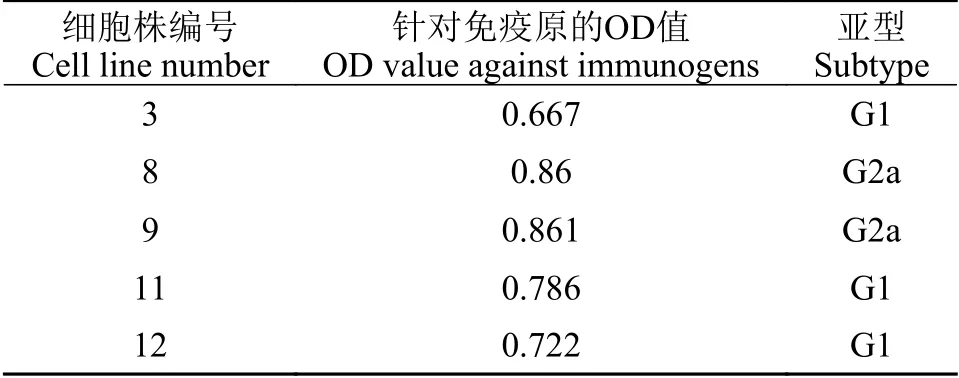
表1 单克隆细胞株亚型鉴定Tab. 1 Determination of monoclonal antibody subtypes
2.4 单克隆抗体纯度及亲和常数测定
挑选3号和12号的单克隆细胞株(命名为GCRV3-VP7和GCRV12-VP7)进行大规模抗体制备和纯化。用ELISA检测两株抗体的亲和常数,按照亲和常数≈150000×A/抗体浓度(150000为单个IgG抗体平均分子量值,抗体浓度单位为mg/mL)来计算,A代表平台上的1/2 OD值所对应的抗体稀释倍数,结果图4显示,GCRV3-VP7的亲和常数为4.04×109,GCRV12-VP7的亲和常数为2.74×109。
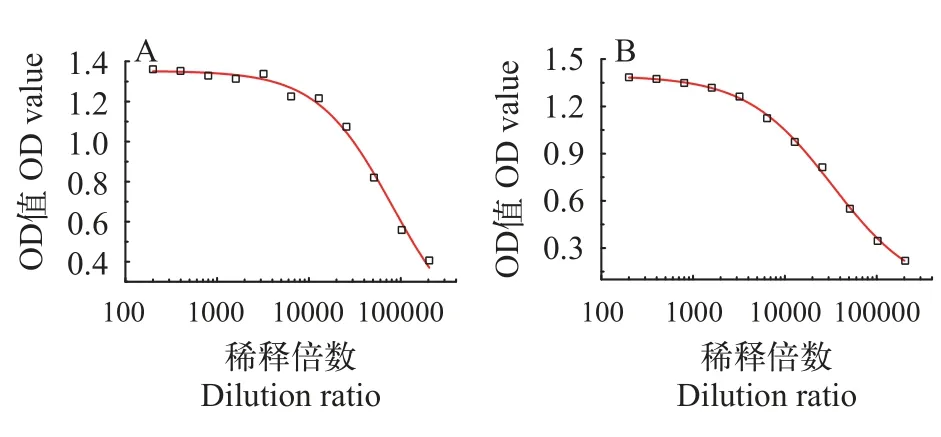
图4 ELISA检测抗体的亲和常数Fig. 4 The affinity parameters of antibodies detected by ELISA A. GCRV3-VP7;B. GCRV12-VP7
2.5 单克隆抗体Western Blot检测
用GCRV3-VP7和GCRV12-VP7单克隆抗体进行Western Blotting分析分析GCRV-873感染的CIK细胞和未感染的CIK细胞(对照组)。感染24h后提取蛋白进行Western Blotting实验。结果显示,感染GCRV-873病毒的细胞样品在35 kD大小附近有一条清晰单一的条带,未感染病毒的细胞样品未出现条带(图5)。综上,本研究制备的VP7单克隆抗体可以识别GCRV-873病毒的VP7且具有很强的特异性。

图5 抗体的Western Blotting鉴定Fig. 5 Characterization of VP7 antibodies by Western Blotting
2.6 直接免疫荧光检测
用GCRV-873感染CIK细胞,利用直接免疫荧光试验分析病毒感染情况。CIK细胞在GCRV-873病毒感染后出现明显的致细胞病变效应(Cytopathic effect,CPE),细胞稀疏且大量脱落悬浮在细胞培养基中,未感染病毒细胞生长正常。经固定、透化、封闭和 孵育FITC标记的VP7单克隆抗体和DAPI染色后,在倒置在荧光显微镜下观察。病毒感染组细胞出现明显的绿色荧光信号(FITC标记的GCRV3-VP7单抗);而未感染组的细胞未出现荧光信号(图6)。以上结果表明,本研究制备的VP7单克隆抗体可应用于直接免疫荧光试验检测GCRV-873病毒在细胞中的感染情况。

图6 VP7单克隆抗体特异性免疫荧光分析Fig. 6 Immunofluorescence analysis of GCRV-873 infection with VP7 monoclonal antibody
3 讨论
草鱼出血病是危害草鱼的头号病毒性传染病,传染性广、致死率高。1978年,研究人员首次证实该病的病原是一种病毒[24]。1983年,草鱼出血病病毒 (Grass Carp Haemorrhage Virus,GCHV)被鉴定为呼肠孤病毒科(Reoviridae)成员[25]。草鱼出血病主要危害草鱼和青鱼苗种,由于其发病季节长,流行范围广,致死率可高达85%以上,严重制约草鱼养殖业的健康发展[26]。因此,亟须发展该病的防控措施。
生物信息学分析显示,GCRV-I不同株的VP7蛋白序列具有高度保守的结构域,同源性高,以VP7为免疫原制备的单克隆抗体检测GCRV-I具有广谱性。另外,VP7蛋白作为GCRV-I特有的衣壳蛋白,其单克隆抗体特异性好,不与Ⅱ型GCRV发生交叉反应。目前,GCRV的检测多采用分子生物学方法和电镜观察,主要包括电镜观察法、各种PCR法[27,28]、细胞分离法和逆转录环介导等温扩增法[29,30]。尽管这些检测方法高度敏感,但其广泛应用存在应用局限性,包括成本太过高昂、检测时间长、操作复杂、需要训练有素的实验操作人员、依赖贵重仪器等。酶联免疫吸附试验作为一种基于抗体-抗原反应的免疫学方法,可以提高疾病确认过程的可靠性。它的主要优点是能够在短时间内进行高通量样本检测,检测的敏感性和特异性取决于所用抗体的质量。相比于多克隆抗体,单克隆抗体的优点是纯度高,灵敏度高,特异性强,交叉反应少,制备成本低。郝贵杰等[31]制备的GCRVI VP7蛋白多克隆抗体特异性和效价有待提高,而我们的单克隆抗体在ELISA检测中拥有更高的亲和力,当稀释倍数达到1∶204800时仍可检测到抗原蛋白。因此,本研究制备的VP7单克隆抗体可应用于GCRV-I的ELISA诊断和检测,可用于研发GCRV-I快速检测试剂盒。
为深入探究GCRV-I病毒的感染机制,本研究在大肠杆菌中表达了VP7蛋白,VP7蛋白主要以包涵体形式存在,以纯化的VP7蛋白免疫BALB/c小鼠获得了单克隆抗体。通过直接免疫荧光实验证实该单抗可用于检测GCRV-I在细胞水平的感染,Western Blot检测到的蛋白条带大小约为35 kD。VP7蛋白由276个氨基酸组成,分子量的理论值约为29.81 kD,推测GCRV-I VP7的翻译后修饰可能是导致分子量偏大的原因,但其具体机制尚不明确。因此,以vp7基因为突破口开展GCRV-I病毒感染机制验证具有重要理论和应用价值。同时VP7单克隆抗体可应用于开发快速反应试剂盒,更加方便养殖场对病鱼样本的快捷检测。本研究制备的VP7单克隆抗体及其相关GCRV-I免疫学诊断方法为GCRV-I病毒感染机制和防控技术的开发奠定了良好的基础。
