全预混冻干PCR试剂检测草鱼呼肠孤病毒Ⅱ型的研究
2019-01-17侯月娥伍建敏王凤求赵玉林王贵平李中圣
侯月娥,伍建敏,王凤求,赵玉林,张 杰,王贵平,李中圣
( 广东海大集团股份有限公司,广东 广州 511400 )
草鱼呼肠孤病毒(Crasscarpreovirus,GCRV)是我国研究人员于1983年分离出的一株草鱼出血病病毒,经研究后按照其在形态学和理化特性等方面的特征最终鉴定[1]。草鱼呼肠孤病毒是水生动物呼肠孤病毒属(Aquareovirus)中毒力、传染性、致病性均较强的病毒,暴发高峰期可引起高达90%的死亡率,病鱼以体表充血、出血为主要症状,口腔、眼部、鳃、肝、脾、肾等器官和组织也可见不同程度的充血、出血现象,给我国的草鱼(Ctenopharyngodonidellus)养殖业造成巨大的经济损失。该病毒病原学复杂、毒株变异大。曾伟伟等[2]根据GenBank数据库中的草鱼呼肠孤病毒序列,将其分为Ⅰ型、Ⅱ型、Ⅲ型。至今,已报道的分离株有30余株,通过对近5年提交到GenBank数据库中的草鱼呼肠孤病毒基因序列进行分析和比较后发现,19个草鱼呼肠孤病毒新分离株中的16株为Ⅱ型,占整个草鱼呼肠孤病毒新分离株的84%,可见草鱼呼肠孤病毒Ⅱ型毒株为当前流行株[3-11]。
草鱼呼肠孤病毒诊断方法主要为免疫学诊断,如葡萄球菌A蛋白协同凝集试验法[12]、荧光抗体技术和酶联免疫吸附试验法[13]、斑点酶联免疫吸附试验法[14];电镜观察也常用于草鱼呼肠孤病毒病毒病的诊断[15]。草鱼呼肠孤病毒免疫学诊断法在基层检测机构中使用频率较高、特异性好,但操作复杂,对检测人员的专业性要求较高。实验室中针对草鱼呼肠孤病毒核酸的RT-PCR检测是普遍使用的检测手段[16],可有效区分不同基因型草鱼呼肠孤病毒。本研究首先建立了草鱼呼肠孤病毒Ⅱ型荧光定量PCR检测法,在此基础上,通过将检测试剂整体冻干,制备了一种可常温长期保存、快速检测的核酸检测法,该方法适合草鱼呼肠孤病毒Ⅱ型的快速检测和流行病学调查,为草鱼呼肠孤病毒预防和控制提供帮助。
1 材料与方法
1.1 病毒株、菌株及质粒
草鱼呼肠孤病毒、鲤春病毒血症病毒(Springviremiaofcarpvirus, SVCV)、传染性造血器官坏死症病毒(Infectioushematopoieticnecrosisvirus, IHNV)均由广东海大畜牧兽医研究院有限公司惠赠。大肠杆菌(Escherichiacoli)DH5α和pMD18TM-T载体购自TaKaRa公司。
1.2 主要试剂和仪器
体液病毒RNA小量制备试剂盒(Axygen公司);RNA酶抑制剂、M-MLV逆转录酶(Promega公司);dNTP(TaKaRa公司);琼脂糖凝胶DNA纯化回收试剂盒、普通质粒小量提取试剂盒(Omega公司);NeuM冻干保护剂由广东海大畜牧兽医研究院提供。CFX384Real-Time Systerm、S1000 Thermal Cycler(广东昊洋贸易有限公司);核酸蛋白检测仪(Thermo)(广东东锐仪器设备有限公司);Triad冷冻干燥器(照生有限公司)。
1.3 引物和探针的设计及合成
根据草鱼呼肠孤病毒(GQ896337)的核酸序列,利用Beacon Designer 7设计软件,设计特异性引物和荧光探针(表1),引物和探针由上海Invitrogen公司合成。

表1 草鱼呼肠孤病毒的荧光定量RT-PCR探针及扩增引物
1.4 草鱼呼肠孤病毒总核酸的提取及模板的制备
参照病毒RNA小量制备试剂盒说明书提取病毒传代细胞中的总核酸。取草鱼呼肠孤病毒的总RNA部分反转录为cDNA,并置于超低温冰箱-80 ℃保存备用。
1.5 草鱼呼肠孤病毒基因片段克隆及标准品的制备
分别以草鱼呼肠孤病毒的cDNA为模板,GCRV-F/GCRV-R (10 pmol/L)为引物进行PCR扩增。扩增条件为:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃ 6 min。PCR扩增产物采用2%的琼脂糖凝胶进行电泳检测。将切胶纯化的PCR产物分别克隆至pMD-18T载体中,构建重组质粒pMD-GCRV,将阳性的重组质粒测序鉴定[17]。并采用thermo核酸蛋白检测仪测定重组质粒密度,换算成个数。
1.6 TaqMan荧光定量RT-PCR扩增反应条件的优化
调节草鱼呼肠孤病毒的引物和探针终浓度为0.1~0.6 μmol/L,反转录时间5~15 min,退火温度55~65 ℃,不同浓度配比、反转录时间和退火温度单独进行荧光定量RT-PCR反应优化,选择其中结果最好的引物、探针浓度、反转录时间及退火温度。
1.7 反应试剂冻干品的制备
1.7.1 冻干保护剂的优化
将冻干保护剂稀释为4组不同的浓度(10、8、5、1.25 μmol/mL)同配制好的反应试剂混匀然后进行无菌分装,200 μL八连管每管加入100 μL反应液(相当于20 μL的反应体系)。分装后放于-80 ℃冰箱冷冻3 h,当完全冻好以后,开盖放于已经调试好的Triad冷冻干燥器里进行冷冻干燥。冷冻程序为:-35 ℃ 3 h,-20 ℃ 1 h,-15 ℃ 1 h,0 ℃ 3 h,25 ℃ 1 h。程序停止以后根据冻干样品物理性状选择最佳的一组。
1.7.2 草鱼呼肠孤病毒冻干检测试剂的使用方法
将冻干试剂用灭菌的去离子水16 μL进行溶解,加入2 μL的阳性对照品,同时用灭菌的去离子水作为阴性对照,每管20 μL,封盖混匀离心。荧光定量RT-PCR的反应条件均为:42 ℃ 5 min,95 ℃预变性1 min,95 ℃变性10 s,退火温度为RT-PCR扩增反应条件优化的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.8 草鱼呼肠孤病毒冻干检测试剂标准曲线的构建
将制备的草鱼呼肠孤病毒标准品作10倍系列稀释,用不同稀释梯度的重组质粒作为模板,每个梯度的质粒设立3个重复。用优化的反应体系进行实时荧光定量RT-PCR扩增。荧光定量RT-PCR的反应条件均为:42 ℃ 5 min,95 ℃预变性1 min,95 ℃变性10 s,退火温度为RT-PCR扩增反应条件优化的最适温度,40个循环,每个循环结束时进行荧光信号采集。
1.9 草鱼呼肠孤病毒冻干检测试剂特异性、敏感性和稳定性试验
1.9.1 草鱼呼肠孤病毒冻干检测试剂特异性试验
将提取的草鱼呼肠孤病毒、鲤春病毒血症病毒、传染性造血器官坏死症病毒核酸作为模板进行RT-PCR扩增,验证其特异性。
1.9.2 草鱼呼肠孤病毒冻干检测试剂敏感性试验
将测定好质粒密度的模板进行10倍系列稀释,利用草鱼呼肠孤病毒冻干检测试剂测定其敏感性。与本试验室已经建立草鱼呼肠孤病毒普通PCR进行检测,比较其敏感性。
1.9.3 草鱼呼肠孤病毒冻干检测试剂稳定性试验
自已经稀释好的质粒样品中选取密度为1×106个/μL为模板,对抽取的6个批次的草鱼呼肠孤病毒冻干检测试剂进行试验,计算其Ct值的标准差和变异系数,验证其稳定性。
1.10 草鱼呼肠孤病毒冻干检测试剂保存期试验
将冻干检测试剂分别放置于室温25 ℃和37 ℃保存,定期进行其敏感性检测,考察不同保存条件下的敏感性。
1.11 草鱼呼肠孤病毒冻干检测试剂在手持式荧光PCR仪上的试验
手持式荧光PCR仪为单通道PCR仪,将1.5制备的草鱼呼肠孤病毒标准品做10倍系列稀释,用不同稀释梯度的重组质粒作为模板,根据其已有内置程序进行荧光PCR扩增,收集荧光信号进行定性检测,42 min可以看到结果。
1.12 临床样本的检测试验
选取经过检测验证的草鱼呼肠孤病毒阳性样品20份、草鱼呼肠孤病毒可疑的样品13份,未经验证的样品27份累计60份,样品均来自广东地区,采用本次构建的一步法冻干检测试剂进行临床样品验证。
2 结 果
2.1 重组质粒标准品的制备
以草鱼呼肠孤病毒合成的引物进行RT-PCR扩增,扩增产物采用2%的琼脂糖凝胶进行电泳检测。将切胶纯化的PCR产物分别与pMD-18T载体连接,构建重组质粒pMD-GCRV,将阳性的重组质粒测序鉴定。结果显示,草鱼呼肠孤病毒引物能扩增出相应的目的片段(图1)。

图1 草鱼呼肠孤病毒阳性重组质粒鉴定结果1:草鱼呼肠孤病毒;M:DL2000 Marker.
2.2 荧光定量RT-PCR扩增反应条件优化
引物、探针终浓度的不同配比、不同的退火时间以及不同退火温度试验结果显示,引物、探针的不同终浓度和不同的退火温度都会引起Ct值的不同,而反转录时间5 min和15 min对Ct值没有影响,GCRV-F/GCRV-R引物的终浓度0.2 μmol/L、探针终浓度为0.3 μmol/L、反应条件退火温度为60 ℃时,对同一标准品的检测信号值最强,Ct值最小(图2~图3)。
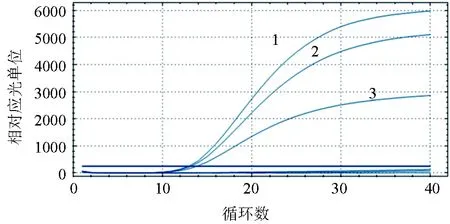
图2 草鱼呼肠孤病毒引物浓度优化1:引物浓度0.2 μmol/L;2:引物浓度0.25 μmol/L;3:引物浓度0.3 μmol/L.
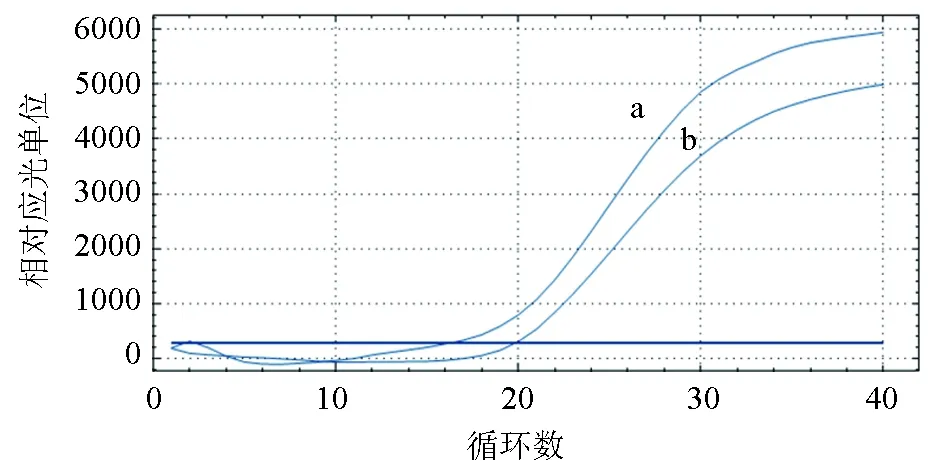
图3 草鱼呼肠孤病毒退火温度优化a:退火温度60 ℃;b:退火温度55 ℃.
2.3 草鱼呼肠孤病毒冻干保护剂的优化
优化试验结果显示,保护剂浓度达到8 μmol/mL时的Ct值与不加保护剂的反应相同(图4),且该组的冻干形态也较好,冻干样品致密,来回摇动不散开,加入DEPC水迅速溶解,故将保护剂浓度定为8 μmol/mL(图5)。

图4 草鱼呼肠孤病毒冻干保护剂的优化a:不加保护剂;b:8 μmol/mL保护剂;c:10 μmol/mL保护剂;d:5 μmol/mL保护剂;e:1.25 μmol/mL保护剂.
图5 草鱼呼肠孤病毒冻干检测试剂的冻干后的物理性状
2.4 草鱼呼肠孤病毒冻干检测试剂标准曲线构建
草鱼呼肠孤病毒的荧光定量PCR反应标准品,质粒密度梯度为1×101~1×106个/μL的6个线性梯度的检测标准曲线呈等距性和平行性,具有较好的梯度性(图6)。

图6 草鱼呼肠孤病毒冻干检测试剂标准曲线
2.5 草鱼呼肠孤病毒冻干检测试剂特异性、敏感性和稳定性试验
2.5.1 草鱼呼肠孤病毒冻干检测试剂特异性试验
将提取的草鱼呼肠孤病毒、鲤春病毒血症病毒、传染性造血器官坏死症病毒核酸作为模板进行RT-PCR扩增,结果显示,仅有草鱼呼肠孤病毒的荧光信号为阳性,其他两种病毒的检测均为阴性,说明构建的草鱼呼肠孤病毒冻干检测试剂的特异性较强,与其他病毒的基因无交叉反应(图7)。

图7 草鱼呼肠孤病毒冻干检测试剂的特异性试验GCRV为草鱼呼肠孤病毒,SVCV为鲤春病毒血症病毒,IHNV为传染性造血器官坏死症病毒.
2.5.2 草鱼呼肠孤病毒冻干检测试剂敏感性试验
通过对草鱼呼肠孤病毒的反应标准重组质粒进行系列稀释,结果显示,对草鱼呼肠孤病毒的扩增效率较好,实时荧光定量RT-PCR的最低检测量为101个/μL(图8)。与实验室已经构建的草鱼呼肠孤病毒普通PCR检测结果进行比较,是普通PCR敏感性的100倍(图9)。
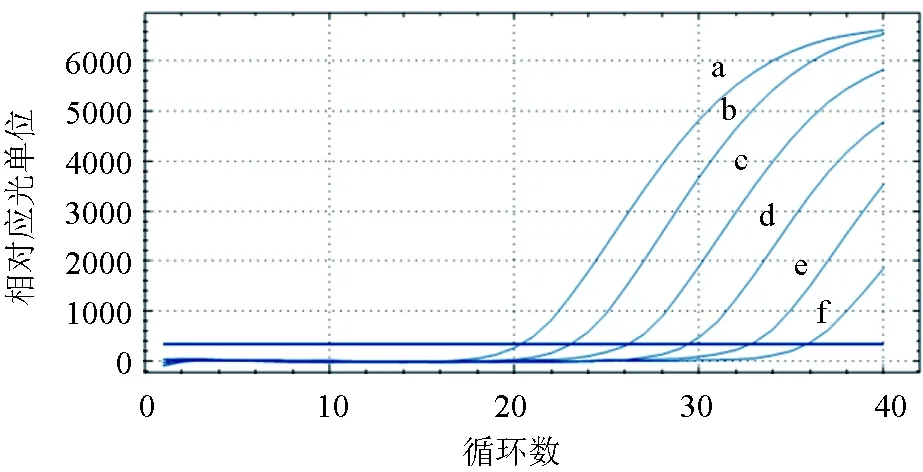
图8 草鱼呼肠孤病毒 冻干检测试剂敏感性试验a~f曲线分别为草鱼呼肠孤病毒质粒密度1×106、1×105、1×104、1×103、1×102、1×101 个/μL.

图9 普通草鱼呼肠孤病毒标准品敏感性试验1~6分别为草鱼呼肠孤病毒质粒密度1×106、1×105、1×104、1×103、1×102、1×101 个/μL;M:DL2000 Marker.
2.5.3 草鱼呼肠孤病毒冻干检测试剂稳定性试验
选取稀释好的标准品质粒密度为1×106个/μL为模板,对抽取的6个批次的草鱼呼肠孤病毒冻干检测试剂进行试验,结果显示,6个批次间的变异系数为3.6%(表2),验证了该冻干试剂具有良好的稳定性。

表2 草鱼呼肠孤病毒冻干检测试剂荧光定量RT-PCR稳定性试验
2.6 草鱼呼肠孤病毒冻干检测试剂保存期试验
试验结果显示,冻干试剂分别在25 ℃ 180 d、37 ℃ 15 d与对照试剂(0 d样品)检测结果无差异,敏感性均可以达到10个(表3),由此说明,草鱼呼肠孤病毒的冻干检测试剂在这两种存放条件下的敏感性并未降低,质量稳定。
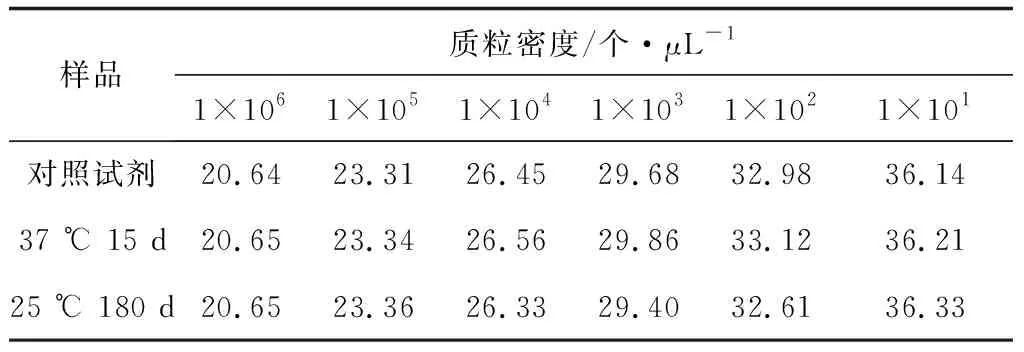
表3 草鱼呼肠孤病毒冻干检测试剂不同保存条件下的敏感性试验(Ct值)
2.7 草鱼呼肠孤病毒冻干检测试剂PCR敏感性
草鱼呼肠孤病毒冻干检测试剂在手持式荧光PCR仪和荧光定量PCR仪上的敏感性比对结果见表4。

表4 草鱼呼肠孤病毒冻干检测试剂不同PCR试验敏感性比对(Ct值)
2.8 临床样品检测结果
对20份普通PCR鉴定的已知临床病料和13份可疑临床病料以及未知的27份病料进行检测,结果显示,20份阳性病料,病毒密度为2.3×103~6.4×107个/μL(超过以及等于106个/μL的样品,均稀释100后再次检测),符合率为100%;13份可疑病料检测结果显示,5份感染草鱼呼肠孤病毒,病毒密度为1.0×102~3.1×103个/μL,阳性率为38.46%。27份未验证病料的检测结果显示,阳性感染的有7份,病毒密度为4.3×102~5.1×108个/μL,感染率为25.93%,而普通PCR仅检测出3份,感染率为11.11%。
3 讨 论
草鱼呼肠孤病毒是危害草鱼鱼苗阶段的一种病毒性鱼病,目前我国针对预防草鱼呼肠孤病毒的疫苗如组织灭活疫苗、细胞灭活疫苗、细胞弱毒疫苗以及基因工程亚单位疫苗均有小范围使用,也取得了不错的效果,但是仍然无法对草鱼呼肠孤病毒进行有效控制,每年都会给养殖户造成较大的损失。因此对该病的快速、准确、定性、定量以及便捷的检测就显得尤为重要。
本研究建立的一步法冻干检测试剂检测方法,是利用探针设计和引物设计的两种软件相互验证[18],并对体系中引物、探针、酶、反应液盐浓度等条件进行了反复筛选调整和优化,最终确定了一个最佳检测反应条件。在此优化的基础上将除核酸以外的所有成份(含保护剂)进行优化,添加在八连管中,分装后放于-80 ℃冰箱冷冻3 h,当完全冻好以后,开盖放于已经调试好的Triad冷冻干燥器里进行冷冻干燥,最终确定了对反应无影响的保护剂组合和冻干条件。干燥好的冻干检测试剂可以常温运输和短时间保存,均不会影响其性能,省去了各种试剂的混合和条件摸索以及在冰盒上的操作,也降低了对工作人员的专业要求。直接用DEPC水进行溶解添加所需检测的RNA,置于荧光定量PCR仪,通过分析软件能直观详细记录整个RT-PCR过程,无需再置备荧光定量专用的离心管,进行反转录以及琼脂糖凝胶电泳,利用标准曲线,可以直接从软件上得到病毒的准确密度。有效减少假阳性和污染发生的机会,步骤简单快捷。
草鱼呼肠孤病毒一步法冻干检测试剂的特异性结果显示,将提取的草鱼呼肠孤病毒、鲤春病毒血症病毒、传染性造血器官坏死症病毒核酸RNA为模板进行试验,仅有目的曲线扩增,其余均为阴性,说明其具有良好的特异性;敏感性试验的结果显示,其敏感性可达到101个/μL,r2>99.9%,具有较好的标准曲线和线性关系;6个批次间的变异系数为3.6%,稳定性较好;与常规的RT-PCR反应方法比较,是普通RT-PCR敏感性的100倍。周勇等[19]建立的草鱼呼肠孤病毒荧光定量检测方法特异性和敏感性均较好,但是操作繁琐,试剂必须低温保存,不方便运输,不能普及。而本研究的草鱼呼肠孤病毒冻干检测试剂可以在常温操作而不影响其敏感性,也可以利用手持式荧光PCR仪,将样品放置好,42 min就可以判定是否感染。弥补了传统检测方法重复性和耗时长的不足,同时具有较高的特异性,可以避免临床样品中其他病原的干扰。这对于草鱼出血病的早期诊断、病毒定量检测、致病机理研究以及防控技术研究等且有重要意义。
