三角褐指藻dxs基因克隆与诱导表达
2022-09-13舒明雨龚一富吕欣梦贾泽茗刘瑄瑄王何瑜
舒明雨 龚一富 吕欣梦 贾泽茗 王 博 刘瑄瑄 王何瑜
(1. 宁波大学海洋学院,浙江省海洋生物工程重点实验室,宁波 315832;2. 宁波大学食品与药学学院,宁波 315832)
三角褐指藻(Phaeodactylum tricornutum)作为硅藻模式生物,繁殖快、易调控,可以合成岩藻黄素等萜类化合物[1]。已有研究表明,岩藻黄素在抗肿瘤[2—6]、抗氧化[7]、抗糖尿病[8]、减肥[9]、抗衰老[10]和维持肝功能[11]等方面具有较强的生理活性,是一类重要的海洋药物和新型功能性食品。但目前,三角褐指藻中岩藻黄素的天然含量仍不能满足产业化生产的需求。因此,如何利用生物技术手段调控岩藻黄素的合成是目前研究的主要方向。
2-C-甲基-D-赤藓糖醇4-磷酸(2-C-methyl-Derythritol 4-phosphate,MEP)合成途径是硅藻萜类物质合成的上游途径[12]。1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)是MEP途径中催化丙酮酸生成1-脱氧木酮糖-5-磷酸(DXP)的限速酶[13]。研究发现,dxs基因过表达可使蓝藻二萜化合物含量提高3倍[14],使甜菊中甜菊苷含量提高2倍[15],使桑树类胡萝卜素含量提高六倍以上[16],表明DXS蛋白是萜类物质MEP合成途径中的关键酶之一。目前,dxs基因已从陆地植物青蒿(Artemisia annua)[17]和欧洲红豆杉(Taxus baccata)[18]等中克隆,但在藻类中仅从雨生红球藻(Haematococcus pluvialis)[19]、集胞藻(Synechocystis sp.)[20]和葡萄藻(Botryococcus braunii)[21]等中有克隆的报道,而目前三角褐指藻中dxs基因克隆还未见相关报道。因此,从三角褐指藻中克隆dxs基因可以促进岩藻黄素合成过程分子模型的建立,为岩藻黄素代谢基因工程的深入开展提供依据。
dxs基因的表达受到许多因素的调控,茉莉酸甲酯(MeJA)、花生四烯酸(AA)和硫酸铈铵(ACS)等诱导子均是dxs基因的主要诱导因子。在外源MeJA的诱导下,葡萄dxs基因表达上调,可以促进葡萄果皮中单萜物质的积累[22]。在MeJA处理48h后,雷公藤dxs基因RNA表达量显著上调,且雷公藤甲素的含量提高3倍以上[23]。雨生红球藻dxs基因参与MeJA对虾青素含量的调控,且dxs基因转录水平与虾青素含量呈正相关[20]。在MeJA、AA和ACS诱导下,银杏内酯的积累与银杏dxs基因转录水平增加有关[24]。Li等[25]研究表明,光合诱导素(PIF)可通过提高光合效率和增强pds、lcyb等基因表达水平来促进岩藻黄素的积累。郑小恽等[26]发现敌草隆(DCMU)处理可以抑制三角褐指藻岩藻黄素合成相关基因的表达,从而使藻细胞内岩藻黄素含量降低。已有研究证实,光照是影响岩藻黄素合成的主要环境因素[27],徐润洁等[28]用红光处理三角褐指藻后,发现岩藻黄素含量上升与合成途径中下游基因的表达有关。光质、光合促进剂和光合抑制剂除了对岩藻黄素下游途径基因、光合作用相关基因起调控作用以外,是否对岩藻黄素合成上游途径基因,特别是MEP途径的第一个限速酶基因dxs起调控作用,目前还未见报道。因此,本实验研究MeJA、AA、ACS、PIF、DCMU和光质等6种不同外源因素对三角褐指藻dxs基因表达的影响,探究岩藻黄素生物合成与三角褐指藻dxs基因表达的相关性,明确岩藻黄素合成是否与上游MEP合成途径有关,为进一步探明外源因素调控三角褐指藻岩藻黄素生物积累的分子机制提供参考。
1 材料与方法
1.1 三角褐指藻总RNA的提取及dxs基因序列获得
三角褐指藻藻种由宁波大学海洋学院植物生理生化重点实验室提供。采用f/2培养基培养三角褐指藻,置于12h光照∶12h黑暗的恒温培养箱中[26]。取对数生长期(第5天)的藻液90 mL,4℃,5000 r/min离心10min,用RNA提取试剂盒(OMEGA,美国)提取三角褐指藻RNA。用HiScrit Ⅱ 1st strand cDNA Synthesis Kit反转录试剂(南京诺维赞生物科技股份有限公司)将RNA 反转成cDNA。利用Q-PCR方法准确检测cDNA文库的有效浓度,将质检合格的cDNA文库送至杭州联川生物技术公司进行Illumina HiSeqTM2000 高通量测序。根据转录组测序结果,设计三角褐指藻dxs基因ORF扩增引物(F: 5′-ATGCGTCTATCCAGCGCTCTAT-3′,R: 5′-CTAG TCCTGCAATTGCGGAAC-3′),进行PCR反应,电泳检测后,回收测序加以验证。
1.2 三角褐指藻DXS蛋白生物信息学分析
在DNAMAN5.0软件上分析三角褐指藻dxs基因cDNA全长序列。通过NCBI在线网站查找其他16个物种的DXS蛋白序列。分别通过Vector NTI 7.1软件、ProtParam在线网站(http://web.expasy.org/cgi-bin/protparam/protparam)和ProtScale在线软件(http://web.expasy.org/cgi-bin/ protscale/),对三角褐指藻DXS蛋白进行多序列比对、基本特征分析和疏水性/亲水性预测。通过NetPhosK 2.0 Server(http://www.cbs.dtu.dk/ services/NetPhos/)预测三角褐指藻DXS蛋白中磷酸化位点的位置及数量。通过SWISS-Model(http://swissmodel.expasy.org/ interactive)在线软件预测三角褐指藻DXS蛋白的三维结构。用TMHMM 2.0 Server(http://www.cbs.dtu.dk/services/Net Phos/)预测三角褐指藻DXS蛋白的跨膜结构域。用TargetP 1.1 Server(http://www. cbs.dtu.dk/services/TargetP/)预测三角褐指藻DXS蛋白的亚细胞定位。用Expasy网站预测DXS蛋白编码的氨基酸的理化性质。用CBS、Predictprotein、COILS与TM pred在线软件综合分析三角褐指藻DXS蛋白。用MEGA7.0软件以NJ法(Neighbour joining,bp值设为1000,其他参数默认)对17个物种的DXS蛋白构建系统进化树(表1)。

表1 进化树所用物种Tab. 1 The species for the phylogenetic tree
1.3 三角褐指藻dxs基因的表达调控
在三角褐指藻培养至对数期(第5天)时,用不同浓度的MeJA(0、50、100、200、500和1000 μmol/L)、AA(0、0.1、0.5、2.5、12.5、62.5和312.5 mg/L)、ACS(0、0.2、0.4、0.8和1.6 mg/L)、PIF(0、0.01、0.05、0.10、1.00和10.00 μg/L)、DCMU(0、0.1、0.2、0.4、0.8和1.0 mg/L)和不同LED单色光质[白光W(380—750 nm)、红光R(630—680 nm)、黄光Y(560—590 nm)、蓝光B(470—480 nm)、绿光G(520—530 nm)和紫光P(380—420 nm)]对藻液进行诱导处理24h,分别提取经诱导处理24h的三角褐指藻RNA,反转录成cDNA。每个处理设3次重复。以β-actin为内参基因,分别设计β-actin引物(QF: 5′-CGTGACTTGACGGACTACCTG-3′,QR: 5′-TAGTTTTTTCCAGAGCCGAG-3′)和dxs引物(QFdxs: 5′-TTGCTGAACAACACGCTGTGAC-3′,QRdxs: 5′-ACCATCGTTACCAAC CAAGCCA-3′)。荧光定量PCR反应体系为: cDNA 2 μL,2×SRYB 10 μL,F-primer 0.8 μL,R-primer 0.8 μL,ddH2O 6.4 μL,构成20 μL体系。荧光定量PCR反应程序为: 95℃变性5min后,95℃变性25s,56℃退火25s,72℃延伸25s,扩增40轮后,72℃延伸10min。用荧光定量PCR技术得到不同外源因素浓度处理下dxs基因的表达量。以不同处理下三角褐指藻dxs基因转录量为原始数据,用 2-ΔΔCt法计算三角褐指藻dxs基因的相对表达量,应用SPSS25.0单因素方差分析(Oneway ANOVA) 分析不同处理间的显著性差异,P<0.01表示差异极显著,P<0.05表示差异显著。
1.4 三角褐指藻dxs基因表达与岩藻黄素含量的相关性分析
以加入MeJA等外源因素为初始时间,用不同外源因素处理至第5天,取100 mL三角褐指藻藻液,4℃,52000×g,10min,弃上清,将藻体沉淀冷冻干燥48h后称重,三角褐指藻岩藻黄素提取方法参照俞凯等[29]。将藻粉溶于无水乙醇(1∶40),60℃浸提1h,6000 r/min离心8min,重复浸提一次。取稀释100倍的上清液,用紫外分光光度计测定其445 nm处的吸光值(OD),控制OD小于0.8。三角褐指藻岩藻黄素含量测定方法参照陈若莹等[30]。根据公式(A445×V)/(4×W)计算三角褐指藻岩藻黄素含量。其中,A445为稀释后的上清液在445 nm处的吸光度,V为稀释前上清液的体积,W为样品质量[28]。采用SPSS25.0软件进行线性回归拟合,分析不同处理下三角褐指藻dxs表达量与岩藻黄素含量的相关性。
2 结果
2.1 三角褐指藻dxs基因的克隆和序列分析
分析三角褐指藻转录组测序结果,获得了三角褐指藻dxs基因cDNA序列(GenBank: XM_0021 76350.1),全长为2476 bp,ORF长度为2193 bp,编码730个氨基酸。将测序得到的三角褐指藻dxscDNA序列提交NCBI网站进行比对,发现其与基因组注释信息的一致性达到100%[31],证明了三角褐指藻dxs基因cDNA序列的正确性。在氨基酸第197至第227位存在DXS酶特征结构域,磷酸硫胺素(ThDP)结合位点(ThDP-binding),序列为GDGA-TG-A-EAMN-AG-----M-V-LNDN[32],在氨基酸第479至第513位存在序列为DRAGX28PXD的转酮醇酶保守结构域[33]。
2.2 三角褐指藻DXS蛋白的生物信息学分析
三角褐指藻DXS蛋白的氨基酸序列理化性质分析结果显示,三角褐指藻D X S的分子式为C3511H5590N976O1057S29,共11163 个原子,理论相对分子质量(Mw)为79.31 kD,pI为6.65。三角褐指藻DXS蛋白正电荷氨基酸(Arg+Lys)总数为77个,负电荷氨基酸(Asp+Glu)总数为80个。赖氨酸(Gly)是三角褐指藻DXS蛋白中含量最丰富的氨基酸,占10.5%,色氨酸(Trp)含量最少,为0.3%。三角褐指藻DXS蛋白不稳定系数低至38.25%,属于稳定蛋白。疏水性/亲水性预测结果显示,三角褐指藻DXS蛋白多肽链中第592位丝氨酸(Ser)的亲水性最强,第7位赖氨酸(Lys)的疏水性最强。三角褐指藻DXS蛋白亲水性的总平均值为0.8645,表明该蛋白属于亲水性蛋白。该蛋白有TM-螺旋、信号肽、卷曲螺旋和跨膜区域。无规则卷曲占比最高,为40.55%,β-转角比例最低,为6.16%。
三角褐指藻DXS蛋白三级结构分析结果表明(图1),三角褐指藻DXS蛋白含有ThDP-binding高度保守区域(GDGA-T-G-A-EAMN-AG-----M-VLNDN)和转酮醇酶结构域(DRAGX28PXD)。ThDPbinding为转酮醇酶家族中ThDP辅酶的结合位点,可以从2-酮糖中转移2-羟基乙醛基,生成醛糖[34]。转酮醇酶结构域是转酮醇酶的关键序列之一,可能与羟基丙酮酸转化为乙醇醛的催化过程有关[35,36]
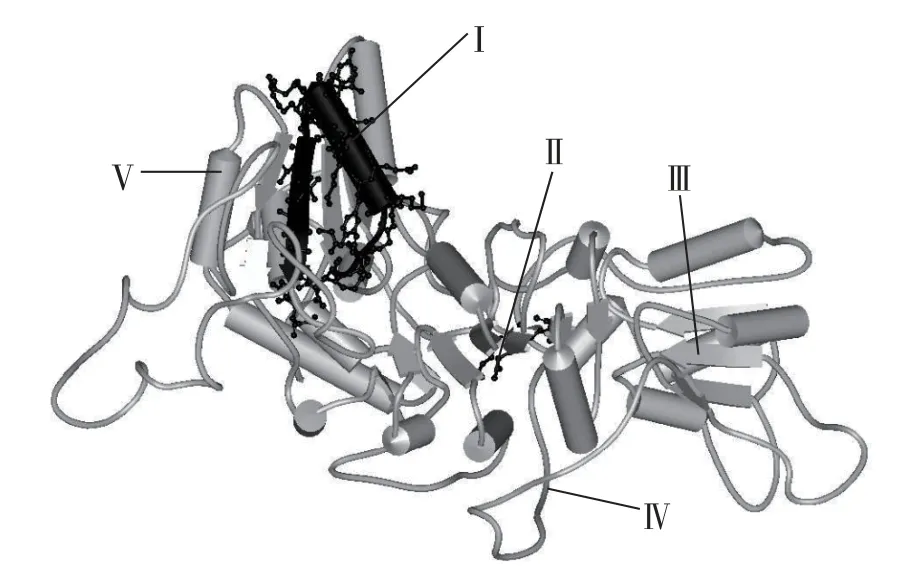
图1 三角褐指藻DXS蛋白三维结构预测图Fig. 1 Prediction of DXS spatial structure in Phaeodactylum tricornutum
2.3 三角褐指藻DXS蛋白系统进化树分析
为进一步了解三角褐指藻DXS的进化关系,利用MEGA7.0软件对包括三角褐指藻DXS在内的17种DXS蛋白构建系统进化树。结果表明(图2),进化树分为高等植物和藻类2个分支,高等植物DXS蛋白进一步分为DXS1和DXS2两支。藻类DXS蛋白聚类为3个分支,分别为硅藻门(Bacillariophyta)、红藻门(Rhodophyta)和绿藻门(Chlorophyta)分支。其中,青蒿(Artemisia annua)、番茄(Solanum lycopersicum)、拟南芥(Arabidopsis thaliana)和银杏(Ginkgo biloba)聚类为DXS1类蛋白,长春花(Catharanthus roseus)、万寿菊(Tagetes erecta)、丹参(Salvia miltiorrhiza)和辣薄荷(Mentha piperita)聚类为DXS2类蛋白。龙须菜(Gracilariopsis chorda)、角叉菜(Chondrus crispus)和紫球藻(Porphyridium purpureum)等3种红藻门藻类聚类在同一个分支中,盐生杜氏藻(Dunaliella salina)、葡萄藻(Botryococcus braunii)和莱茵衣藻(Chlamydomonas reinhardtii)等3种绿藻聚类在相同进化分支中,三角褐指藻(Phaeodactylum tricornutum)、圆柱拟脆杆藻(Fragilariopsis cylindrus)和大洋海链藻(Thalassiosira oceanica)等硅藻在进化树上聚为一支。这与目前藻类分类学的结果一致。其中圆柱拟脆杆藻DXS蛋白与三角褐指藻DXS的进化关系最近,表明获得的DXS蛋白确为藻类蛋白。

图2 三角褐指藻DXS氨基酸序列NJ系统进化树Fig. 2 NJ phylogenetic tree of DXS amino acid sequence in Phaeodactylum tricornutum
2.4 不同外源因素处理对三角褐指藻dxs基因表达的影响
研究6种外源因素诱导对三角褐指藻dxs基因相对表达水平的影响,结果表明(图3),适宜条件的外源因素可以促进三角褐指藻dxs基因的表达。100 μmol/L MeJA、62.5 mg/L AA、1.6 mg/L ACS、1.00 μg/L PIF、0.2 mg/L DCMU和紫光处理均能促进三角褐指藻dxs基因的表达,且dxs基因表达量最高。同时,在MeJA和光质诱导下,三角褐指藻dxs基因的转录量的变化与岩藻黄素含量变化趋势一致,表明三角褐指藻dxs基因参与MeJA和光质对三角褐指藻岩藻黄素生物合成的调控。
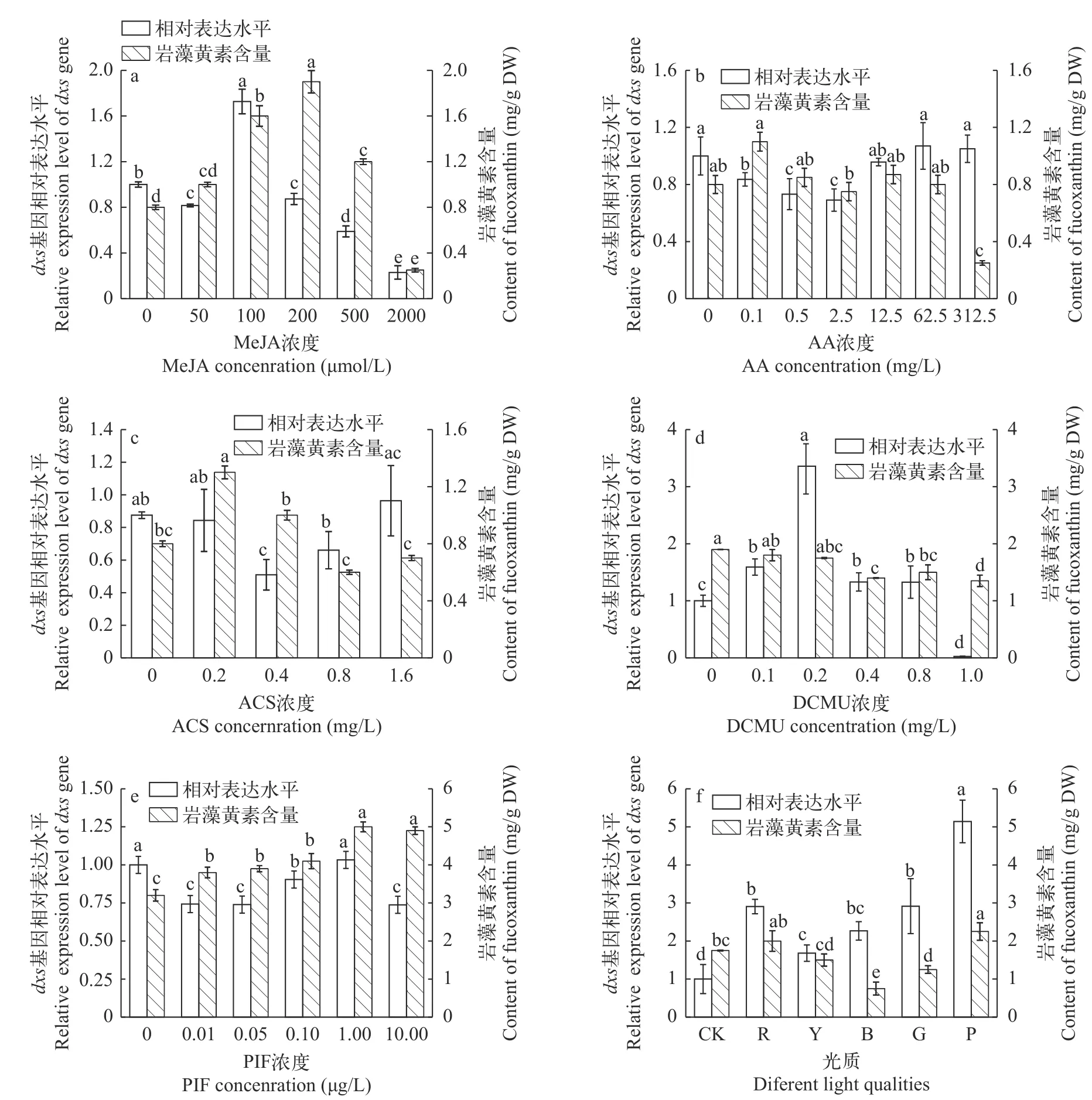
图3 六种外源因素对岩藻黄素含量和三角褐指藻dxs基因表达的影响Fig. 3 Effects of six exogenous factors on fucoxanthin content and dxs transcription levels in Phaeodactylum tricornutum
对三角褐指藻dxs基因的相对表达水平和岩藻黄素含量进行一元回归相关性分析,结果表明(图4),在光质处理下三角褐指藻岩藻黄素含量和三角褐指藻dxs基因相对表达量呈Power曲线相关(R2=0.598,P<0.01),且当三角褐指藻dxs基因转录水平随光照波长的增加出现下降(绿光、蓝光)时,岩藻黄素相对含量呈下降趋势。在MeJA处理下三角褐指藻dxs基因表达与岩藻黄素含量呈Allometricl曲线相关(R2=0.383,P=0.01)。当三角褐指藻dxs基因表达水平因MeJA浓度升高而上调时,岩藻黄素的含量直线上升。在100 μmol/L MeJA的诱导下,三角褐指藻dxs基因的表达水平是对照组的1.7倍,且差异极显著(P<0.01)。
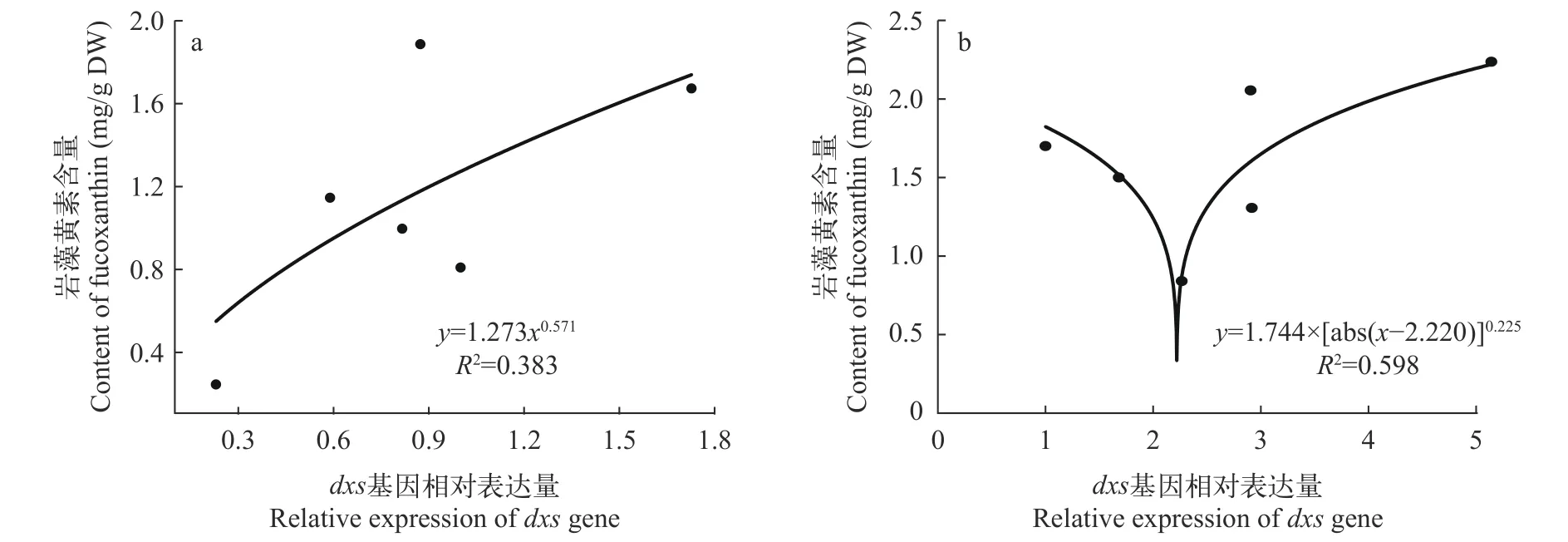
图4 三角褐指藻dxs基因相对表达量和岩藻黄素含量的相关性分析Fig. 4 Correlation analysis of content of fucoxanthinand and dxs transcription levels in Phaeodactylum tricornutum
3 讨论
植物近80%的类胡萝卜素来源于MEP途径。DXS是 MEP途径中的第一个酶,属于磷酸硫胺素(ThDP)依赖性酶,与转酮醇酶同源。对包括三角褐指藻dxs基因在内的9种藻类氨基酸序列进行比对发现,所有藻类DXS氨基酸序列都含有ThDP结合位点(ThDP-binding)和转酮醇酶保守结构域。作为ThDP依赖酶的特征结构,ThDP-binding几乎存在于所有丙酮酸脱氢或脱羧酶及氧代脱氢或脱羧酶中,并具有将一个乙醇醛从5-磷酸木糖转移到a-(R)-羟醛的功能。此外,转酮醇酶能参与植物碳水化合物代谢中的磷酸戊糖循环[37],其保守结构域可能与副产物乙酰-ThDP的形成阻断反应有关[24,36,38]。这与三角褐指藻dxs在类胡萝卜素合成途径中催化丙酮酸实现酮基转移的功能一致。系统进化树分析结果表明,三角褐指藻的DXS氨基酸系列与同类硅藻圆柱拟脆杆藻的同源性较高(79.7%)。高等植物和藻类分别聚类为一支,高等植物中同类型的DXS蛋白聚为一小支,藻类中同门类的藻类DXS蛋白也分别形成分支,符合常规藻类分类学[39]。
研究表明,不同物种的dxs基因在MeJA和光诱导下均表现出高表达,如银杏(Ginkgo biloba)[40]、丹参(Salvia miltiorrhiza)[15]和青蒿(Artemisiaannua)[17]等,这与本实验结果一致。MeJA作为通用诱导剂,可以通过刺激植物细胞内信号分子的形成激活植物对非生物胁迫的防御反应,而这些反应通常触发萜类物质合成关键基因的转录调控,并诱导次生代谢产物的积累[41]。例如MeJA可以通过刺激D-氨基葡萄糖6磷酸的消耗,上调长春碱合成关键基因dxs的转录水平,从而促进长春花中萜类物质的积累[42]。MeJA处理可以通过保持穿心莲(Andrographis paniculata)dxs基因的高表达水平来提高穿心莲内酯的含量[43]。类胡萝卜素具有强抗氧化性,可以在逆境胁迫下大量合成以猝灭植物细胞内ROS活性氧的合成。作为硅藻类胡萝卜素的大类,岩藻黄素不仅在藻体被光氧化时起保护作用,而且与叶绿素等共同构成捕光复合物,参与光合作用中捕获、收集和转移光能的过程[26,44]。此外,光照可以通过影响藻类的固碳作用改变藻类的光合生理和生长速率,在强光下,三角褐指藻可以减少固碳作用的能量消耗,并将减少的能耗用于藻细胞增长[45]。研究发现,在390 nm(紫光)和680 nm(红光)处三角褐指藻产生最大吸收峰,表明三角褐指藻主要吸收红光和近紫光[46]。本研究发现,在红光和紫光诱导下,三角褐指藻dxs基因表达量上升,三角褐指藻岩藻黄素含量显著提高,这与Valle等[24]的研究结果一致。究其原因,一方面可能是在LED单色光胁迫下,藻细胞光氧化增强,细胞内活性氧含量增加,从而促进岩藻黄素的积累[44],这或许可以解释在不同光质处理下,三角褐指藻dxs基因转录水平均上调的现象。另一方面,在海水条件下,光谱中的红光和紫光会随深度增加而迅速消减,但在实验条件下,各单色光的光强一致。因此,对藻体而言,在红光和紫光等的强光胁迫下,藻细胞增殖速度加快,三角褐指藻总岩藻黄素含量提高。此外,在AA、ACS、PIF和DCMU处理下,三角褐指藻dxs基因表达量和岩藻黄素含量没有明显的相关性,这可能与MEP途径中调控dxs基因表达的方式复杂性有关。研究表明,IPP和DMAPP都通过与ThDP竞争结合位点,来反馈抑制dxs基因的表达[47]。通过碳标记技术,Ghirardo等[48]发现DMAPP对DXS酶活性的反馈抑制机制解释了银灰杨(Populus canescens)合成萜类物质所需碳通量的减少。拟南芥中DXS转录本及蛋白水平比较分析结果表明,dxsmRNA水平和蛋白质水平并不总是一致。这与在光质条件下,三角褐指藻dxs基因和岩藻黄素含量的Allometricl相关曲线趋势符合,当岩藻黄素含量低时,上调或下调三角褐指藻dxs基因的表达量均可使岩藻黄素含量提高。除反馈抑制外,在所有MEP蛋白中,DXS蛋白的转录后调控最为明显。例如,在不同的拟南芥MEP突变体发育时期中,dxs基因的表达水平均比野生型植物高10倍以上,但发育前期DXS蛋白积累水平远高于发育后期,且发育早期DXS蛋白积累与类胡萝卜素含量大量增加有关。因此,该蛋白的转录后调控可能作为一种关键的调控手段,对MEP途径的合成效率产生影响[49]。由于目前三角褐指藻等硅藻的岩藻黄素合成途径仍未被完全阐明,外源因素很有可能通过多条多层面的岩藻黄素合成通路调控单个基因的表达,因此三角褐指藻dxs基因调控岩藻黄素合成的机理仍有待进一步研究。
