4 种大型红藻类菌胞素氨基酸的提取工艺优化与分离鉴定
2022-09-13钱亮亮程同杰沈彦邓小群朱文轩孙颖颖
韩 秀,钱亮亮,程同杰,沈彦,邓小群,朱文轩,孙颖颖,
(1.江苏海洋大学,江苏省海洋生物技术重点实验室,江苏连云港 222005;2.连云港市质量技术综合检验检测中心,江苏连云港 222006)
类菌胞素氨基酸(Mycosporine-like amino acids,MAAs)广泛分布于水生生物中,在大型红藻中含量丰富。MAAs 是一类小分子次级代谢产物,骨架为氨基环己烯酮或氨基环己烯胺的环状结构(图1),最大吸收波长在310~360 nm,是一种天然高效紫外线吸收剂。目前,已鉴定结构的MAAs 接近30 种,主要包括asterina-330、mycosporine-glycine、porphyra-334 和palythine 等。研究表明,MAAs 具有明显的抗氧化作用,能抑制过氧化脂质生成、清除自由基、保护皮肤细胞不受氧自由基过度氧化的影响,还具有调节渗透等多种生理活性。
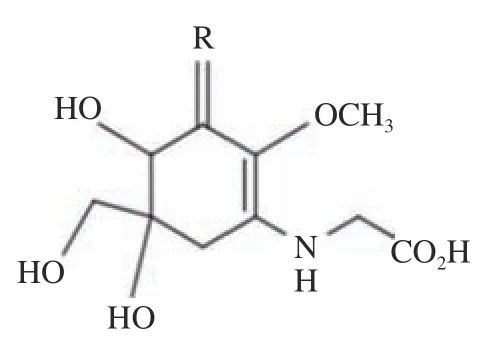
图1 MAAs 基本结构Fig.1 Basic structure of MAAs
大型海藻是MAAs 的主要来源之一,usujirene、palythenic acid 等MAAs 仅存在于藻类。大型红藻是MAAs 的理想来源,不仅含量高,且种类丰富,已探明的MAAs 种类超过22 种,prasiolin和bostrychines A~F等MAAs 仅在大型红藻中发现。此外,大型红藻还含有很多未知MAAs。目前,国内外对大型海藻MAAs 研究尚处于初级阶段,多数集中在分布、环境因子诱导、活性等,大型红藻MAAs 的提取和分离研究非常少。近10年,仅见、、麒麟菜(sp.)、海萝藻()、弓江蓠()、张氏江蓠()和条斑紫菜()等MAAs 提取和分离的相关研究。我国大型红藻种类高达600 多种,绝大多数的MAAs提取和分离为研究空白,有必要进行深入研究。
本文整理了2001~2021 年期间发表在Web of Science、Springer、Google Scholar 和CNKI 数据库收录的有关大型海藻MAAs 研究,发现MAAs 含量高于3 mg/g 的大型红藻主要集中在头发菜目(Bangiales)和仙菜目(Ceramiales),龙须菜目(Gracilariales)也有少数大型海藻MAAs 含量较高(图2)。本文选定红毛苔()、石花菜()、菊花江蓠()和江蓠(sp.)4 种大型红藻,它们分别归属于头发菜目、仙菜目和龙须菜目。目前,国内外尚未见此4 种MAAs 的提取和分离研究。基于此,本实验研究了提取温度、时间、次数和料液比对4 种大型红藻MAAs 提取物得率的影响,建立优化提取工艺。根据MAAs 提取物得率和薄层层析检测结果,发现红毛苔和江蓠中MAAs 含量较高;进一步,采用硅胶柱层析对此2 种大型红藻MAAs 提取物进行分离。最后,通过紫外光谱(Ultraviolet spectrum,UV)、高效液相色谱(High Performance Liquid Chromatography,HPLC)和质谱(Mass Spectrometry,MS)测定,并与已有文献比较,鉴定4 种大型红藻MAAs 组成;以期为大型海藻源MAAs 的分离研究奠定实验基础和提供理论参考。

图2 MAAs 含量>3 mg/g 的大型红藻的目类分布Fig.2 Ordered distribution of MAAs contents present at >3 mg/g in red macroalgae
1 材料与方法
1.1 材料与仪器
红毛苔()、石花菜()、菊花江蓠()、江蓠(sp.)、甲醇、乙醇 分析纯,江苏碧蓝海洋生物科技有限公司;甲醇、甲酸 色谱纯,DIKMA PURE 色谱溶剂;硅胶粉200~300 目 青岛海洋化工有限公司。
CPA224S 电子天平德国 赛多利斯股份公司;DKZ-2 电热恒温振荡槽 上海精宏实验设备有限公司;R-210 真空旋转蒸发器 瑞士步琦;T9CS 双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;QTUM0001X 超纯水机 法国MILLIPORE;TSQ Quantum Access 液质联用仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 原料处理 大型红藻干品经清洗、冷冻干燥、超微粉碎机粉碎后,过40 目筛备用。
1.2.2 MAAs 提取工艺 称取大型红藻干粉末10 g加入到一定体积的25%甲醇溶液中,搅拌后密封放入恒温水浴摇床中,在设定温度下振荡浸提一定时间。提取结束后,取出冷却至室温,倒出浸提液。重新加入相同体积的25%甲醇溶液,按照上述条件重复浸提设定提取次数。浸提液合并、过滤和减压蒸发后,加入无水乙醇(含量为80%),−20 ℃下沉淀6 h。4 ℃下,9000 r/min 离心20 min,移出上清液,沉淀保留。用蒸馏水洗涤沉淀2~3 次,洗涤液和先前的上清液合并,45 ℃下减压浓缩后(除去有机溶剂),冷冻干燥,制备到MAAs 提取物。
1.2.3 单因素实验
1.2.3.1 提取温度对MAAs 提取物得率的影响 提取温度设定为35、40、45、50 和55 ℃,提取时间、次数和料液比分别为2 h、2 次和1:20 g/mL。每个实验设定3 个平行样,MAAs 提取同1.2.2。
1.2.3.2 提取时间对MAAs 提取物得率的影响 提取时间依次为1、2、3 和4 h,提取温度、次数和料液比设定为45 ℃、2 次和1:20 g/mL。每个实验设定3 个平行样,MAAs 提取同 1.2.2。
1.2.3.3 提取次数对MAAs 提取物得率的影响 设定提取次数为1、2、3 和4 次,提取温度、时间和料液比设定为45 ℃、2 h 和1:20 g/mL。每个实验设定 3 个平行样,MAAs 提取同 1.2.2。
1.2.3.4 料液比对MAAs 提取物得率的影响 料液比分别为1:10、1:15、1:20 和1:25 g/mL,提取温度、时间和次数设定为45 ℃、2 h 和2 次。每个实验设定 3 个平行样,MAAs 提取同 1.2.2。
1.2.4 正交试验 在上述单因素实验基础上,选定L(3)正交试验表,考察提取提取温度、提取时间、提取次数和料液比等4 个因素对4 种大型红藻MAAs提取物得率的影响(表1),实验中不设定平行样。
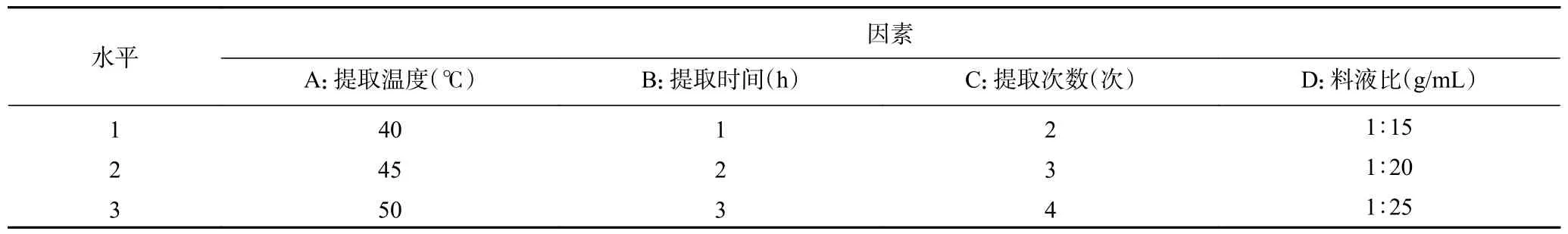
表1 正交试验因素及水平设计Table 1 Factors and levels of orthogonal experiments
1.2.5 MAAs 提取物得率的计算

式中:W 为MAAs 粗提物得率,mg/g;m 为粗提物质量,g;M 为红藻粉末质量,g。
1.2.6 MAAs 分离 参照文献[1,7],并对分离方法进行了主要改进。取1.0 g MAAs 提取物加载在硅胶柱层析(3.0 cm×25 cm,200~300 目)上,洗脱剂为甲醇/乙醇/蒸馏水(8:10:0.5),洗脱速度为1.0 BV/h,洗脱2.5 倍柱体积(BV),每管50 mL 洗脱馏分。馏分减压浓缩后,采用薄层层析和紫外光谱检测MAAs。
1.2.7 MAAs 检测
1.2.7.1 薄层层析定性检测 参照前期研究建立的薄层层析法,并稍加改进。待测样品溶解于蒸馏水中,配制浓度为1.6 g/L,点样在硅胶G 板上,以甲醇/乙醇/蒸馏水(8:10:0.5,体积比)为展开剂。展开结束后,吹干G 板,喷洒碘化秘钾试剂(7.3 g 碘化铋钾,冰醋酸10 mL,蒸馏水60 mL),静置15~20 min,呈现黄或橙色斑点为含氮化合物的阳性反应,可初步确定为目标提取物或目标组分。
1.2.7.2 紫外光谱检测 取1 mL 上述薄层层析检测确定的目标提取物或目标组分,进行200~400 nm 波长扫描。在310~360 nm 范围内有吸收的待测样品,可确定为含有MAAs。
1.2.7.3 高效液相色谱和质谱检测 MAAs 提取物0.005 g 溶于10 mL 蒸馏水,微孔滤膜过滤后,进行高效液相色谱(HPLC)和质谱(ESI-MS)检测。HPLC分析:柱温为25 ℃,色谱柱为Waters HSS T3(4.6 mm×150 mm,3.5 μm)。流动相A 为0.2%甲酸水溶液,流动相B 为0.2%甲酸甲醇溶液。洗脱梯度:0~20 min,B%:0~70%;流速1.0 mL/min,波长330 nm;进样量100 μL。ESI-MS 测定:喷雾气压45 psi,氮气流速10.0 L/min,干燥温度350 ℃,破碎电压100 V,毛细管电压4500 V,全扫描(Scan),参比离子质荷比:121.0509,922.0098,为参比离子对测定结果进行实时矫正,分辨率m/z 在922.0098 处全扫描响应为11300,质荷比(m/z)范围在120~1000。
1.2.8 大型红藻理化指标测定 采用GB 5009.3-2016、GB 5009.4-2016、GB 5009.5-2016、GB 5009.6-2016 标准方法,测定大型红藻中水分、蛋白质、脂肪、碳水化合物等成分。
1.3 数据处理
实验数据采用SPSS11.5 软件包进行独立样本检验统计分析,<0.05 为显著性差异,<0.01 为极显著性差异。
2 结果与分析
2.1 4 种大型红藻MAAs 提取工艺的优化
2.1.1 单因素实验结果
2.1.1.1 提取温度对4 种大型红藻MAAs 提取物得率的影响 由图3 可知,4 种大型红藻MAAs 提取物得率随提取温度的升高而增大,在40~45 ℃时,MAAs 提取物得率达到最大值。当提取温度继续增加时,4 种大型红藻MAAs 提取物得率开始下降,尤其红毛苔和江蓠MAAs 提取物得率显著(<0.05)降低。可能由于温度升高,多糖等水溶性物质更易溶出,在去除这些物质的过程中造成了更多的MAAs损失;也可能是MAAs 中某些MAA 发生降解,具体原因还需要进一步研究。在MAAs 提取过程中,提取温度是一个容易被忽视的影响因素,常见的提取温度在4~45 ℃范围内。本文研究表明,提取温度是一个明显影响红毛苔等4 种大型红藻MAAs 提取物得率的因素,45 ℃是较适宜的提取温度。
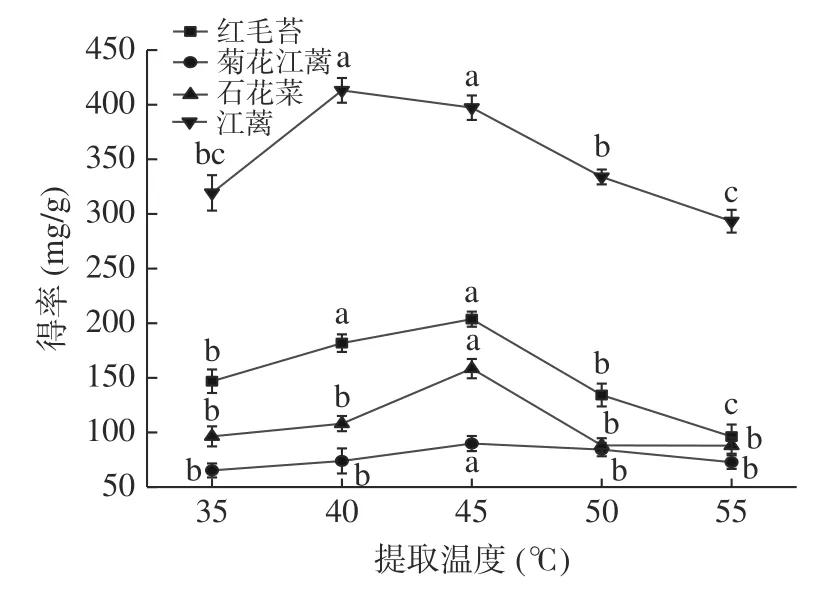
图3 提取温度对4 种大型红藻MAAs 提取的影响Fig.3 Effects of extraction temperature on MAAs extraction from four species of red macroalgaes
2.1.1.2 提取时间对4 种大型红藻MAAs 提取物得率的影响 在图4 中,随提取时间的增加,4 种大型红藻MAAs 提取物得率增大。提取时间为2 h 时,MAAs 提取物得率均达到最大值。当提取时间继续增加时,4 种大型红藻MAAs 提取物得率呈现下降趋势。这可能是提取时间过长,水溶性物质溶出更多,导致后续去除这些物质时MAAs 损失量增大或者MAAs 提取物出现热分解现象。不同大型海藻MAAs 提取时间从几分钟到十几小时不等,推测这可能与MAAs 在藻体中位置有关,目前国内外尚未见大型海藻中MAAs 位置研究。除红毛苔外,提取时间对其余3 种大型红藻MAAs 提取物得率有显著影响(<0.05)。综上所述,2 h 是4 种红藻较适宜的提取时间。
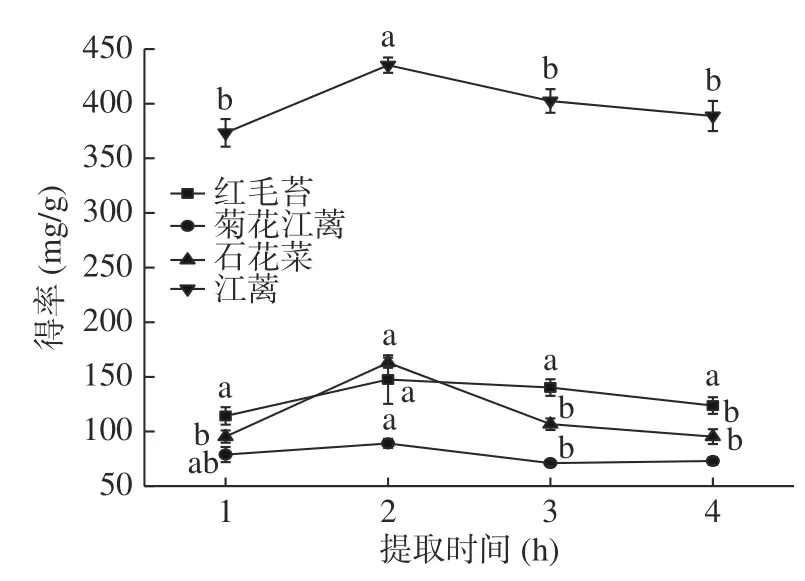
图4 提取时间对4 种大型红藻MAAs 提取的影响Fig.4 Effects of extraction time on MAAs extraction from four species of red macroalgaes
2.1.1.3 提取次数对4 种大型红藻MAAs 提取物得率的影响 图5 表明,提取次数不超过2 次(或3 次),菊花江蓠和石花菜(或红毛苔和江蓠)MAAs 提取物得率随提取次数增加而增大。当提取次数继续增加时,除红毛苔外,其它3 种大型红藻MAAs 提取物得率显著(<0.05)下降。提取次数过多会促使更多水溶性杂质被提取出来,导致在去除杂质过程中MAAs损失增加,从而导致提取次数增加而MAAs 提取物得率下降的现象。在海萝和江蓠等大型海藻MAAs提取过程中,提取次数也是2 次或3 次。综上所述,本文选择的提取次数为3 次。
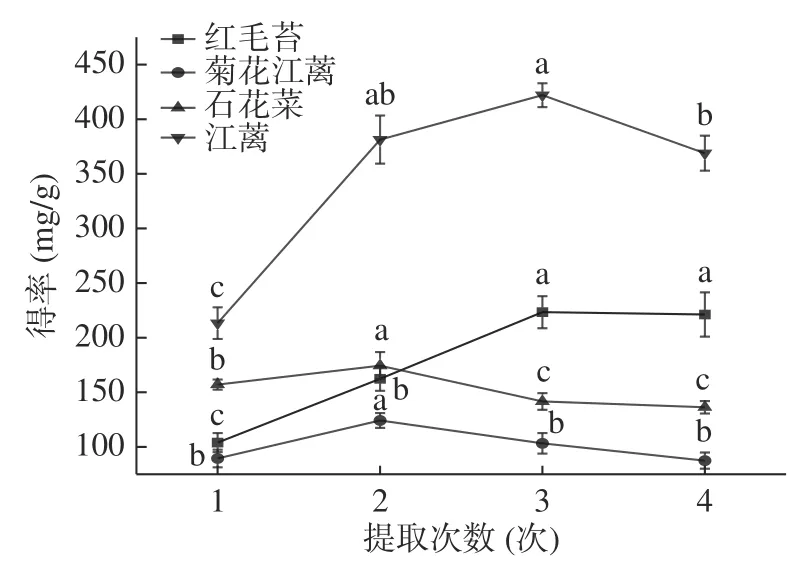
图5 提取次数对4 种大型红藻MAAs 提取的影响Fig.5 Effects of times on MAAs extraction from four species of red macroalgaes
2.1.1.4 料液比对4 种大型红藻MAAs 提取物得率的影响 在1:10~1:20 g/mL 范围内,随料液比增加,4 种大型红藻MAAs 提取物得率增大,在1:20 g/mL时,MAAs 提取物得率达到最大值(图6)。料液比继续增加,MAAs 提取物得率开始下降,特别是红毛苔和江蓠MAAs 提取物得率下降显著(<0.05),可能是越大的料液比溶出了越多水溶性杂质,在除去其过程中导致了更多的MAAs 损失。不同大型海藻MAAs提取时,料液比相差甚远。例如,紫菜、角石花菜()和等大型红藻MAAs 提取时,料液比设定为1:100 g/mL;海萝MAAs 提取料液比为1:67 g/mL;麒麟菜和张氏江蓠MAAs 提取时的料液比与本文的研究结果接近,为1:30 g/mL。综上所述,1:20 g/mL 是4 种红藻较适宜的提取料液比。

图6 料液比对4 种大型红藻MAAs 提取的影响Fig.6 Effects of solid-liquid ratio on MAAs extraction from four species of red macroalgaes
在前期研究基础上,本文选取25%甲醇为提取溶剂,从红毛苔等4 种大型红藻中提取MAAs。在已有报道中,MAAs 常用提取溶剂为15%~75%甲醇溶液,还有其它溶剂,例如,乙腈、0.2%醋酸水溶液(加入0.5%甲醇)和-辛基十二醇等。通过上述单因素实验,发现适当增大提取温度、时间、次数和料液比有利于4 种大型红藻MAAs 的提取。
2.1.2 正交试验结果 在单因素实验基础上,采用正交试验,进一步分析提取温度、时间、次数和料液比对4 种大型红藻MAAs 提取物得率的影响,结果见表2。通过对正交试验结果进行直观分析(计算过程略),可得到红毛苔、石花菜、菊花江蓠和江蓠MAAs 优化提取工艺,即分别为:45 ℃、3 h、4 次、1:25 g/mL;45 ℃、1 h、4 次、1:20 g/mL;45 ℃、2 h、3 次、1:15 g/mL;40 ℃、1 h、3 次、1:20 g/mL。
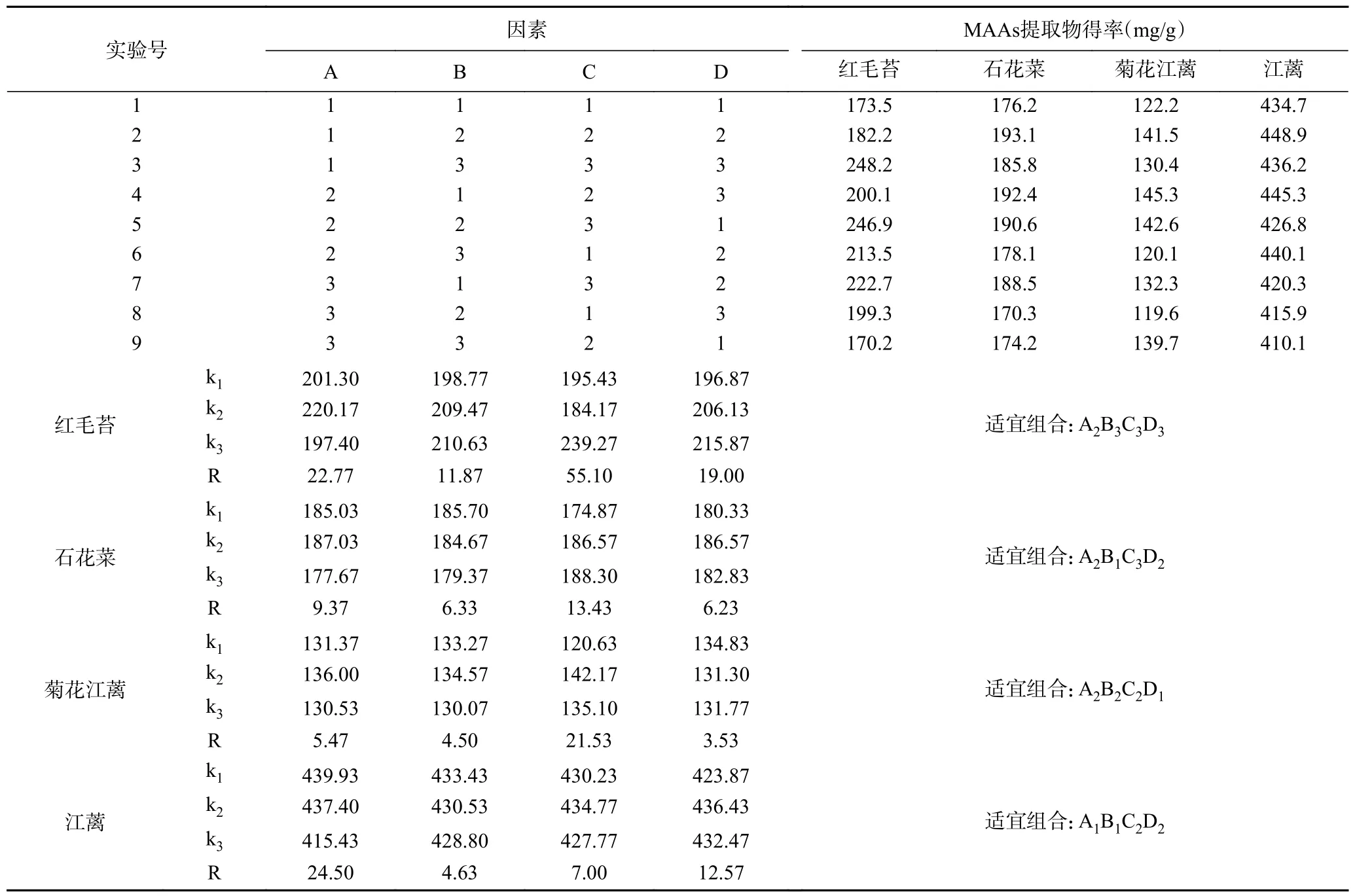
表2 正交试验结果Table 2 Results of the orthogonal experiment
应用上述优化提取工艺,制备到红毛苔、石花菜、菊花江蓠和江蓠MAAs 提取物,提取物得率依次为249.3、197.9、146.4 和449.5 mg/g。Lee 等采用50%乙醇提取大型红藻海萝和马泽藻(sp.),提取物得率依次为10.32%和11.77%,本文中4 种大型红藻提取物得率明显高于它们。在4 种大型红藻MAAs 提取过程中,还发现红毛苔MAAs 提取液经过处理后,仍然非常混浊,而其它3 种大型红藻MAAs 提取液澄清透明,本文认为很可能是大型红藻成分含量不同所致。采用国标方法,测定了4 种大型红藻营养成分(表3)。表3 表明,红毛苔蛋白质含量明显高于其它大型红藻。在后续研究中,可对红毛苔MAAs 提取液进行更有效的蛋白质去除。

表3 4 种大型红藻营养成分测定结果Table 3 Detection results of nutrient content from four red macroalgaes
2.2 4 种大型红藻MAAs 的检测
将4 种大型红藻MAAs 提取物进行薄层层析检测(图7)、紫外波长扫描(未列出)和高效液相色谱-质谱分析(图8)。从图7 可以看出,它们在硅胶板上均呈现了一个或几个黄色斑点(含氮化合物的阳性反应),这表明提取物中可能含有MAAs 成分。紫外光谱扫描显示出此4 种大型红藻MAAs 提取物在310~360 nm 范围内有吸收,符合MAAs 特征吸收。至此,在没有MAAs 标准品作为参照情况下,仍能确定提取物中存在MAAs。由此可见,硅胶薄层层析检测和紫外波长扫描结合可用于大型海藻MAAs 检测。此外,图7 中斑点面积大小可反映待测样品中MAAs 含量高低,这对于筛选高含量MAAs 的大型海藻而言非常直观。

图7 4 种大型红藻MAAs 薄层层析检测结果Fig.7 TLC detection results of MAAs from four red macroalgaes
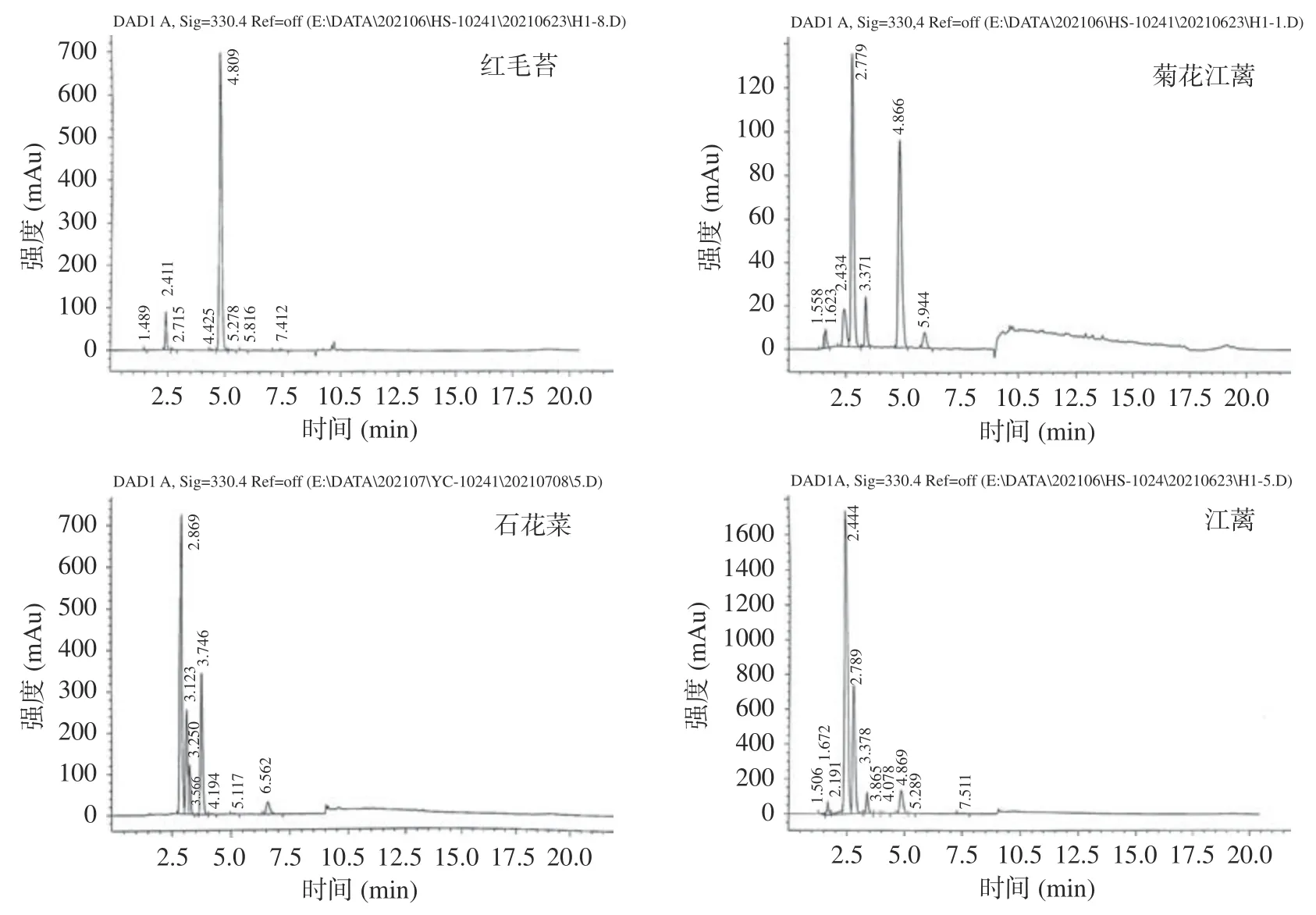
图8 4 种大型红藻MAAs 提取物的高效液相色谱图Fig.8 HPLC detection of MAA extracts from four red macroalgae
HPLC 是MAAs 常用分析和分离方法,本文也采用HPLC 来分析4 种大型红藻MAAs 组成。从图8 能够清晰地看出,红毛苔MAAs 提取物出现了8 个吸收峰,停留时间4.8 min 处吸收峰最明显;菊花江蓠MAAs 提取物在停留时间2.7 和4.8 min处吸收峰较明显;石花菜MAAs 提取物分别在停留时间2.8、3.1、3.7 和6.5 min 处出现了较明显的吸收峰;江蓠MAAs 提取物则在停留时间2.4、2.7、3.3 和4.8 min 处有较明显的吸收峰。由此表明,4 种大型红藻MAAs 提取物中MAAs 组成可能有所差异。
2.3 硅胶柱层析分离和质谱测定
上述实验表明,红毛苔和江蓠MAAs 提取物得率较高,故将它们进行硅胶柱层析分离。红毛苔MAAs 提取物经分离获得1 个组分H1(第5 管~第8 管);江蓠MAAs 提取物经分离获得2 个组分J1(第5 管)和J2(第9 管~第11 管)(图9)。随后,测定此3 个组分的HPLC 和MS。根据HPLC 和MS信息,并参考文献[23−24],能鉴定出组分H1、J1 和J2 中MAAs 组成(表4),即组分H1 中有4 种MAA,shinorine、palythine、porphyra-334 和palythenic acid;组分J1 中有4 种MAA,shinorine、palythine、porphyra-334 和palythenic acid;组分J2 为palythine 单体。硅胶柱层析、离子交换柱层析、高效液相色谱、C固相萃取小柱和HILIC等被用于大型海藻MAAs 分离,其中,采用硅胶柱层析分离MAAs 报道较少。上述结果表明,经硅胶柱层析分离,红毛苔和江蓠MAAs 提取物能获得较好的初步分离。此外,也测定了石花菜和菊花江蓠MAAs提取物的高效液相色谱和质谱。同样地,也得到它们中可能的MAAs 组成。

表4 MAAs 提取物硅胶柱层析分离组分的最大吸收波长、质谱、相对峰面积和MAAs 组成Table 4 Maximum absorption wavelength,MS values,relative peak area and composition of the isolated fractions of MAA extracts by silica gel column chromatography
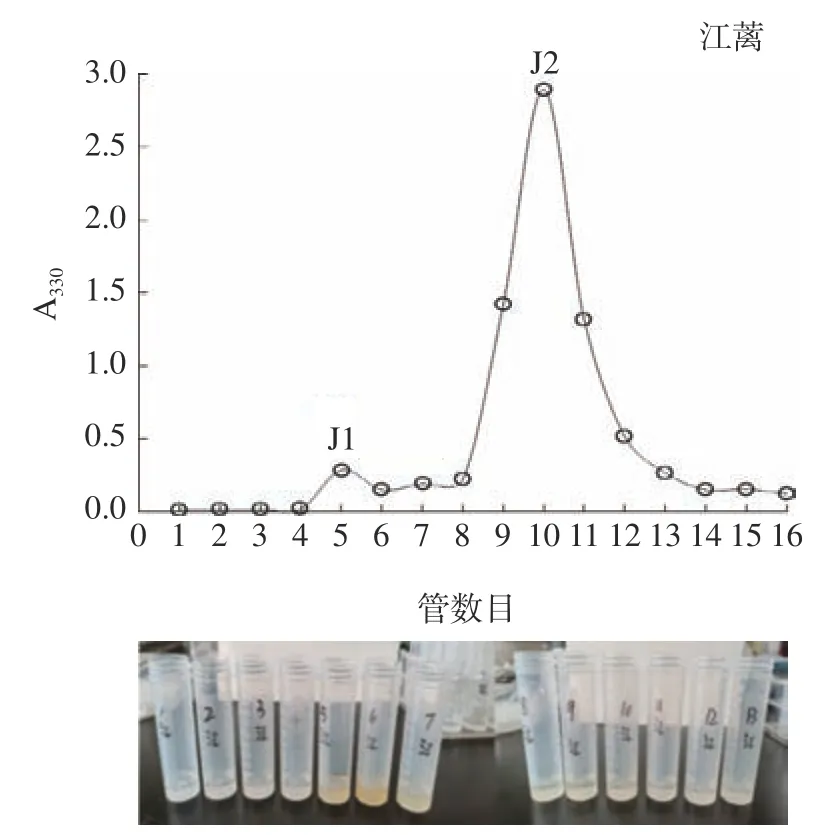
图9 江蓠MAAs 提取物的硅胶柱层析分离Fig.9 Isolation of MAA extracts from through Gracilaria sp.through silica gel column chromatography
Shinorine、palythine 和porphyra-334 是大型红藻中常见MAA,palythenic acid 目前仅在大型红藻中发现,该MAA 在浮游植物和微藻中较为常见。石花菜和菊花江蓠中存在palythinol、gadusol 和未知MAA(M-328 和M-330),这些未知MAA 需要后续继续进行研究。
3 结论
本文优化了红毛苔、石花菜、菊花江蓠和江蓠MAAs 的提取工艺,发现当提取温度、时间、次数和料液比依次为45 ℃、3 h、4 次、1:25 g/mL;45 ℃、1 h、4 次、1:20 g/mL;45 ℃、2 h、3 次、1:15 g/mL;40 ℃、1 h、3 次、1:20 g/mL 时,能获得最大的MAAs 提取物得率,提取物得率依次为249.3、197.9、146.4 和449.5 mg/g。将紫外光谱和薄层层析检测结合,对4 种大型红藻MAAs 提取物进行定性检测的同时还能粗略比较提取物中MAAs 含量高低,可作为大型海藻MAAs 的快速筛选方法。硅胶柱层析可用于红毛苔和江蓠MAAs 提取物的分离,能获得较好的初步分离效果。经紫外光谱扫描、高效液相色谱和质谱分析,并与已有文献比较,确定了红毛苔和江蓠中MAAs 为shinorine、palythine、porphyra-334 和palythenic acid;石花菜和菊花江蓠MAAs 主要由shinorine、palythine、porphyra-334、palythenic acid 和palythinol 组成,还有少量未知MAAs。
本文建立了红毛苔、石花菜、菊花江蓠和江蓠的提取和初步分离工艺,并明确了其MAAs 组成,为大型海藻源MAAs 提取和分离鉴定提供了技术和理论支撑。然而,目前尚未获得较高纯度MAAs,并且对此4 种大型红藻中特定MAA 缺乏针对性分离纯化方法。在后续工作中,需要继续开展MAAs 纯化制备研究。
