出芽短梗霉PA—2产除草活性物质的初步分离
2016-07-25程亮

摘要:将出芽短梗霉(Aureobasidium pullulans)PA-2进行液体发酵,发酵液用等体积正丁醇萃取3次,正丁醇萃取液旋转蒸发去溶剂后进行硅胶柱层析,以二氯甲烷和甲醇的混合液进行梯度洗脱,每50 mL收集为1个馏分,共收集到50个馏分。生物测定结果表明,以二氯甲烷和甲醇(体积比20 ∶ 1)洗脱得到的馏分15~23对供试杂草野燕麦表现出了较强的活性,对野燕麦的除草抑制作用均为4级。合并馏分15~23,以二氯甲烷和甲醇(体积比15 ∶ 1)的混合液为展开剂进行薄层层析,生物测定结果表明,Rf值范围在0.19~0.83的活性条带对野燕麦有不同程度的抑制活性。HPLC分析PA1条带发现,该活性条带主要含有2个组分,最大吸收峰在220 nm,其保留时间分别为59.015、65.948 min。
关键词:出芽短梗霉;代谢产物;除草活性;分离纯化;柱层析;薄层层析
中图分类号:S482.4+9文献标志码:A文章编号:1002-1302(2016)06-0199-03
收稿日期:2015-04-27
基金项目:国家自然科学基金(编号:31160371、30860165);国家科技支撑计划(编号:2012BAD19B02)。
作者简介:程亮(1978—),男,河南林州人,硕士,副研究员,主要从事杂草生物防治方面的研究。Tel:(0971) 5313283;E-mail:liangcheng1979@163.com。化学除草剂从应用至今已有70多年的历史,在提高农作物产量方面起到不可低估的作用。但从20世纪70年代中期以来,抗药性杂草种类一直呈上升趋势[1-2]。同时,随着环境保护呼声的日益提高,高毒性农药的大量使用对农业生产及生态环境造成的负面影响已引起世界范围的广泛关注。为了保护人类生存的环境和农业的可持续发展,除草剂的研制与使用将严格受到环境和生态的制约[3]。微生物除草剂因其对目标杂草选择性强、环境负荷小和安全性高等优势而成为近年来杂草生物防治研究中一个较活跃的领域。
近年来,以微生物天然产物开发生物源除草剂或新颖除草剂的先导化合物引起了杂草科学家和农药化家学的极大兴趣。利用微生物天然产物开发除草剂,即将细菌、真菌和放线菌等微生物在发酵过程中所产生的、具有抑制某些杂草生物活性的次级代谢产物,加工成可以直接使用的形态。
农药工业发掘具有除草活性微生物产生的毒素的努力主要集中在非病原土壤微生物和腐生微生物上,而不是植物病原菌。从微生物天然产物分离得到的植物毒素在贮藏、应用、制剂的相容性和半衰期方面都比活体微生物具有优越性,施用分离出来的毒素不会使非靶标植物染病,其药效通常不依赖环境因素,便于预测。毒素在分子大小、化学种类(肽类、萜类、二酮吡嗪、大环内酯、酚类)和寄主专一性(病原菌从完全专一寄生到非专一寄生)上差别很大[4]。
出芽短梗霉(Aureobacidium pullulans)别称出芽茁酶、芽生侧茁酶、黑酵母及短梗霉等,是一类类酵母真菌,具有酵母样和真菌菌丝体2种形态,据其生理特征和孢子产生的特征等将之归属于半知菌门(Deuteromycophyta )丛梗孢目(Moniliates)短梗霉菌属(Aureodacidium)。出芽短梗霉可产生多种代谢产物,如胞外多糖、酶、抗菌素、黑色素及单细胞蛋白等,是一种很有开发价值和应用前景的多功能新型生物制品[5-13]。Prashanthi等从香泽兰花序上分离到出芽短梗霉,该菌株代谢产物能引起香泽兰花序乌霉症状、花蕾早凋谢和抑制种子萌发[14]。李永龙等从杨树叶片上分离纯化的出芽短梗霉PA-2菌株代谢物对一些杂草具有除草活性[15]。
本试验以PA-2菌株为研究对象,利用树脂柱层析、薄层层析及液相色谱等方法对该菌株除草活性组分进行初步分离和纯化,为深入研究除草活性物质的化学结构奠定一定的基础。
1材料与方法
1.1菌株
出芽短梗霉PA-2菌株。
1.2杂草
野燕麦(Avena fatua L.)。
1.3培养基
YPD培养基(10 g酵母提取物、20 g蛋白胨、20 g葡萄糖和1 000 mL水)用于PA-2菌株的液体发酵培养。
1.4试剂
正丁醇(分析纯),天津市百世化工有限公司生产;甲醇(分析纯),天津市北辰方正试剂厂生产;二氯甲烷(分析纯),上海广诺化学科技有限公司生产;柱层析硅胶(300~400目),山东烟台江友硅胶开发有限公司生产;硅胶制备板(20 mm×20 mm),山东烟台江友硅胶开发有限公司生产;甲醇(色谱纯),德国默克公司生产。
1.5仪器设备
旋转蒸发仪N-1100,埃朗科技国际贸易(上海)有限公司生产;真空泵SHZ-DⅢ,郑州长城科工贸有限公司生产;高效液相色谱仪,天津博纳艾杰尔科技有限公司生产。
1.6除草活性物质的分离纯化
将培养好的斜面种子接种于已消毒的发酵培养基中,在28 ℃下振荡培养144 h,得到发酵液30 L。将发酵液于 5 000 r/min 离心20 min,将沉淀部分用10 L 80%丙酮浸泡过夜。冷冻离心去除沉淀,将上清液减压旋转浓缩去除丙酮,然后与发酵液合并。用等体积正丁醇萃取3次,合并正丁醇相浓缩至干,再用甲醇浸取2遍,过滤除去甲醇不溶物,真空浓缩除去甲醇,获得粗品。
粗品经硅胶柱层析分离,以二氯甲烷/甲醇不同的比例作洗脱液,分别为25 ∶ 1(1 500 mL)、15 ∶ 1(800 mL)、3 ∶ 1(500 mL)的流动相进行洗脱,分部收集,根据生物活性跟踪结果,将活性部分浓缩,得到淡黄色固体。用少量甲醇溶解,进行TLC分离制备,展开液配比为二氯甲烷 ∶ 甲醇=15 ∶ 1,记录除草活性物质条带Rf值,将具有除草活性最高的条带刮下,用无水甲醇浸泡过夜,过滤,滤液减压浓缩至10 mL左右,再用制备型HPLC进一步分离纯化(制备柱型号:COSMOSIL 5C18-MS-Ⅱ,20 mm I.D.×250 mm,日本半井公司,流动相为甲醇 ∶ 水=5 ∶ 95,流速16 mL/min,检测波长220 nm)。整个分离纯化过程以除草活性为生物活性跟踪。
1.7生物活性测定
硅胶柱层析分离所得馏分生物活性测定采用种子萌发抑制法:首先,1%次氯酸钠对野燕麦种子消毒3 min,然后用无菌水冲洗3次,室内晾干备用。在直径6 cm的培养皿中放入同皿底大小的双层滤纸,灭菌后备用。在每皿中加入1 mL毒素稀释液(为减少溶剂对种子萌发的影响,取粗毒素处理液 0.5 mL 均匀滴加到滤纸上,待滤纸完全干后再均匀滴加 0.5 mL 灭菌水),在上述处理的培养皿中均匀摆放20粒杂草种子,置于12 h光照/12 h黑暗、25 ℃条件下培养,并以灭菌水作对照,每个处理重复4次,3 d 后检测种子萌发情况。
种子萌发标准以种子发芽长度超过种子长度计,按下列公式计算种子萌发抑制率。
种子萌发抑制率=(对照组种子萌发率-处理组种子萌发率)/对照组种子萌发率×100%。
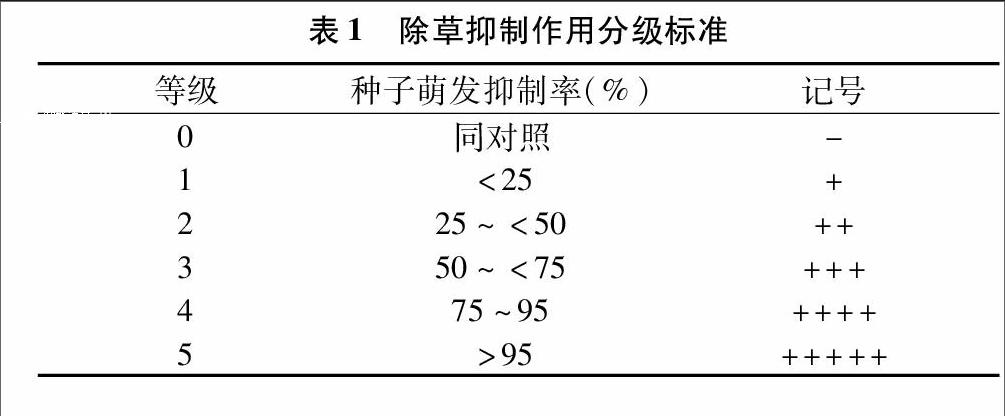
除草抑制作用分级标准如表1所示。
2结果与分析
2.1粗毒素的柱层析和薄层层析
将除草活性物质粗提物进行硅胶柱层析,以二氯甲烷和甲醇(体积比25 ∶ 1、15 ∶ 1、3 ∶ 1)的混合液对其进行梯度洗脱,每50 mL收集为1个馏分,共收集到了104个馏分。将所收集到的馏分分别用甲醇稀释,利用种子萌发抑制法对野燕麦进行除草活性测定,结果表明柱层析后所得到的馏分都对野燕麦表现出不同程度的活性,其中馏分15~23对野燕麦的抑制作用达到了4级,其余馏分活性较弱,如馏分31、馏分32对野燕麦的抑制作用为3级,馏分4、馏分5等对野燕麦的抑制作用为2级,馏分1、馏分2等对野燕麦的抑制作用为1级。
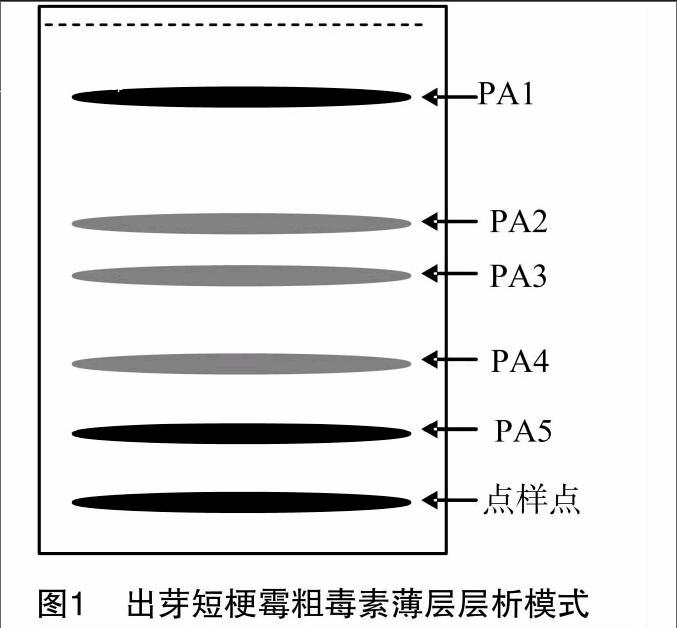
15~23馏分合并浓缩,进行薄板层析(图1),在展开剂二氯甲烷 ∶ 甲醇为20 ∶ 1时,可以分离出大致5个条带,其Rf分别为0.83、0.50、0.40、0.29、0.19,依次标记为 PA1、PA2、PA3、PA4、PA5,分别将其刮下回收,用甲醇溶解,除去硅胶粉,旋转蒸发至干,甲醇定容后,分别取等量的各回收样品对野燕麦进行生物活性测定。
生物测定结果表明,PA-2所分离出的5个条带对野燕麦都具有不同程度的除草活性,PA1条带芽长抑制率为8373%,根长抑制率为93.37%;PA2条带对野燕麦种子芽长抑制率为51.53%,根长抑制率为 74.35%;PA3条带对野燕麦种子芽长抑制率为63.74%,根长抑制率为63.60%;PA4条带对野燕麦种子芽长抑制率为73.39%,根长抑制率为7434%;PA5条带对野燕麦种子的芽长抑制率为64.12%,根长抑制率为75.69%。PA1和PA5在波长为365 nm下吸收,显示紫色色带,PA2、PA3和PA4在波长为254 nm先吸收,显示荧光色带。
2.2HPLC分析
2.2.1检测波长的选择用紫外分光光度计对除草活性强的PA1条带进行紫外波谱区200~900 nm全波长扫描,以确定样品的最大吸收波长,由图2可见,在波长为220 nm处有较大的吸收峰,且无次级吸收,故在以下的HPLC分析时选用220 nm为分析波长。
2.2.2活性组分的 HPLC分析色谱分析条件:COSMOSIL 5C18-MS-Ⅱ(20 mm I.D.×250 mm),流动相为甲醇 ∶ 水为 5 ∶ 95,流速16 mL/min,检测波长220 nm,每次进样量15 μL。将PA-2的PA1条带回收样品通过有机滤膜,取样 15 μL 进行HPLC分析,由图3可见,通过对图谱的分析,可以看出在上述分析条件下该样品可分离出2个较大的峰,其保留时间分别为59.015 min和65.948 min,可以看出保留时间是59015 min 的组分(标记为A 峰)峰形较好,有点拖尾,后面有个保留时间为65.948 min的小峰(标记为B峰)。分别将2个组分进行收集制备,利用种子萌发抑制法测定其对野燕麦的活性(图4为2个组分处理3 d的症状),可见2个组分峰都表现出了不同程度的除草活性,A峰对野燕麦种子的芽长抑制率为64.81%,根长抑制率为75.00%;B峰对野燕麦种子的芽长抑制率为62.96%,根长抑制率为52.34%。
3讨论与结论
由于利用微生物代谢产物进行除草剂开发的研究从本质上是利用化合物的生物活性,类同于化学合成除草剂,所以更受到化学家们的重视。而深入研究微生物代谢产物,以期从中找到天然源的环保型化学除草剂之先导化合物,是天然产物利用研究的一个热门领域。
已往研究曾采用薄层层析分离天然除草活性物质[16]。但该法上样量小,分离组分用于生测后难以有足够的量进行第2次分离。选用硅胶作固定相,二氯甲烷和甲醇混合溶剂作洗脱剂,对除草活性物质进行柱层析,取得了较好的分离效果。显然本试验采用柱层析方法对出芽短梗霉除草活性物质进行粗分是可行的。使用柱层析分离,上样量大,能保证获得足够多的除草活性物质进行再分离纯化以及生测和结构鉴定。
生物活性跟踪贯穿于整个提取过程中是必须的。根据除草活性物质分离流程的不同与要求,采用的生测方法也多种多样。本研究通过摸索,过柱子后获得的馏分确定了用培养皿滤纸法来进行活性跟踪。随后进行薄层层析板生物活性测定,确定薄层板上的除草活性条带区域,达到进一步去除杂质的目的。同时研究还发现,有些除草活性组分中的物质在254、365 nm紫外光下几乎无吸收或者吸收很弱,但在别的波长下却有最大吸收。因此,用薄层层析分离除草活性物质时不应只刮取在254、365 nm下有荧光带的部分生测,还应刮取荧光带之间无荧光的部分进行生测,以防某些无荧光的活性物质在分离过程中损失。采用柱层析分离,因为收集洗脱液是连续的,有助于发现一些在紫外光下无吸收的次生代谢产物。但柱层析缺点是不直观,将薄层层析和柱层析相结合有助于解决这一问题。最后HPLC分析制备获得的除草活性组分的量较少,故采用容器直径较小的瓶盖进行生物活性测定。
本试验利用薄层层析的方法,得到了5个条带,并分别测定了其对野燕麦的除草活性,对5条带回收样品都进行了HPLC分析,但除PA1条带外,其他样品的色谱图分离效果不太理想,文中未列出。笔者认为5个条带的组分差别较大,其物化性质也必存在诸多差异,故在同一条件下进行HPLC分析时,其分离度难免会受到影响,同时,PA1的HPLC结果显示,A峰和B峰2个保留时间分别为59.015 min和 65.948 min,这2个峰还是没有完全分开,可能是难分离物质,要求在今后分离工作中不断选择和试验分离效果较好的洗脱剂或展开剂,选择适宜的洗脱方法对除草活性物质进行分离。为了达到较好的分离目的,特别到了分离后期,不仅可以改变流动相,也可以改变固定相。所以对其分离条件的进一步探索仍需进行,此部分试验也正在进行中。
参考文献:
[1]邱芳心,杜桂萍,刘开林,等. 杂草抗药性及其治理策略研究进展[J]. 杂草科学,2015,33(2):1-6.
[2]杨浩娜,柏连阳. 抗草甘膦杂草检测方法的研究进展[J]. 杂草科学,2014,32(3):30-33.
[3]姚克兵,王飞兵,庄义庆,等. 植物源除草剂Pure对非耕地杂草的防除效果[J]. 杂草科学,2015,33(3):49-51.
[4]王晓艳. 生防菌株SF-193对空心莲子草的防除作用及应用潜力研究[D]. 扬州:扬州大学,2007.
[5]卢辉官. 出芽短梗霉的胞外多糖在氮源作用下的积累及其应用[D]. 扬州:扬州大学,2010.
[6]崔玉海. 出芽短梗霉G-58的发酵条件及动力学研究[D]. 无锡:江南大学,2008.
[7]Ma C,Ni X,Chi Z,et al. Purification and characterization of an alkaline protease from the Marine yeast Aureobasidium pullulans for bioactive peptide production from different sources[J]. Marine Biotechnology,2007,9(3):343-351.
[8]Mari M,Martini C,Spadoni A,et al. Biocontrol of apple postharvest decay by Aureobasidium pullulans[J]. Postharvest Biology and Technology,2012,73:56-62.
[9]Choudhury A R,Bhattacharyya M S,Prasad G S. Application of response surface methodology to understand the interaction of media components during pullulan production by Aureobasidium pullulans RBF-4A3[J]. Biocatalysis and Agricultural Biotechnology,2012,1(3):232-237.
[10]Zou X,Zhou Y,Yang S T. Production of polymalic acid and malic acid by Aureobasidium pullulans fermentation and acid hydrolysis[J]. Biotechnology and Bioengineering,2013,110(8):2105-2113.
[11]Boti c' T,Kralj-Kun cˇi cˇ M,Sep cˇi c' K,et al. Biological activities of organic extracts of four Aureobasidium pullulans varieties isolated from extreme marine and terrestrial habitats[J]. Natural Product Research,2014,28(12):874-882.
[12]Janisiewicz W J,Jurick W M,Peter K A,et al. Yeasts associated with plums and their potential for controlling brown rot after harvest[J]. Yeast,2014,31(6):207-218.
[13]徐磊. 短梗霉黑色素的分离提取及其结构分析[D]. 大连:大连理工大学,2006.
[14]Prashanthi S K,Kulkarni S. Aureobasidium pullulans,a potential mycoherbicide for biocontrol of eupatorium [Chromolaena odorata (L.) King and Robinson] weed [J]. Current science,2005,88(1):18-21.
[15]李永龙,程亮,朱海霞,等. 出芽短梗霉菌菌株PA-2的除草活性及对作物的安全性[J]. 中国生物防治学报,2014,30(2):232-238.
[16]李铭刚,Groth I,李一青,等. 薄层层析指导下的嗜碱放线菌菌株YIMGQ-14次生代谢产物研究[J]. 微生物学报,2003,43(4):481-486.
