南瓜皮多糖锌的制备及生物利用率研究
2022-09-13董淑君张禧庆刘旭龙马越郑振佳姜高飞
董淑君,张禧庆,刘旭龙,马越 ,郑振佳,姜高飞
(1.北京市农林科学院农产品加工与食品营养研究所,果蔬农产品保鲜与加工北京市重点实验室,农业农村部蔬菜采后处理重点实验室,北京 100097;2.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;3.山东杰诺检测服务有限公司,山东烟台 265200;4.莱阳孟宇食品有限公司,山东烟台 265200)
多糖是南瓜中的重要活性物质,含量约为5.7%,具有抗氧化、降血糖、降血脂、抑菌、抗肿瘤等多种生物活性。南瓜皮是南瓜加工过程中的副产品,加工过程中产生量约占南瓜总质量的10%~40%,通常当作废弃物处理。从南瓜皮中提取南瓜皮多糖可以提高南瓜资源的综合利用,增加南瓜的附加值。南瓜皮多糖属于酸性多糖,糖链中含有羧基、羟基等配位基团,具有表面螯合能力,能与金属离子以配位键结合生成螯合物。目前对南瓜多糖的研究主要集中在提取、结构解析、改性修饰以及活性评价,其中改性修饰主要包括南瓜多糖的硫酸酯化、磷酸酯化和硒化修饰。
锌是人体必需的微量元素之一,能够提高机体免疫力,具有促进生长发育、杀菌抗炎、抗氧化、提高大脑功能、参与酶调节和基因表达等多种生理功能。人体对锌的储存能力不高,需要从外界获取以稳定体内环境。无机锌在人体中的吸收利用率低且对肠胃具有刺激作用,因此开发高利用率、低刺激性的新型锌补充剂尤为重要。将多糖与锌进行螯合得到多糖锌,可解决无机锌与食物中的植酸、草酸等化合物结合生成沉淀的问题,且利用率高、稳定性好,具有肠道益生作用,在摄入益生元的同时实现补锌目的。现报道的多糖锌研究主要集中在工艺优化及其活性评价,涉及的多糖来源主要包括大米胚芽、金针菇、孔石莼、灰树花、光帽鳞伞菌丝体、肉苁蓉、猪苓和蛹虫草基质,对南瓜皮多糖与锌的螯合工艺及生物利用率研究尚未见报道。
本研究以南瓜皮为原料提取多糖,利用金属螯合法制备南瓜皮多糖锌,采用响应面法优化制备工艺,并研究产物的生物利用率,开发具有肠道益生作用的新型补锌剂,减少南瓜资源的浪费,提高南瓜皮的附加值。
1 材料与方法
1.1 材料与仪器
南瓜皮 品种为爱碧斯,山东省莱阳市孟宇食品有限公司;七水合硫酸锌 分析纯,天津市凯通化学试剂有限公司;锌标准储备液(1000 μg/mL)国家检验认证有限公司;盐酸(优级纯)、氢氧化钠(分析纯)天津市科密欧化学试剂有限公司;硝酸 优级纯,苏州晶瑞化学股份有限公司;人工胃液、人工肠液 福州飞净生物科技有限公司;透析袋 怡康科贸生物试剂耗材实验有限公司。
7800 电感耦合等离子体质谱仪(ICP-MS)美国安捷伦科技公司;SECURA224-ICN 电子天平北京赛多利斯仪器有限公司;S210 pH 计 梅特勒-托利多仪器有限公司;Multiwave PRO 微波消解仪奥利地安东帕公司;DKZ-2B 水浴恒温振荡器 上海一恒科技仪器有限公司;FD-304 冷冻干燥机 济南骏德仪器有限公司。
1.2 实验方法
1.2.1 南瓜皮多糖的提取 采用热水浸提法从南瓜皮中提取多糖。取1 kg 鲜南瓜皮切碎,以1:12 的料液比加入去离子水,85 ℃的热水浸提两次,过滤,滤液浓缩后用4 倍体积的无水乙醇醇沉,静置,5000 r/min 离心10 min 得南瓜皮粗多糖。Sevag 溶液(氯仿:正丁醇=4:1)脱蛋白,重复操作3~4 次至中间无变形蛋白层,浓缩后醇沉,5000 r/min 离心10 min,冻干得到南瓜皮多糖。苯酚-硫酸法测定多糖含量为74.78%。
1.2.2 南瓜皮多糖锌的制备工艺 采用硫酸锌法制备多糖锌。称取一定质量的南瓜皮多糖溶于去离子水中,与一定浓度的锌溶液等体积混合,设计不同的反应质量比、反应时间、反应温度和反应pH 后于恒温水浴振荡反应,反应结束用4 倍体积的无水乙醇进行醇沉,5000 r/min 离心10 min,上清液保存备用,将沉淀复溶后用500 Da 的透析袋透析48 h,冷冻干燥得到南瓜皮多糖锌。
1.2.3 单因素实验
1.2.3.1 南瓜皮多糖与锌质量比对螯合率的影响固定锌的浓度为0.4 g/L,南瓜皮多糖与锌质量比分别为1:1、5:1、10:1、20:1、30:1、40:1,反应时间为100 min,反应温度为50 ℃,反应pH7,按“1.2.2”进行操作,考察多糖与锌的质量比对螯合率的影响。
1.2.3.2 反应时间对螯合率的影响 固定锌的浓度为0.4 g/L,南瓜皮多糖与锌质量比为5:1,反应pH7,反应温度为50 ℃,反应时间分别为50、100、150、200、250 min,按“1.2.2”进行操作,考察反应时间对螯合率的影响。
1.2.3.3 反应温度对螯合率的影响 固定锌的浓度为0.4 g/L,南瓜皮多糖与锌质量比为5:1,反应时间为100 min,反应pH7,反应温度分别为30、40、50、60、70 ℃,按“1.2.2”进行操作,考察反应温度对螯合率的影响。
1.2.3.4 反应pH 对螯合率的影响 固定锌的浓度为0.4 g/L,南瓜皮多糖与锌质量比为5:1,反应温度为50 ℃,反应时间为100 min,反应pH 分别为5、6、7、8、9、10、11,按“1.2.2”进行操作,考察反应pH 对螯合率的影响。
1.2.4 响应面试验 在单因素实验的基础上,以南瓜皮多糖螯合锌的螯合率为响应值,以南瓜皮多糖与锌质量比、反应时间、反应pH 为自变量,进行三因素三水平响应面试验。采用Design-Expert 8.0.6 统计分析软件建立Box-Behnken 模型,对螯合反应进行响应面优化设计。响应面试验设计因素与水平见表1。
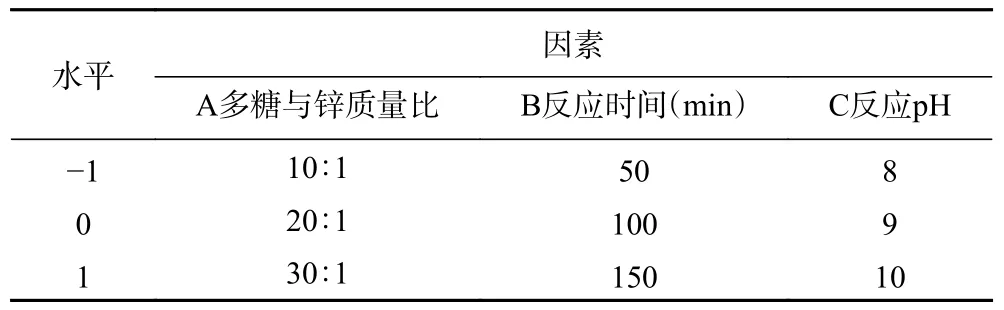
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiment
1.2.5 南瓜皮多糖锌中锌元素的测定
1.2.5.1 锌标曲的绘制 利用锌标准溶液配制成浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0 μg/mL 的锌溶液。电感耦合等离子体质谱仪(ICP-MS)测定,以锌元素的浓度(X,μg/mL)为横坐标,响应信号值(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=0.989X+0.0072,R=0.9998。
ICP-MS 相关参数如下:射频功率1550 W,等离子体气体流速15 L/min,辅助气体流速0.9 L/min,蠕动泵转速0.1 rps,雾化室温度2 ℃,采样深度8 mm。
1.2.5.2 螯合率的计算 采用2%的硝酸稀释上清液,ICP-MS 测定锌离子的含量,按照下式计算南瓜皮多糖锌的螯合率:
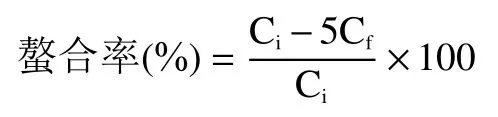
式中:C表示混合液中锌离子的初始浓度,μg/mL;C表示反应后上清液中锌离子的浓度,μg/mL。
1.2.5.3 锌含量的测定 称取南瓜皮多糖锌0.02 g,按照表2 设定的升温程序消解样品,消解后冷却至室温将样品转移至50 mL 容量瓶,去离子水定容,保存备用,ICP-MS 测定锌含量。

表2 微波消解升温程序Table 2 Temperature rise procedure of microwave digestion
1.2.6 南瓜皮多糖锌的生物利用率 参照文献[32−34]方法并稍作修改,通过体外模拟胃肠道消化法对螯合物南瓜皮多糖锌的生物利用率进行评价。
1.2.6.1 模拟胃液消化 分别配制5 mg/mL 的南瓜皮多糖锌和8.9 mg/mL 七水合硫酸锌溶液,添加1 mol/L 的HCl 使pH 达到2.0 左右,加入等体积的模拟人工胃液,混合均匀,37 ℃振荡,分别反应0、30、60、90、120、150、180、210、240 min 后,在95 ℃水浴中灭酶处理10 min,于4 ℃条件下保存,备用。
1.2.6.2 模拟肠液消化 分别将“1.2.6.1”中模拟胃消化120 min 的样品混合物和无机锌混合物取出,用1 mol/L 的NaOH 调节pH 至7.0,加入等体积的模拟人工肠液,混合均匀,将混合物转移到透析袋中,37 ℃振荡,分别反应1、2、4、6、8 h 后,在95 ℃水浴中灭酶处理10 min,于4 ℃条件下保存,备用。
1.2.6.3 溶解率的测定 分别取胃液、肠液的消化液来测定南瓜皮多糖锌的溶解率。在“1.2.6.1”和“1.2.6.2”的消化液中加入4 倍体积的无水乙醇进行醇沉,5000 r/min 离心10 min 后取上清液,ICPMS 测定锌含量,按照下式计算溶解率:

式中:C表示反应后上清液中锌离子的浓度,μg/mL;F 表示样品中锌的含量,μg/mL。
1.2.6.4 透析率的测定 在肠液消化的过程中,按照1、2、4、6、8 h 时间段依次取样,ICP-MS 测定,按照下式计算锌离子的透析率:

式中:E 表示透析液中锌的浓度,μg/mL;V 表示透析液的体积,mL;F 表示样品中锌的含量,μg/g;M 表示样品的质量,g。
1.3 数据处理
每组试验均重复3 次,利用Design Expert 8.0.6进行数据统计分析;采用Origin 2017 软件绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 南瓜皮多糖与锌质量比对螯合能力的影响由图1 可知,随着多糖与锌质量比的增加,螯合能力不断上升。当质量比超过20:1 后,螯合率的增势趋于平缓,可达到98%左右,原因可能是随多糖比例的增加,为Zn提供了足够的结合位点,螯合率逐渐上升。随着多糖浓度的提高,体系粘度增加,不利于结合位点的暴露,螯合率下降。

图1 质量比对螯合率的影响(n=3)Fig.1 Effect of the mass ratio on the chelation rate (n=3)
2.1.2 反应时间对螯合能力的影响 由图2 可知,随着反应时间的增加,螯合率逐渐增加,当反应时间为100 min 时达到最大值79.28%,之后螯合率迅速下降。这可能是因为随着反应时间的延长,体系稳定性下降,导致部分螯合物出现了解离的现象。
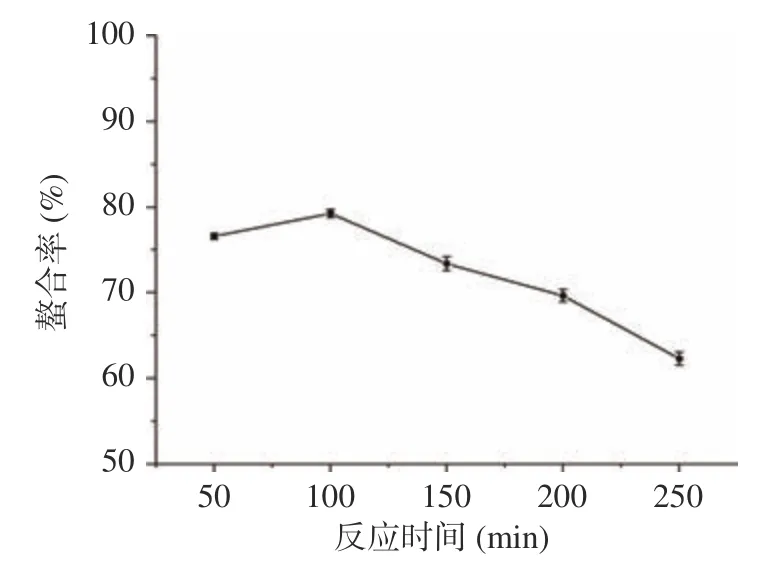
图2 反应时间对螯合率的影响(n=3)Fig.2 Effect of the reaction time on the chelation rate (n=3)
2.1.3 反应温度对螯合能力的影响 由图3 可知,反应温度对螯合率的影响较小。随着温度的升高,螯合率逐渐上升,当反应温度为60 ℃时,螯合率达到最大值79%。当反应温度超过60 ℃以后螯合率开始下降。推测因为温度的升高会促进分子的运动,虽然有利于结合位点的暴露,但是温度过高时,解离速度高于螯合速度,不利于多糖与Zn的螯合。结果显示,温度对螯合率的影响较小,因此可作为次要考虑因素,不作为响应面优化参数。

图3 反应温度对螯合率的影响(n=3)Fig.3 Effect of the reaction temperature on the chelation rate (n=3)
2.1.4 反应pH 对螯合能力的影响 由图4 可知,随着pH 的增加,螯合率不断上升。当pH 为9 时达到最大值99.4%,之后螯合率开始下降。推测因在偏酸性条件下,Zn与多糖解析速度高于螯合速度;随着pH 的增加,螯合率提高;pH 超过11 后反应体系有略浑浊现象,可能因为部分Zn会和OH生成沉淀,导致Zn损失。
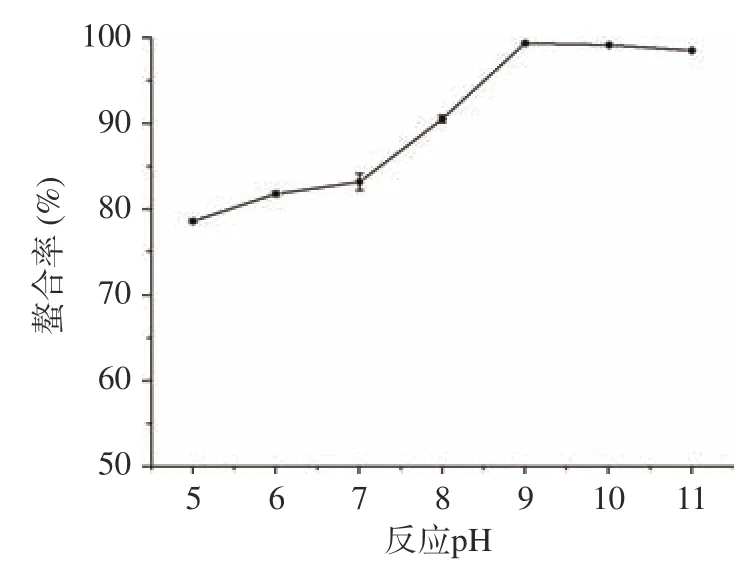
图4 反应pH 对螯合率的影响(n=3)Fig.4 Effect of the reaction pH on the chelation rate (n=3)
2.2 响应面试验结果
2.2.1 响应模型的建立与分析 采用Design Expert 8.0.6 软件对数据进行回归分析,得到螯合率(Y)对南瓜皮多糖与锌质量比(A)、反应时间(B)和反应pH(C)的三元二次回归方程为Y=99.49−0.46A+0.13B+0.18C+0.078AB−0.2AC+0.19BC−1.31A−0.77B−1.39C。响应面试验结果见表3,方差分析结果见表4。
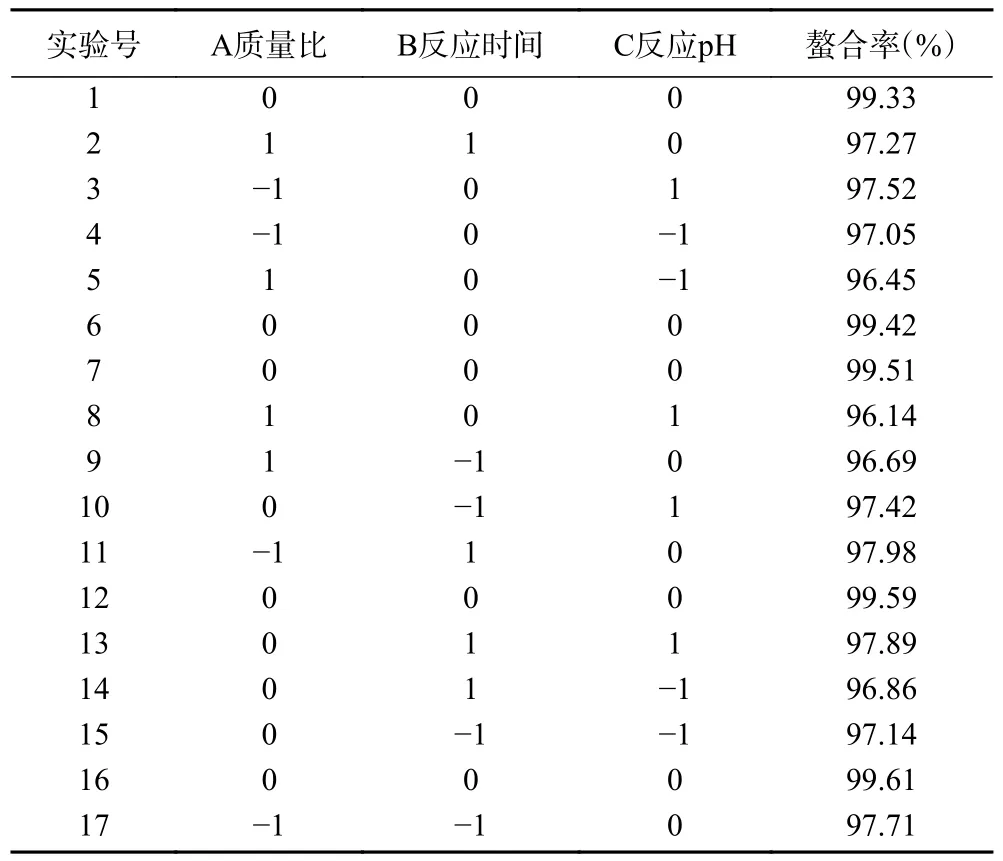
表3 响应面试验结果Table 3 Response surface test results
由表4 可知,该模型差异性显著(<0.0001),失拟项不显著(>0.05),说明此模型的拟合度较好;决定系数为0.9875,说明螯合率的试验值和模拟回归值具有很好的一致性;校正后决定系数为0.9713,说明该回归方程可信度较高,能够反应97.13%的响应值变化。因此该模型的可信度和拟合度均较高,可以利用该模型对南瓜皮多糖锌的螯合能力进行预测和分析。

表4 回归模型方差分析Table 4 Analysis of variance of regression model
回归模拟一次项A,二次项A、B、C对螯合作用影响显著(<0.0001),一次项C 对螯合作用影响显著(<0.05),一次项B,交互项AB、AC 和BC对螯合率的影响不显著,可将其从回归模型中删除。最终确定回归模型为Y=99.49−0.46A+0.18C−1.31A−0.77B−1.39C。因此,各因素对响应面的影响并不是简单的线性关系,值可以反映出各个因素对螯合率的影响程度。本试验中螯合率的影响因素排序为多糖与锌质量比>反应pH>反应时间。
2.2.2 响应面图分析 响应曲面图可以形象地描述各因素之间的交互作用,各因素交互作用对螯合率的影响见图5。图5A 为固定反应pH 的编码水平为零,考察南瓜皮多糖与锌质量比和反应时间的交互作用对螯合率的影响。此条件下,等高线形状呈圆形,等高线稀疏,说明反应质量比和反应时间的交互作用对螯合率的影响较弱。当反应质量比达到最优时,随着反应时间的增加,螯合率趋于稳定。当反应时间达到最优时,螯合率随着反应质量比的增加呈现出先上升后下降的趋势,说明反应质量比对螯合率的影响大于反应时间。图5B 为固定反应时间的编码水平为零,考察南瓜皮多糖与锌质量比和反应pH 的交互作用对螯合率的影响。对应的等高线形状呈椭圆形,三维图倾斜面大,说明两者的交互作用对螯合率影响较大。随着反应质量比和反应pH 的增加,螯合率逐渐上升,当反应质量比超过20:1,反应pH 超过9 后,螯合率开始下降。图5C 为固定南瓜皮多糖与锌质量比的编码水平为零,考察反应时间和反应pH 交互作用对螯合率的影响。等高线形状呈椭圆形,说明两者的交互作用对螯合率影响较大。当反应pH 达到最优时,随着反应时间的增加,螯合率趋于稳定。当反应时间达到最优时,螯合率随着反应pH 的增加呈现出先上升后下降的趋势,说明反应pH 对螯合率的影响大于反应时间。
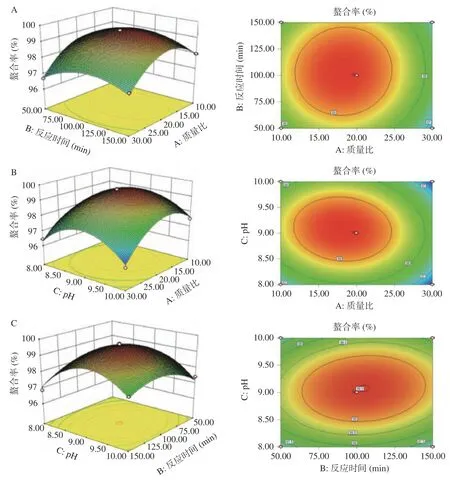
图5 各因素交互作用对南瓜皮多糖锌螯合能力影响的响应面图Fig.5 Response surface diagram of the effects of each factor interaction on polysaccharide zinc chelation ability in pumpkin skin
2.2.3 回归模型验证 结合Design Expert 8.0.6 软件分析可得最佳的螯合条件为:南瓜皮多糖与锌质量比为18.19:1,反应时间为104.29 min,反应pH 为9.09 时,螯合率达到最大值为99.55%。为考虑实际生产需要,选择以下条件进行验证:南瓜皮多糖与锌质量比为18:1,反应时间为104 min,反应pH 为9,在此条件下实际得到的南瓜皮多糖锌螯合率为99.37%±0.12%,与预测值相差较小为0.18%,说明该工艺稳定可靠,可用于生产,ICP-MS 测定南瓜皮多糖锌中锌含量约为23.17±0.05 mg/g。
2.3 生物利用率分析
2.3.1 南瓜皮多糖锌在胃中的释放情况 多糖锌的溶解率随时间的增加呈现出上升趋势,溶解率最高为12.76%,无机锌在胃中的溶解率比较稳定,结果见图6。在消化初期(0~60 min),无机锌中锌离子的溶解率为48.4%,多糖锌中锌离子的溶解率为9.22%,在消化中后期,无机锌的溶解率为50.52%远高于多糖锌的溶解率12.76%,说明多糖锌对Zn释放效果平缓,刺激性可能小于无机锌。这与阚文翰对螯合锌在胃中Zn的溶解率结论相似,说明多糖锌受胃液的酸化环境影响不大。整个消化过程中,无机锌的溶解率维持在50%左右,推测可能是因为无机锌与胃中的蛋白类物质结合,部分锌以结合态存在,导致游离锌离子浓度下降。
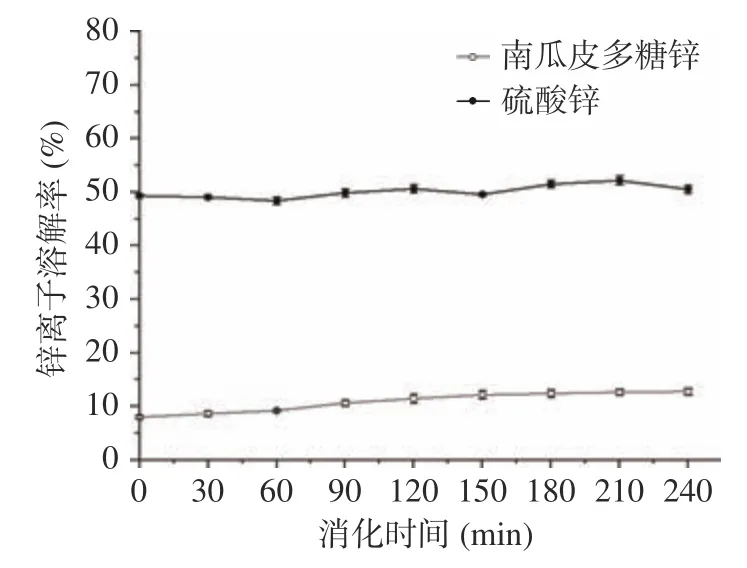
图6 体外模拟胃肠道消化中锌离子溶解率的比较Fig.6 Comparison of zinc release rate in simulated gastrointestinal digestion in vitro
2.3.2 南瓜皮多糖锌在肠中的释放情况 多糖锌在肠中溶解率比较稳定,维持在2%左右,无机锌在肠中的溶解率随着时间的延长呈现出降低的趋势,结果见图7。在消化后期,南瓜皮多糖锌和无机锌的溶解率分别为2.18%和0.13%。肠液环境中无机锌的溶解率明显降低,推测可能是肠道的弱碱性环境使释放出的Zn易生成沉淀,导致两者的溶解率下降,多糖锌中由于具有多糖的保护作用,使其在肠道中的溶解率高于无机锌。这与柯枭等研究的螯合锌在肠道中Zn的溶解率结论相似。

图7 体外模拟肠道消化中锌离子溶解率的比较Fig.7 Comparison of zinc release rate in simulated intestinal digestion in vitro
2.3.3 南瓜皮多糖锌的透析率 多糖锌和无机锌在胃中的透析率均随着时间的增加而增加,8 h 后南瓜皮多糖锌及无机锌的透析率分别为16.59%和0.56%,无机锌的透析率趋于稳定,南瓜皮多糖锌的透析率增幅较大,结果见图8。推测可能是因为锌的主要吸收部位在肠道,在弱碱性的环境下,释放出的Zn容易生成Zn(OH)或者其它沉淀,无法透过透析袋;多糖环境对锌具有一定保护作用,不容易生成沉淀,因此多糖锌的生物利用率高于无机锌。综上表明,与无机锌相比,南瓜皮多糖锌的生物利用率和稳定性更高。
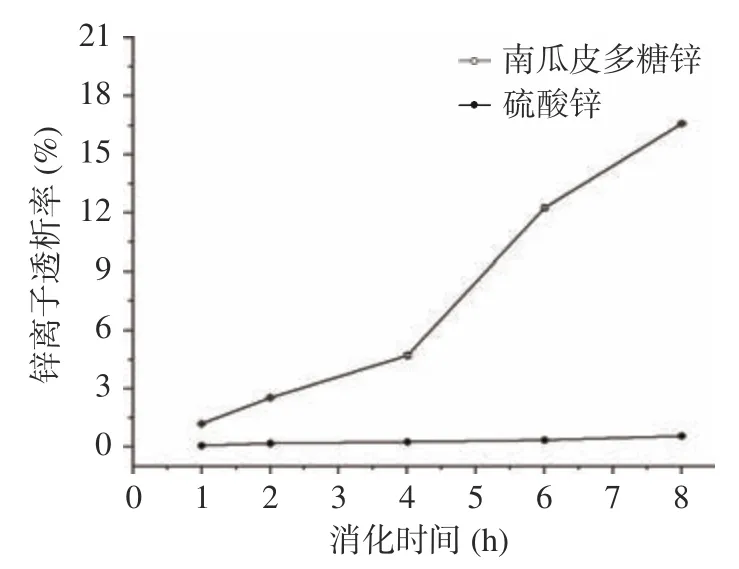
图8 体外模拟肠道消化中锌离子透析率的比较Fig.8 Comparison of zinc ion dialysis rate in simulated intestinal digestion in vitro
3 结论
在南瓜皮多糖锌的制备过程中,各因素对螯合率的影响大小为:反应质量比>反应pH>反应时间。通过响应面法优化后得到最佳制备工艺为:南瓜皮多糖与锌质量比18:1,反应时间104 min,反应pH9,此时螯合率能达到99.37%±0.12%,在此条件下制备的南瓜皮多糖锌的锌含量约为23.17±0.05 mg/g。体外消化模拟试验表明:南瓜皮多糖锌受胃的酸化环境影响较小,在胃中的溶解率较低,但在肠道中的溶解率和透析率均明显高于无机锌,可以证明多糖锌具有较好的生物利用率和稳定性。本研究为开发兼具补锌和肠道益生作用的新型补锌剂提供了理论依据。
