SAH后迟发性脑血管痉挛伴发脑梗死患者预后情况及危险因素分析
2022-09-09张永亮高鲁杨金亮王少华
张永亮,高鲁,杨金亮,王少华
(1.安徽医科大学附属阜阳医院神经外科,安徽 阜阳 236000;2.安徽医科大学第一附属医院神经外科,安徽 合肥 230000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是由脑底部或表面血管破裂,血液流入脑表面软膜与蛛网膜之间的腔隙引发的一种综合性疾病,>85%的病因来源于脑动脉瘤破裂[1]。迟发性脑血管痉挛(delay cerebral vasospasm,DCVS)是SAH发生后常见的严重并发症之一。研究[2]指出,行CTA或MRA检查可发现有超过半数以上患者存在DCVS,SAH后DCVS可造成严重脑组织损伤,引起迟发性脑缺血缺氧等神经功能障碍,并被指出或可成为SAH后迟发性脑梗死的预测指标。SAH后脑梗死指动脉瘤术后新发病灶,是造成SAH患者致残或致死的严重后遗症之一。有临床血管造影结果显示,>69%SAH后DCVS患者均发生脑梗死,而发生严重残疾甚至短期内死亡超过半数以上[3]。此前对SAH后DCVS患者伴发脑梗死研究尚不多见。本研究通过回顾性分析72例SAH后DCVS患者的资料及预后,旨在探究影响其发生脑梗死的危险因素。
1 资料与方法
1.1 一般资料
选取2017年9月至2021年8月安徽医科大学附属阜阳医院收治的72例SAH并发DCVS的患者为研究对象,根据治疗后头颅CTA或MRA是否伴发迟发性脑梗死(DCI)分为梗死组(n=25)及非梗死组(n=47)。纳入标准:(1)经CT或DSA检查符合脑动脉瘤破裂造成的SAH患者;(2)经DSA检查确定且患者符合美国心脏协会/美国卒中协会发布的《动脉瘤性蛛网膜下腔出血处理指南》中关于迟发性脑血管痉挛的相关诊断标准[4],颅内动脉的持续性收缩,并出现神经功能缺损的症状;(3)于动脉瘤夹闭术后48~72 h或症状加重时复查头颅CTA,出现脑血管直径较术前明显缩小且长时间持续并发痉挛,判定为迟发性脑血管痉挛患者;(4)患者及家属均知情并同意。排除标准:(1)颅外伤、出血性或缺血性脑梗死、脑血管畸形、凝血异常所致的SAH患者;(2)合并严重心、肺、肝肾等重要器官功能障碍患者;(3)临床资料不全或依从性差患者。本研究获得医院伦理委员会批准。
1.2 方法
1.2.1 治疗方法 所有入组患者均参考《脑血管痉挛防治神经外科专家共识》[5]及《重症动脉瘤性蛛网膜下腔出血管理专家共识(2015)》[6]中的相关诊疗方案,本纳入患者均采取颅内动脉瘤介入栓塞治疗,术中结合血管多普勒检查,确定载瘤动脉及动脉夹闭情况。根据患者动脉瘤位置不同选择相应入路位置:前、后交通、大脑前、中动脉采用翼点入路;后循环枕下正中或旁正中入路。动脉瘤夹闭参照瘤方位及与颈及动脉关系而定,常规消毒铺巾及确定入路位置后,依次分离/去除皮瓣、骨瓣,打开硬膜,显微镜辅助夹闭术。术中注意保护血管及神经,术后注意抗感染治疗,持续监测患者生命体征及神经功能变化。
1.2.2 临床评分标准 (1)改良Fisher分级:0级为未见出血或仅脑室内或脑实质出血;I级为仅见基地池出血;II级为仅见周边脑池或侧裂池出血;III级为广泛蛛网膜下腔出血伴脑实质内血肿;IV级为基地池和周边脑池、侧裂池较厚积血。(2)Hunt-Hess分级:0级为未破裂动脉瘤;I级为无症状或轻微头痛及轻度颈部强直;II级为中~重度头痛、颈部强直,除有颅神经麻痹外,无其他神经功能缺失;III级为倦睡,意识模糊或轻微的灶性神经功能缺失;IV级为木僵,中/重度偏侧不全麻痹,可能有早期的去脑强直及植物神经功能障碍;V级为深昏迷,去大脑强直,濒死状态(若患者伴有严重全身疾病,如高血压、糖尿病、慢性肺疾病及伴有严重血管痉挛,则评级要增加1级)。(3)mRS评分:0分为完全无症状;1分为有症状,但无明显功能障碍,可完成日常职责及活动;2分为轻度残疾,不能完成病前所有活动,但不需要帮助可自理;3分为中度残疾,需要部分帮助,但可自行行走;4分为重度残疾,不能独立行走,无其他人帮助不能满足自身需要;5分为严重残疾,卧床、失禁及需要持续关注及护理;6分为死亡。
1.3 观察指标
(1)患者一般资料:包括年龄、性别、身高、体重、BMI、基础病及既往病史、用药史等;(2)术前动脉瘤类型、出血次数、改良Fisher分级、Hunt-Hess分级;(3)行动脉瘤夹闭手术时间窗(从发病至手术治疗前时间)、术后血常规、肝功能、血凝;(4)数字减影血管造影定义DCVS程度及超声造影大脑中动脉的血流速度等相关指标及预后行改良Rankin量表(mRS)的评分。
1.4 统计学分析

2 结果
2.1 两组患者预后情况比较
SAH后DCVS患者发生DCI占34.72%(25例),严重致残患者(4分≤mRS评分<6)占29.17%(21例),死亡患者占4.17%(3例);其中梗死组mRS评分(3.52±1.53)与非组mRS评分(1.28±2.00)比较,差异有统计学意义(t=4.90,P<0.001);梗死组mRS<4分患者占44.00%(11例),4分≤mRS评分<6患者占52.00%(13例),死亡率4.00%(1例);非梗死组mRS<4分患者占78.72%(37例),4分≤mRS评分<6患者占17.02%(8例),死亡率4.26%(2例),两组差异有统计学意义(P<0.05)。见图1。

2.2 两组患者一般资料比较
两组患者在高血压、Fisher(以II级上下为分组)分级、Hunt-Hess(以II级上下为分组)分级、手术时间窗、白细胞计数、红细胞宽度(SD)、凝血酶原时间、纤维蛋白原、DCVS程度及中动脉血流量方面比较,差异有统计学意义(P<0.05);其余一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
2.3 影响患者伴发脑梗死的单因素Logistic回归分析
单因素Logistic回归分析显示,高血压、Hunt-Hess分级、改良Fisher分级、mRS评分、手术时间窗、出血次数、白细胞计数、红细胞分布宽度SD、凝血酶原时间、纤维蛋白原、DCVS程度及中动脉血流量均是SAH后DCVS患者发生DCI的危险因素(P<0.05)。见表2。
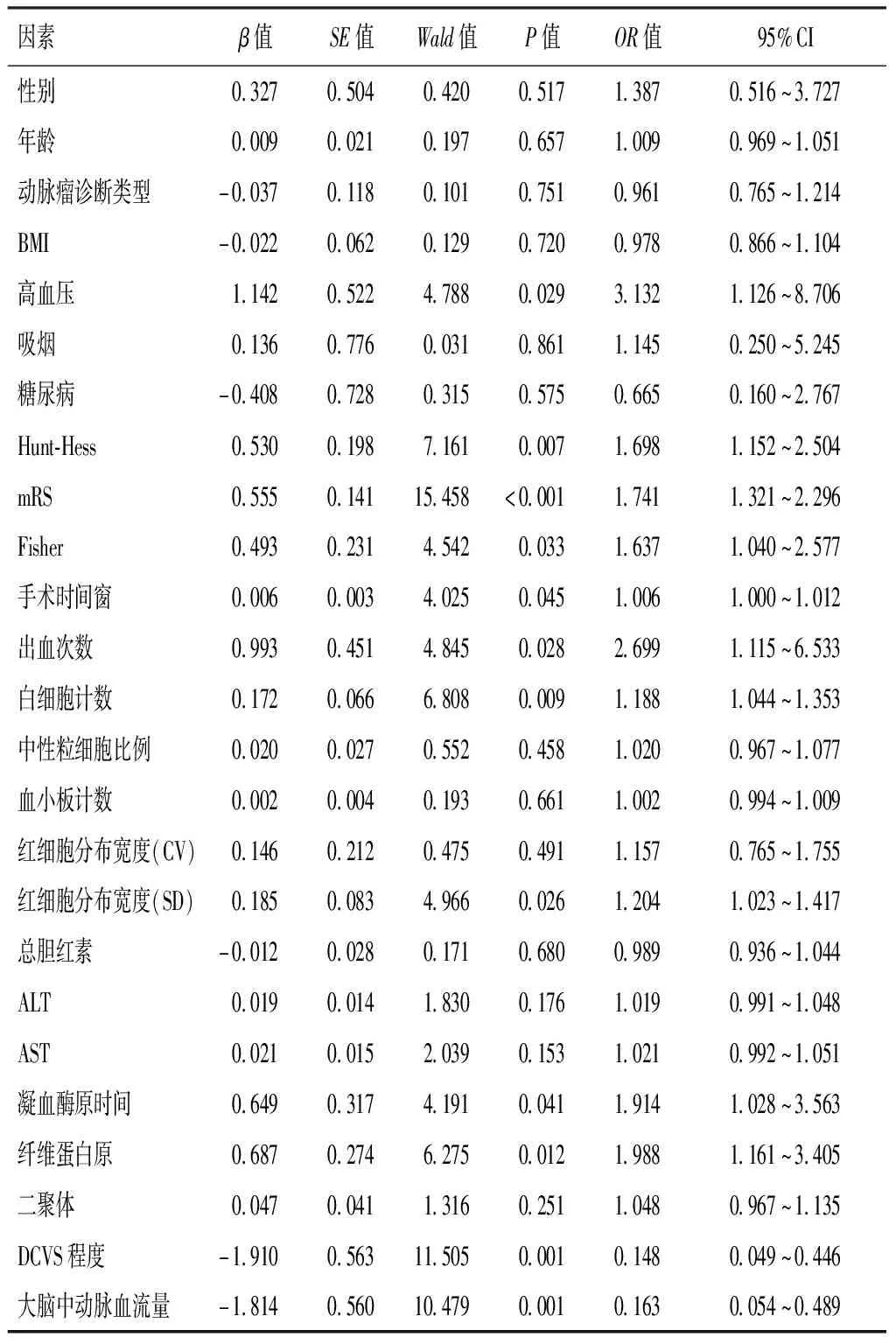
表2 影响患者伴发脑梗死的单因素Logistic回归分析
2.4 影响患者伴发脑梗死的多因素Logistic回归分析
将上述P<0.20指标均纳入多因素Logistic回归分析,结果发现,Hunt-Hess分级、改良Fisher分级、mRS评分、手术时间窗、纤维蛋白原及DCVS程度均是SAH后DCVS患者发生DCI的独立危险因素(Hunt-Hess分级:OR=10.834,95%CI:1.190~98.605;改良Fisher分级:OR=9.251,95%CI:1.373~62.313;mRS评分:OR=4.465,95%CI:1.431~13.925;手术时间窗:OR=9.065,95%CI:1.398~58.797;纤维蛋白原:OR=16.314,95%CI:3.059~86.994;DCVS程度:OR=3.562,95%CI:1.657~7.656);凝血酶原时间及大脑中动脉血流量是SAH后DCVS患者发生DCI的保护因素(凝血酶原时间:OR=0.004,95%CI:0.001~0.797;大脑中动脉血流量OR=0.287,95%CI:0.119~0.690)。见表3。

表3 影响患者伴发脑梗死的多因素Logistic回归分析
3 讨论
本研究72例SAH后DCVS患者中伴发脑梗死患者占比34.72%,预后严重致残(mRS≥4且<6)患者占比29.17%,死亡患者占比4.17%。经单因素及多因素Logistic回归分析发现,改良Fisher分级、Hunt-Hess分级、mRS评分、手术时间窗、凝血酶原时间及DCVS程度是SAH后DCVS伴发脑梗死的独立危险因素(P<0.05),纤溶酶原及大脑中动脉血流量是其保护因素(P<0.05)。
文献报道DCVS、脑梗死、患者基础疾病、动脉瘤形态大小、是否介入治疗等均是SAH患者预后情况的影响因素,其中DCVS与脑梗死影响最为严重[7]。本研究Fisher及Hunt-Hess分级结果显示,梗死组患者III级以上占比均高于非梗死组(P<0.05);在DCVS中/重度及大脑中动脉血流量中/重度闭塞数量比例更高(P<0.05)。DCVS是SAH后3 d左右开始,7~8 d可达到高峰,并可持续长达14~21 d。蛛网膜下腔出血后,损伤内皮的红细胞迅速释放血管收缩物质,刺激血管收缩;而大量堆积的血块对血管壁产生机械性的压迫及牵拉,引发血管内皮神经反射,加重管壁收缩。此时血管壁的剧烈收缩,促进了内皮细胞合成和释放内皮素等血管刺激物质,加剧管壁的持续性痉挛。有报道指出[8],由DCVS造成动脉管狭窄程度达到50%时,可使脑血流量显著下降,此时脑组织可通过提高氧提取分数,保证局部组织供血;但当脑血流量下降程度>50%时,脑组织无法补偿额外氧供,则会迅速发展为局部脑梗死[9]。由此可说明,出血量越大、出血次数多、DCVS痉挛程度越强烈,脑血流量越低,大脑缺血、缺氧的程度越严重,发生脑梗死概率明显更高。与此前的相关文献[3]显示相比,本研究脑梗死发生率及梗死患者死亡率均明显偏低,可能与本研究患者出血次数少、FisherIII级及Hunt-HessIII级患者人数少有关。本研究证实Fisher、Hunt-Hess分级以及DCVS痉挛程度均可独立影响SAH伴发DCVS后患者是否发生脑梗死,但出血次数在多元回归中并未呈现显著性,这与其他研究存在客观差异。
大量研究[10]认为,由脑梗死引发的脑损伤是SAH后患者致残或致死的主要原因。结合临床实践显示,mRS ≥4分患者即出现重度残疾,需要他人帮助满足生活需求,提示脑神经功能缺失严重,部分神经元细胞或已发生不可逆性损伤;而SAH患者若发病至手术治疗时间<24 h,则可大幅度降低DCVS及脑梗死的发生风险,降低二次出血及动脉瘤破裂造成的多重危险[11]。本研究结果显示,非梗死组患者mRS评分<4分,且患者手术时间窗<24 h占比超过半数,而梗死组符合患者尚不足9%。此外,SAH后患者机体的高凝状态,被广泛认为是诱发脑梗死的另一重要因素。SAH患者脑组织及脉管损伤后,损伤内皮使大量血小板黏附、聚集,并激活因子X释放大量凝血酶,促进纤维蛋白原及凝血酶原的转化,缩短凝血酶原时间,加速血液高凝、高粘、高纤溶状态[12];凝血活动增强后,管壁合成释放的纤溶酶原激活物迅速增加,正向促进血小板聚集速度,加剧高凝状态[13];同时凝血酶通过诱导内皮素等改变内皮基因表达过程、改变血管壁紧张程度、与纤溶酶共同激活NF-κB信号通路而介导炎症反应等途径,加剧DCVS症状,加重梗死风险。此外,纤维蛋白原在急性时相反应蛋白及凝血因子等共同作用下,凝聚成不可溶解的纤维蛋白多聚体,加速栓塞形成[14]。本研究结果显示,梗死组患者凝血酶原时间更短(P<0.05),而纤维蛋白酶原水平更高(P<0.05)。另有研究[15]指出,二聚体是脑梗死发生的危险因素,而本研究中二聚体在单因素分析中未体现显著性差异,可能与本研究样本量小及个体差异有关。此外,其他相关研究[16]还发现,性别、高血压、吸烟、饮酒、红细胞分布宽度等因素均为SAH后发生脑梗死的独立危险因素,但本研究中均未体现,后续研究可扩大样本量,进一步探讨。
综上所述,早诊断、早治疗,缩短手术治疗窗时间,妥善处理动脉瘤并积极预防并治疗术后DCVS,关注患者术后血压、血凝等指标,降低预后DCI的发生,降低致残或致死的发生率。
