初次ERCP选择性胆管插管困难的研究进展
2022-09-05范玲傅燕叶磊杨瑶刘懿
范玲,傅燕,叶磊,杨瑶,刘懿
(昆明医科大学第二附属医院消化内科,云南昆明650101)
1968年McCune等[1]首次介绍了内镜逆行胰胆管造影 术(endoscopic retrograde cholangiopancreatography,ERCP),我国的ERCP 技术起步于20 世纪70年代初,历经近半个世纪的发展与推广,随着ERCP 技术不断提高以及内镜附件不断优化,ERCP 已从主要的诊断方式转变为目前许多胆胰疾病首选的微创治疗手段[2]。然而,对于许多内镜医师而言,ERCP 仍是一项极具挑战性的操作,在很大程度上是因为存在不能忽视的胆管插管失败率、ERCP 术后胰腺炎(post-ERCP pancreatitis,PEP)及其他不良事件发生率[3]。
选择性胆管插管是ERCP 成功进行的第一步,也是最困难、最关键的一步,胆管插管的成功取决于患者的解剖结构、疾病特定因素、内镜医师的技术和经验等[4],据我国学者报道[5],约8.1%的患者出现插管困难。ERCP 胆管插管困难患者的手术难度大、手术时间长,显著增加术后不良事件发生率。PEP 是ERCP 最常见且最严重的并发症,插管困难已被证明是PEP 的独立危险因素[2],重度PEP 甚至可导致死亡[3]。采用ERCP 标准插管技术进行胆管插管的成功率约为75%~85%,而应用辅助插管技术[6],如双导丝(double-guidewire,DGW)技术、胰管支架占据法导丝引导插管(wire guide cannulation-pancreatic stent,WGC-PS)、经胰管预切开 术(transpancreatic precut sphincterotomy,TPS)、针刀乳头切开术(needle⁃knife papillotomy,NKP)、针刀瘘管切开术(needle-knife fistulotomy,NKF)可将插管困难患者整体插管成功率提高至95%[7]。既往普遍认为预切开术是ERCP 术后发生不良事件(尤其是PEP)的重要危险因素[8-9],在一定程度上限制了预切开技术的推广使用。然而越来越多的研究[10-11]发现,预切开术后PEP 发生率较高主要是由于预切开操作前长时间持续尝试标准插管技术导致乳头炎症水肿、导丝反复进入胰管及反复胰管造影等原因造成,并非预切开术。目前关于预切开的理想应用时机引起了内镜医生们的广泛关注,多项研究[12-13]称早期行预切开术可显著提高插管困难患者的初次插管成功率且可降低并发症发生率,然而目前关于插管困难的定义尚存争议,因此“早期”的具体含义目前尚不明确。
既往当标准插管技术以及先进辅助插管技术均失败时, 通常采取经皮肝穿刺胆道引流(percutaneous transhepatic cholangial drainage,PTCD)作为补救措施,然而随着超声内镜引导下胆道穿刺引流术(endoscopic ultrasound guided biliary drainage,EUS-BD)不断发展,目前已被公认为是ERCP 失败后的新替代方案[14]。此外,ERCP 初次胆管插管失败时,及时终止手术,择期行第2 次ERCP[15]及经皮经肝胆囊穿刺引流(percutaneous transhepatic gallbladder drainage,PTGD)[16-17]也是一种合适的替代措施。
笔者现对胆管插管困难的定义、风险因素及不良影响进行阐述,并且介绍和讨论了在初次ERCP 选择性胆管插管困难时常用的辅助插管技术以及选择方法,以期能为内镜医师在面临不同插管困难时做出更精准的决策提供临床借鉴意义。
1 胆管插管困难定义
已发表的文献中对胆管插管困难的定义差异较大,尚缺乏共识。大多数研究根据插管尝试次数和(或)插管时间来定义胆管插管困难,而目前关于插管尝试的描述尚不统一。有研究[18]将插管尝试定义为ERCP 术中对插管器材进行任何重新定位或插入。而Halttunen 等[19]将插管尝试描述为持续接触乳头至少5 s。由于各研究对插管尝试的定义不一,插管尝试次数的量化也就比较主观。一项前瞻性研究[20]发现插管时间似乎是评估插管难度更客观准确的指标。此外,还需将无意的胰管插管次数和胰管造影纳入考虑,已有研究[8]证实两者与插管困难以及PEP 风险增加相关。欧洲胃肠内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)指南[21]推荐将胆管插管困难定义为存在以下一种或多种情况:⑴在试图插管时与乳头接触超过5 次;⑵在乳头可视化后尝试插管超过5 min;⑶超过1 次意外的胰管插管或胰管造影。中国ERCP 指南(2018 版)[2]将插管困难描述为反复插管或插管时间延长(超过5~10 min)。而胆管插管困难国际共识[22]则将插管困难的定义为在标准的ERCP 操作中无法在10 min 以内或无法通过5 次尝试完成胆道选择性插管,或无法接近十二指肠主乳头。
2 胆管插管困难相关风险因素
胆管插管的成功与否主要受操作者因素(经验)和患者因素(解剖结构、疾病特定因素)的影响[4]。年操作ERCP 病例数多的内镜医师经验增加与较高的插管成功率、较低的并发症发生率及较短的手术时间密切相关[23]。在ERCP 培训期间,当选择性插管成功率超过80%时,学员将被视为有能力独立执行ERCP 操作,而这项能力可能需要完成至少300例次的ERCP 操作才能获得[24]。此外,有研究[4]指出由非内镜专家执行的ERCP、低容量内镜中心是插管困难的危险因素。我国一项大样本研究[5]发现,胆道良恶性狭窄、十二指肠乳头或壶腹肿瘤、十二指肠乳头粗而长、憩室旁乳头、异位乳头、水肿乳头、溃疡性乳头、胆胰管汇合异常以Billroth II 式胃切除术是选择性胆管插管困难的主要因素。多项研究[25-26]表明胆囊切除术史可能是插管困难的独立危险因素。一项基于多国ERCP 前瞻性数据库的研究[27]认为患者和疾病特定因素对胆管插管成功率影响更大,而内镜医师和机构层面的因素可能是次要的,但内镜医师的操作次数会影响最终插管成功率,理想的操作次数应超过200例/年。此外,镇静水平也可能影响插管成功率[28],与清醒状态相比,气管插管静脉全麻时麻醉镇静作用明显,胃肠道蠕动减少,十二指肠乳头括约肌不易因插管发生痉挛,可显著缩短插管时间,选择性插管成功率极高[29]。目前尚未发现高龄与胆道插管困难率增加有关[30]。
3 胆管插管困难的不良影响及PEP预测
在发生胆管插管困难时,由于对乳头的操作时间延长导致组织水肿,以及持续尝试插管导致导丝反复进入胰管等影响,PEP、出血以及穿孔等不良事件发生风险增加,目前已证实胆管插管困难是PEP 和穿孔的独立危险因素[3]。国内学者[31]报道PEP 发生率约为6.3%,韩国学者[32]进行的全国性队列研究报道PEP 发生率约为4.6%。ESGE 指南[3]指出PEP 发生率约为3.5%~9.7%,PEP 的发生导致可能需要延长住院时间、增加额外的医疗开支,0.1%~0.7%的患者死于PEP,PEP 成为ERCP 相关医疗诉讼的主要原因[33]。早期识别PEP 高危人群并对这些患者进行风险分层管理对于减少PEP 的发生率和病死率至关重要,有研究[34]发现年龄增长(≥75 岁)引起的胰腺萎缩、纤维化和外分泌功能减退对PEP 发生具有一定的抑制作用,但对PEP 的严重程度影响不明显。有研究[35]比较了BISAP、Balthazar、 Glasgow-Imrie、 APACHE II、 Marshall、PANC3、Ranson、HAPS 这八大常用的急性胰腺炎预后评分在PEP 诊断中预测中至重度病程的准确性,发现BISAP、Balthazar 和Glasgow-Imrie 分类是最有效的预后评分。然而以上预后评分模型针对的是各种病因导致的急性胰腺炎,专门用于PEP 的预测模型研究比较少见,近期有学者[36]提出了一个新的预测PEP 风险的实用评分系统,该预测评分系统由插管困难、胰管导丝留置技术、胰管造影等7个公认的PEP 危险因素构成,该评分系统的分值范围为:0~9 分[插管困难1 分、胰管导丝留置技术1 分、胰管造影1 分、PEP 病史2 分、完整的乳头1 分、胆管内超声(IDUS)/胆道取样2 分、胰管IDUS/胰管取样1 分]。低风险组(得分为0~2 分)PEP 发生率为2.0%,而高风险组(得分超过3 分)PEP 发生率为13.4%。
4 插管困难时常用辅助插管技术
4.1 DGW技术
DGW 技术,又称胰管导丝留置技术,此法有助于打开并稳定乳头孔,伸直胰胆管共同通道,机械关闭胰管开口,因此可减少胰管的反复注射或插管,并有助于术后沿胰管导丝放置胰管支架(图1)。

图1 DGW 技术 A:导丝误入胰管时,在胰管内留置第1 根导丝后,在其上方11 点钟方向用第2 根导丝进行选择性胆管插管;B:X线透视下可见通过DGW技术成功插入胆管Figure 1 DGW technique A: A guide wire inadvertently passing into the pancreatic duct, and selective bile duct intubation with the second guide wire at 11 o'clock above the indwelled first guide wire in the pancreatic duct; B: X-ray fluoroscopy showing successful insertion of the guide wire into the bile duct through the DGW technique
4.2 WGC-PS技术
WGC-PS 技术,即在胆管插管困难时,如果导丝进入胰管,立即随误入胰管的导丝放置胰管支架,然后在支架上方进行胆管插管,此外还可以在胰管支架上使用针刀进行预切开(图2),胰管支架上的预切开术(precut over a pancreatic duct stent,PPDS)是WGC-PS 的延伸,这两种胰管支架辅助插管技术通过放置胰管支架不仅可起到支撑指引作用,还可保护胰管开口,减少胰腺的损伤。

图2 WGC-PS技术 A:导丝误入胰管,随误入胰管的导丝放置5 cm 长的5 Fr 胰管支架;B:在胰管支架上方用弓形切开刀进行选择性胆管插管Figure 2 WGC-PS technique A:Aguide wire inadvertently passing into the pancreatic duct,and placement of a 5 cm long 5 Fr pancreatic duct stent alongside the inadvertently introduced guide wire; B: Selective bile duct cannulation with an arcuate incision above the pancreaticductstent
4.3 TPS技术
TPS 技术术式切口小,切口的方向和深度容易控制,有利于避免长时间插管导致的乳头水肿,同时方便放置胰管支架进行胰液引流(图3)。

图3 TPS 技术 A:X 线透视下可见导丝进入胰管;B:导丝引导弓形切开刀调整至胆管方向(11~12 点钟方向),从乳头开口处向上切开胆胰管共同隔膜暴露乳头内胆管下端,然后进行胆管插管Figure 3 TPS technique A: X-ray fluoroscopy showing the guide wire entering into the pancreatic duct; B:Adjusting the arcuate incision knife to the direction of the bile duct under guidance of the wire guided(11-12 o 'clock direction), and upward cuting the common septum of the biliopancreatic duct from the opening of the papilla to expose the lower end of the bile duct in the papilla,and then cannulating the bile duct
4.4 NKP技术
NKP 技术即为传统的预切开技术,此法切口较小,止血迅速、方便且能快速解除结石嵌顿,但对操作者技术水平要求高(图4)。

图4 NKP 技术 A:使用针刀自乳头开口11 点钟处向上逐层切开,直到切开乳头内的胆管下端括约肌,然后进行选择性胆管插管;B:成功插入胆管后乳头口可见浓黑色胆汁涌出Figure 4 NKP technique A: Using a needle knife to make incision in a layered fashion from the opening of the papilla at 11 o 'clock upwards until the dissection of the lower sphincter of the bile duct in the papilla,followedbyselectivebileductcannulation;B:Outflow of dense black bile from the papilla after successful bile duct insertion
4.5 NKF技术
NKF 技术也被称为针状刀开窗术,此术式保留了乳头,避免切开乳头下段部分的胰管括约肌,可减少PEP 发生率(图5)。
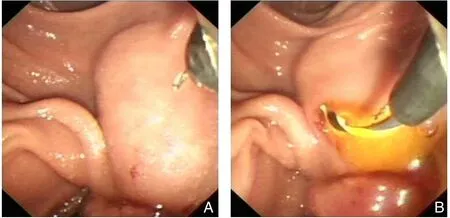
图5 NKF 技术 A:镜下可见十二指肠乳头隆起,乳头开口不易辨认;B:使用针刀在距乳头开口约5 mm处将黏膜刺穿成瘘口,然后经瘘口向11点方向切开,直至远端胆管显露,然后用导丝进行选择性胆管插管Figure 5 NKF technique A: Eminence of the duodenal papilla with difficult identification of the opening of the papilla under endoscopy; B: A fistula made by puncturing through the mucosa at about 5 mm from the opening of the papilla with a needle knife,followed by incision at 11 o 'clock through the fistula until the exposure of the distal bile duct, and then performing selective bile duct intubation with a guide wire
5 不同辅助插管技术有效性及安全性比较
一项纳入7 984例ERCP 的研究[37]报道,在标准插管失败后,行TPS 组的插管成功率为87.2%,明显高于DGW 组(74.5%)和NKP 组(69.6%),而DGW 组和NKP 组之间成功率无明显差异。关于PEP 发生率,TPS 组(1.1%)、DGW 组(6.4%)以及接受标准插管的对照组(2.3%)间无明显差异。而NKP 组的出血率明显高于TPS 组、DGW 组及标准插管对照组。近期的一项网络Meta 分析[6]发现,在提高插管成功率方面TPS 最优,其次是早期NKP,两者的PEP 发生率均低于DGW 和持续尝试标准插管技术。此外相较于其他技术,TPS 的切口方向和深度更容易控制,在技术上的要求相对较低。Barakat 等[37]认为TPS 可能是一种更容易让小容量内镜中心和经验不足的内镜医师学习和采用的技术,因此建议将TPS 视为插管失败的主要抢救方法。
相较于NKP 及NKF 这两种可普遍应用于所有插管困难情形的针刀预切开技术,TPS 及DGW 只能用于胰管插管成功的患者。此外,TPS 可能导致胰管狭窄形成,尤其在年轻患者中,但在一项长达11年的随访研究[37]中,未发现任何TPS 术后患者有并发胰管狭窄的证据。越来越多的研究[38-40]报道TPS 较其他方法应用于插管困难时具有高插管成功率和低PEP 发生率的优势,但以上结果是在理想比较环境中得出,在将这些数据应用于临床实践之前需要注意各个研究中关于预切开技术、插管困难定义、围手术期预防措施以及是否有学员参与等影响因素造成的差异。Bronswijk 等[41]认为尽管在反复胰管插管的情况下,TPS 可能更有效、安全,然而盲目推广TPS 存在风险,这可能导致对胰管进行插管以进行TPS 辅助胆道通路的无根据和潜在有害的尝试。
关于胰管支架辅助插管技术,有研究[42]报道与DGW 相比,WGC-PS 虽不能明显提高胆管插管成功率,但可明显降低PEP 发生率。此外,目前预防性胰管支架置入已被公认可显著降低PEP 发生率[2-3, 43-44],胰管支架置入对PEP 高危患者也具有成本效益[3]。ESGE 指南[21]推荐对意外胰管插管或胰管注射、实施DGW 以及TPS 的患者进行预防性胰腺支架置入术(强推荐)。然而,胰管支架的放置通常会使乳头开口变窄以及会压迫胆道口,有时会使标准胆管入路更加困难,此时为了促进胆管插管,还可以行PPDS。在插管困难且导丝意外进入胰管的患者中,与DGW/TPS 组相比,PPDS 组虽不能提高插管成功率(94.6 %vs.83.3%,P=0.18),但可明显降低术后总并发症发生率(0vs.20.8%,P=0.003)[45]。然而放置胰管支架后再行ERCP 操作的过程中支架可能发生移位,并且,若放置胰管支架失败后反而会显著增加PEP 的发生风险,此外术后长期放置胰管支架有支架堵塞和导管损伤的风险,中国ERCP 指南(2018 版)[2]推荐使用5 Fr 胰管支架,其置入成功率及自然脱落率高,并发症少,若支架发生移位,需要内镜下拔除,若胰管支架在ERCP 术后5~10 d 内仍未脱落,可能会诱发胰腺炎,推荐内镜下将支架移除。综上所述,在插管困难患者中行胰管支架辅助插管技术是安全有效的,并且支架应在胰管中留置至少12~24 h,以降低PEP 的风险[8]。
6 不同插管困难情况下插管技术的选择
6.1 无意进入胰管的插管困难患者
ESGE 指南[21]建议在胆管插管困难且导丝意外插入胰管的情况下,首选DGW,而TPS 仅作为二线选择。有研究[46]报道在导丝进入胰管的插管困难患者中依次采用DGW、TPS 和WGC-PS 的插管顺序总体插管成功率高,且并发症少。此外,最新研究数据[47-48]表明,与TPS 相比,DGW 具有较高PEP 发生风险及更低的插管成功率,笔者中心经验是在误入胰管的插管困难患者中,将TPS 视为与DGW 同等的一线选择中,并且在接受TPS 与DGW的患者中行预防性胰腺支架置入术。
6.2 未发生胰管插管的插管困难患者
对于未发生胰管插管的胆管插管困难患者,超过1 次的胰管插管已被认为是PEP 发生的独立危险因素[3],行DGW 及TPS 可能是不利的,此时首选的挽救技术为针刀预切开技术。与传统的NKP 相比,由于NKF 保留了括约肌和乳头口的完整,乳头开口和胰管的热损伤较小,从而具有较高的插管成功率和较低的PEP 发生风险[49]。但NKF 需要一定的解剖基础,如胆总管内壁长、结石嵌顿导致的乳头隆起等[50],笔者中心发现此时用针刀切开结石外面的胆管括约肌,由于有结石支撑,切开造瘘安全易行,而如果是扁平乳头或小乳头,则因为没有切开造瘘空间而无法进行。ESGE 指南[21]推荐将NKF 作为预切开的首选技术(强推荐),并且对于接受NKP 或NKF 的插管困难患者,术后行胰管支架置入术也是减少并发症的合适选择(弱推荐)。此外,由于针刀预切开术的切口的深度和方向不易控制,需要高水平的内镜技术,因此ESGE 指南[21]强调只有那些使用标准插管技术行选择性胆管插管成功率超过80%的内镜医师才能使用预切开技术。
6.3 预切开的时机
既往普遍认为预切开术是ERCP 术后不良事件(尤其是PEP)的重要危险因素[8-9],因此在一定程度上限制了预切开技术的推广使用。然而考虑到预切开技术通常在反复乳头插管尝试失败后进行,PEP 等ERCP 术后不良事件的真正原因是否仅归咎于预切开技术本身引起了关注。越来越多的研究[10-11]报道,标准插管技术持续失败导致的乳头刺激损伤增加、导丝反复进入胰管以及胰管注射才是预切开术后PEP 发生率较高的实际原因。与多次尝试插管使乳头水肿后才进行预切相比,早期预切可降低PEP 发生风险并增加胆管插管成功率。重复插管可能比预切开术更危险[13],对于胆管插管困难的患者,早期实施预切开术由于避免了对乳头黏膜的反复刺激,因此不会增加风险。Sundaralingam 等[13]发现,与持续标准插管相比,早期使用预切开术可以降低PEP 的风险并提高初次插管成功率。随后我国学者[12]也证实了这一观点。目前关于“早期”的具体范围仍存在很大争议,“早期”是相对于发生插管困难的时机而言的,如前所述插管困难的定义目前也尚不统一,而基于预切开时机的各项研究[10-11]中关于插管困难的定义及预切开技术的使用差异较大,这也导致预切开早期应用的时机差异也很大。近期一项研究[51]推荐在10 min 内对插管困难的患者进行早期预切开是安全有效的。尽管预切开术应用的最佳时间仍很难确定或标准化。但目前的证据表明,对于插管困难患者,由经验丰富的操作者尽早实施预切开术可提高插管成功率并减少不良事件发生率[12-13]。
6.4 不同乳头结构的插管困难患者
根据内窥镜下外观[52],十二指肠主乳头可分为4 种类型:1 型为普通规则乳头,2 型为扁平小乳头,3 型为突出或下垂的乳头,4 型为有褶皱或隆起的乳头。乳头的内镜外观影响胆管插管成功率,与1 型乳头相比(36%),2 型(52%)和3 型(48%) 乳头插管困难发生率更高(P<0.001)[53]。我国学者[54]也证实了这一点,并且他们发现小乳头与较高的PEP 发生率有关。此外,在Maharshi等[55]的研究中,3 型乳头最适合预切开,其次是1 型,而2 型扁平乳头最不利于预切开,可能与作者在文中均采取NKP 有关。而Horiuchi 等[56]根据乳头特征前瞻性地选择预切开技术,小乳头组行TPS、大乳头或突起乳头组行NKP、肿胀隆起的乳头组行NKF,各组的插管成功率分别为96%、90%、100%。ESGE 指南[21]也推荐对于插管困难的扁平小乳头应考虑行经胰管预切开术(强推荐)。此外,刘辉等[57]报道对于乳头冗长、膨大隆起或正常形态的乳头还可通过圈套器辅助Dual 刀预切开技术,该技术全程在直视下完成,操作简单,可能比较适合经验不足的操作者,但不建议应用于扁平小乳头、憩室内乳头。因此,基于乳头特征而非仅依靠内镜医师的偏好选择合适的预切开技术可能有更高的插管成功率并能减少并发症的发生。
7 初次ERCP失败的可行替代措施
在初次胆管插管困难的情况下,即使积极应用上述辅助插管技术,也并不总是能成功实现胆管插管。长时间或反复尝试插管以及预切开后的热损伤会使乳头充血水肿,可能导致胆管插管更加困难。此时可考虑及时终止手术数天后行第2 次ERCP、PTCD、PTGD 以及较新颖的EUS 引导的促进胆管通路和治疗的干预措施[58],如EUS-BD、EUS 引导会合术以及EUS 引导顺行干预术等。有研究[59]发现初次NKP 辅助胆管插管失败后,与PTCD及外科胆道手术引流相比,数天后重复ERCP 具有更高的插管率和低并发症发生率,应该在考虑更具侵入性的替代性干预措施之前进行尝试。可能因为此时乳头的充血水肿会随着时间的推移得到改善。目前关于第2 次ERCP 的实施时间尚存争议,有研究[60]报道第2 次ERCP 应至少间隔4 d 进行才是安全有效的,近期的一项研究[61]指出对于病情紧急需要立即缓解的患者,可行EUS 引导会合术或者PTCD,而对于病情稳定者,尽量等到48 h 后行第2 次ERCP 比较理想。笔者中心通常在初次ERCP失败后7 d 左右行第2 次ERCP,此时乳头的充血水肿一般已经完全消失,插管成功率更高。
ERCP 治疗失败后或胃肠改道术后内镜无法到达十二指肠乳头时,PTCD 以及EUS-BD 是有效的方法。但若存在胃流出道梗阻、十二指肠支架在位或手术解剖结构改变者,则内镜常无法到达主乳头,此时PTCD 可替代ERCP,避免手术治疗[2]。但PTCD 可能导致外部胆汁流失,并且长期成本高昂,此外如导管移位或闭塞、胆管炎以及皮肤感染等PTCD 术后不良事件发生率高达61.9%[62]。自2001年EUS-BD 初次问世以来,EUS-BD 已越来越多地用作初始ERCP 失败的胆道梗阻患者的新替代方法[14],在EUS 引导下经胃肝内途径或经十二指肠肝外途径穿刺肝内胆管或胆总管成功后,后续的治疗可通过经乳头会合技术或顺行干预实现胆道引流[63],其穿刺引流成功率约为90%,不良事件发生率约为20%[2]。多项研究[64-65]显示EUS-BD 和PTCD 之间的技术成功率无差异,但是EUS-BD 具有更高的成功率、更低的不良事件发生率、再干预率及更优的经济成本效益。因此,如果有足够的高级内镜操作经验,EUS-BD 是ERCP 失败后安全有效的替代措施。此外,有研究[16-17]发现与ERCP相比,对于急性胆源性胰腺炎患者,PTGD 能快速安全有效地减轻胆道压力,可作为ERCP 失败或无法耐受时的替代疗法。当以上抢救措施仍失败时,还可尝试经皮会合技术以及腹腔镜辅助ERCP 技术等[21],而采用何种方法将取决于当地医生的专业技术水平和内镜中心设施条件。
8 结论与展望
在持续应用标准插管技术失败时,应及时尝试先进的插管技术辅助插管。不同的辅助插管技术都有其适合的实施环境,TPS 具有高插管成功率且简单易学,在插管困难患者中具有较好的应用前景。早期应用预切开技术可明显减少不良事件的发生,而关于各种预切开技术的早期启动时机仍存在较大争议。目前关于不同辅助插管技术的选择没有明确的标准,为了实现更高的插管成功率及更少的不良事件,对各种先进辅助技术的选择应该基于内镜医师的经验、十二指肠乳头特征以及是否有意外的胰管插管等,而非仅依赖内镜医师的偏好或是对特定技术的熟悉程度。在初次ERCP 失败后的数天内进行重复ERCP 是一种成功的策略,应该在考虑更具侵入性的替代性干预措施之前进行尝试。目前胆管插管困难的定义仍未统一,而基于发生插管困难时的不同场景而设定不同插管顺序的研究较罕见,未来需要更多前瞻性多中心研究来协助建立规范的胆管插管困难处理流程。
利益冲突:所有作者均声明不存在利益冲突。
