深圳市大气污染物与肺源性脓毒症关系的时间分层病例交叉研究
2022-08-31陈璟史菲
陈璟,史菲
脓毒症通常由宿主对感染的反应失调引起[1],患者起病急、临床症状重、病情凶险,其病因较为复杂,感染可源于全身多个部位。呼吸道是人体抵御病原菌的第一道防线,故肺部感染已成为引发脓毒症的主要感染源之一(约占50%以上)[2-3],且肺源性脓毒症已成为全球高发病率和高死亡率的主要病因[4]。因此,如何预防或延缓肺源性脓毒症的发生、发展是亟待解决的临床问题。研究显示,每年全球约有900万人的死亡与大气污染物暴露有关,大气污染物暴露已成为全球疾病和过早死亡的最主要环境原因[5]。目前认为,空气颗粒物(particulate matter,PM)、臭氧(ozone,O3)、二氧化氮(nitrogen dioxide,NO2)、二氧化硫(sulfur dioxide,SO2)和一氧化碳(carbon monoxide,CO)是五大重要的大气污染物[6]。PM等各种大气污染物可刺激肺内多种炎症因子及促炎递质的释放,引起器官炎症及氧化应激,导致气道发生短期损伤及肺功能降低[7-8]。同时,各种病原体还可附着在大气污染物表面,增强病原体的播散能力,故大气污染物暴露可能与肺源性脓毒症的发生密切相关。因不同地域大气污染物暴露存在各自的特征,明确地区性大气污染物对疾病的影响,将有助于为该区域疾病防治提供新的线索和理论依据。本研究旨在分析深圳市大气污染物与肺源性脓毒症的关系,以期为制定肺源性脓毒症的防控措施提供可靠的循证医学证据。
1 对象与方法
1.1 研究对象 本研究为时间分层病例交叉研究。选取2018—2020年深圳市人民医院收治的肺源性脓毒症患者336例为研究对象。纳入标准:(1)符合2016年脓毒症3.0的诊断标准[9];(2)原发感染部位为肺部;(3)年龄≥18岁。排除标准:(1)晚期恶性肿瘤患者;(2)妊娠期或哺乳期妇女;(3)入院时即为不可逆的终末期患者;(4)长期卧床或长期居家治疗的患者;(5)发病前1周内未在深圳市区居住的患者。本研究已通过深圳市人民医院伦理委员会审批(编号:LLKT-201705001)。
1.2 资料收集
1.2.1 患者临床资料 收集患者住院日期、性别、年龄、吸烟史、合并症(糖尿病、高血压、冠状动脉疾病、慢性呼吸系统疾病、慢性肾脏病、慢性肝病、脑血管病)、住院时间、28 d病死情况。
1.2.2 大气污染物及气象资料 大气污染物及气象资料源自深圳市气象资料核心数据库,获取每例患者发病当天(住院当天)(记为Lag0)及发病前第1~7天(滞后1~7 d,记为Lag1~Lag7)的深圳市区大气污染物(PM1、PM2.5、PM10、NO2、SO2、CO、O3)浓度,并换算为统一计算单位(μg/m3或mg/m3);整理2018-01-01至2020-12-31深圳市区日均大气污染物浓度、气象资料(温度、相对湿度)。
1.3 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料符合正态分布以(±s)表示,不符合正态分布以M(P25,P75)表示;计数资料以相对数表示;两变量间的相关性分析采用Spearman秩相关分析,r|s|>0.8表示两指标间存在强相关关系,r|s|≤0.8表示两指标间存在弱相关关系[10-11];肺源性脓毒症影响因素分析采用单因素、多因素条件Logistic回归分析,并根据OR值最大原则确定大气污染物的最佳滞后期。以P<0.05为差异有统计学意义。
2 结果
2.1 肺源性脓毒症患者的临床资料 336例患者中,男213例(63.4%),女123例(36.6%);年龄19~99岁,平均(70.7±17.1)岁;有吸烟史88例(26.2%);合并症:糖尿病129例(38.4%),高血压162例(48.2%),冠状动脉疾病62例(18.5%),慢性呼吸系统疾病90例(26.8%),慢性肾脏病18例(5.4%),慢性肝病18例(5.4%),脑血管病82例(24.4%);住院时间12(8,19)d;28 d病死率为20.2%(68/336)。
2.2 大气污染物与气象资料的相关性 2018-01-01至2020-12-31深圳市区日均PM1、PM2.5、PM10、NO2、SO2、CO、O3分别为12.29(6.66,108.70)μg/m3、15.44(9.32,22.91)μg/m3、19.82(11.97,32.35)μg/m3、7.15(0.74,17.20)μg/m3、11.43(6.84,75.77)μg/m3、0.80(0.50,7.62)mg/m3、24.72(5.20,59.32)μg/m3,日均温度为24.80(20.58,28.35)℃,日均相对湿度为77.92%(70.40%,83.46%)。Spearman秩相关分析结果显示,日均PM2.5与日均PM1呈强正相关,日均PM10与日均PM1、PM2.5呈强正相关,日均NO2与日均PM1、PM2.5、PM10呈弱正相关,日均SO2与日均PM1、PM2.5、PM10、NO2呈弱正相关,日均CO与日均PM1、PM2.5、NO2呈弱正相关,日均O3与日均PM1、PM2.5、PM10、SO2呈弱正相关,日均O3与日均NO2呈弱负相关,日均温度与日均PM1、PM2.5、PM10、NO2、SO2呈弱负相关,日均相对湿度与日均PM1、PM2.5、PM10、NO2、SO2、O3呈弱负相关,日均相对湿度与日均CO、温度呈弱正相关(P<0.05),见表1。
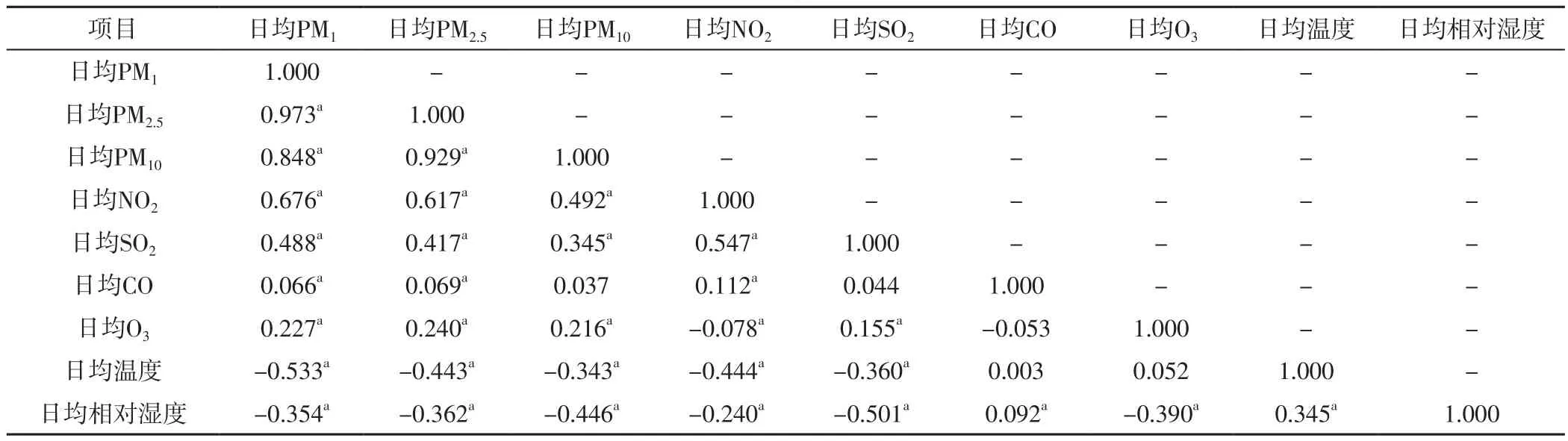
表1 大气污染物及气象资料的相关性(rs值)Table 1 Correlation between air pollutants and meteorological data
2.3 肺源性脓毒症影响因素的单因素条件Logistic回归分析 分别以不同时间PM1、PM2.5、PM10、NO2、SO2、CO、O3为自变量(实测值),肺源性脓毒症为因变量(赋值:是=1,否=0),以日均温度、相对湿度为协变量,进行单因素条件Logistic回归分析,结果显示,Lag6时PM1〔OR=1.742,95%CI(1.120,2.710),P=0.014〕及Lag4、Lag5、Lag6时O3〔OR=1.815,95%CI(1.135,2.903),P=0.013;OR=1.769,95%CI(1.094,2.862),P=0.006;OR=2.090,95%CI(1.258,3.475),P=0.004〕是肺源性脓毒症的影响因素,且滞后6 d是PM1、O3的最佳滞后期。
2.4 肺源性脓毒症影响因素的多因素条件Logistic回归分析 以Lag6时PM1、PM2.5、PM10为自变量(实测值),肺源性脓毒症为因变量(赋值:是=1,否=0),以日均温度、相对湿度为协变量,进行多因素条件Logistic回归分析,结果显示,在分别控制了PM2.5、PM10的影响后,PM1对肺源性脓毒症发病的影响有所减弱(P<0.05),见表2。
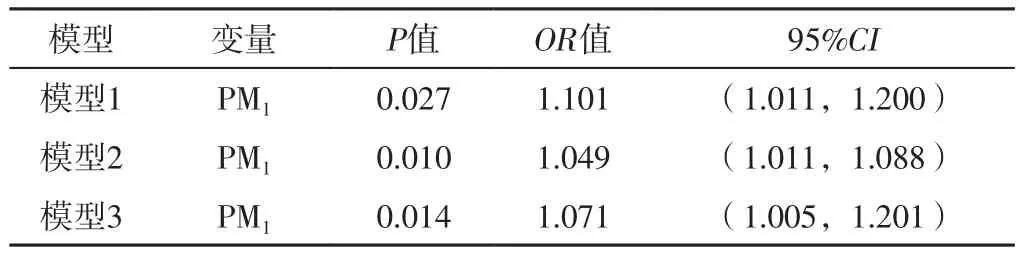
表2 肺源性脓毒症影响因素的多因素条件Logistic回归分析Table 2 Multivariate conditional Logistic regression analysis of influencing factors of pulmonary sepsis
3 讨论
肺源性脓毒症是脓毒症中最为常见、致残致死率较高的亚型。研究表明,大气颗粒物暴露可使患者罹患肺部感染,严重时存在死亡风险[12-14],但肺源性脓毒症患者发病与大气污染物之间的关系尚未见临床报道。深圳市是中国南部的海滨城市,濒临南海和太平洋,受南亚热带海洋季风气候影响,长夏短冬、日照充足,常年气候温和、雨量充沛,并常呈现昼热夜凉、冷热次序更替的特征,尽管深圳市的空气质量指数在全国范围内相对良好,但因其城市化水平高、全年部分时期存在个别大气污染物超标情况,仍有较多患者因肺源性脓毒症入院。对此,本研究采用时间分层病例交叉研究方法分析深圳市大气污染物与肺源性脓毒症的关系。时间分层病例交叉研究即通过比较同一患者在发病时(病例期)的大气污染物暴露情况和未发病时(对照期)的大气污染物暴露情况,研究大气污染物暴露和疾病发生的关联性。自身配对的病例对照研究能有效控制一些短期内相对固定的混杂因素,如吸烟、饮食、遗传、生活条件、经济等个体因素。同时,通过病例期与对照期的匹配以进一步控制时间趋势、季节性、短期自相关性等与时间有关的因素,减少基础疾病等对数据分析结果的干扰。
PM是大气中各种具有不同化学组分的颗粒状物质的混合体,其主要来源为工厂灰尘、汽车尾气、煤炭/麦秸燃烧等。PM的直径越小,其表面积越大,可携带、吸收的有毒物质也越多,如重金属、有机化合物和黑炭等,从而明显增加患病风险,其中PM1指空气中直径≤1.0 μm的颗粒物[6]。PM被人体吸入后沉积在呼吸道、肺泡等部位并通过肺部进入血液,从而引发各种疾病[15]。一项关于2014—2017年深圳市呼吸系统疾病死亡的病例研究发现,PM1浓度升高可引起呼吸系统疾病死亡率增加,其最佳滞后时间为Lag3[16]。另一项关于2015—2016年深圳市的研究显示,PM1浓度增高可明显增加患者因肺炎及慢性阻塞性肺疾病入院的风险[17]。本研究Spearman秩相关分析结果显示,日均PM2.5与日均PM1呈强正相关,日均PM10与日均PM1、PM2.5呈强正相关;单因素条件Logistic回归分析结果显示,Lag6时PM1是肺源性脓毒症的影响因素,且滞后6 d是PM1的最佳滞后期;多因素条件Logistic回归分析结果显示,在分别控制了PM2.5、PM10的影响后,PM1对肺源性脓毒症发病的影响有所减弱;与上述研究结果相似,提示滞后6 d PM1对肺源性脓毒症发病的影响最大,且PM2.5、PM10可使其对肺源性脓毒症发病的影响减弱。
O3是二次大气污染物,是由车辆和工业排放的氮氧化物与阳光发生光化学反应后形成的光化学烟雾。作为一种强力氧化剂,O3可通过多种机制诱导气道内巨噬细胞、上皮细胞等产生各种促炎递质,通过形成自由基、脂质过氧化物及使酶活性丧失、膜通透性发生改变,引起肺部炎症、氧化应激,导致呼吸道短期损伤及肺功能降低[7-8]。日本西部城市的一项研究表明,短期O3暴露将增加儿童呼吸道疾病症状[18]。中国的一线流调研究也表明,1990—2013年大气O3污染导致中国不同省份慢性阻塞性肺疾病发病率增高,造成了较大的健康和经济损失[19]。本研究单因素条件Logistic回归分析结果显示,Lag4、Lag5、Lag6时O3是肺源性脓毒症的影响因素,且滞后6 d是O3的最佳滞后期。由此可知,O3短期暴露即可对肺源性脓毒症发病产生重要影响,需进行积极预防和关注。
综上所述,深圳市大气污染物中的PM1及O3升高可导致肺源性脓毒症发病风险升高,且滞后6 d是其最佳滞后期,此外,PM2.5、PM10可使PM1对肺源性脓毒症发病的影响减弱。然而,本研究尚存在一定局限性:本研究为单中心临床研究,样本量较小、研究持续时间有限,可能存在结果偏倚,需要更大规模的研究验证本结论。另外,本研究仅采用回顾性研究方法研究了大气污染物暴露与肺源性脓毒症发病之间的相关性,未能深入探讨大气污染物浓度对肺源性脓毒症患者体内炎症水平的影响及其作用机制。此外,由于研究时间及方法受限,并未分析高浓度大气污染物是否导致患者感染某种类别病菌的概率增加、不同基础疾病或吸烟状况的患者罹患肺源性脓毒症的风险增加。因此,下一步将开展多中心临床研究、扩大样本量、并对不同基础疾病的亚组患者开展相关基础研究,以期获得更加准确的结论。
作者贡献:陈璟进行文章的构思与设计,文献/资料的收集、整理,统计学处理,撰写论文;史菲进行文章的可行性分析,负责文章的质量控制及审校,对文章整体负责、监督管理;陈璟、史菲进行论文的修订。
本文无利益冲突。
