紫檀芪对人结直肠癌细胞生物行为的影响及作用机制研究①
2022-08-30吴雪峰贵州中医药大学第一附属医院肛肠科贵阳550001
李 志 冷 羽 蔡 涛 吴雪峰 (贵州中医药大学第一附属医院肛肠科,贵阳 550001)
结直肠癌是威胁我国人口生命安全的恶性肿瘤之一,其早期临床症状较为隐匿导致大部分患者失去最佳治疗时机[1]。不能接受根治性手术的患者需要接受药物治疗,中草药具有毒副作用小、效果好等优势,并可抑制结直肠癌细胞的增殖及转移,促进细胞凋亡[2-3]。紫檀芪为芪类化合物,且属于白藜芦醇天然二甲基化类似物,广泛存在于蓝莓、葡萄中,具有抗癌、抗氧化作用[4]。LncRNA ELFN1-AS1 在结直肠癌细胞中表达水平升高,其可通过调节miR-4644/TRIM44促进结直肠癌细胞的增殖和迁移[5]。生物信 息学分 析 显示 ELFN1-AS1 与 miR-1205存在结合位点,miR-1205在结直肠癌细胞中表达水平降低,研究表明,LncRNA ZEB2-AS1 通过miR-1205/CRKL 途径促进结直肠癌细胞转移[6]。但ELFN1-AS1/miR-1205 是否参与紫檀芪调控结直肠癌细胞生物学行为过程尚未可知。因此,本研究主要探讨紫檀芪是否可以通过调控ELFN1-AS1/miR-1205影响结直肠癌细胞的生物学行为。
1 材料与方法
1.1 材料 紫檀芪(537-42-8)购自美国Selleck;人结直肠癌细胞Caco-2 购自中国典型培养物保藏中心;DMEM 培养基(PM150310B)购自美国Hyclone;胎牛血清(10099141C)购自美国Gibco;CCK-8 试剂(20181203)购 自 上 海 碧 云 天 ;Transwell 小 室(p002439)购自美国Corning;基质胶(356234)、凋亡检 测 试 剂 盒(556507)购 自 美 国 BD;Lipo‑fectamine2000(11668019)购自美国Invitrogen;si-NC、si-ELFN1-AS1、miR-NC、miR-1205 mimics 购自广州锐博生物;pcDNA、pcDNA-ELFN1-AS1 购自上海吉玛;Trizol(20190203)购自北京全式金生物;反转录试剂(20190216)、SYBR Green 试剂(20190106)购自北京天根生化;E-cadherin、N-cadherin、GAPDH 一抗购自美国CST;羊抗兔二抗购自美国Abcam。
1.2 方法
1.2.1 实验分组 Caco-2 细胞分别接种于含不同浓度(20、40、80 µmol/L)紫檀芪的培养基内培养24 h,分别记为紫檀芪20µmol/L组、紫檀芪40µmol/L组、紫檀芪 80 µmol/L 组[7]。同时将正常培养的 Caco-2细胞作为对照组。si-NC、si-ELFN1-AS1分别转染至Caco-2 细胞后继续培养24 h,分别记为si-NC 组、si-ELFN1-AS1 组。pcDNA、pcDNA-ELFN1-AS1 分别转染至Caco-2 细胞后加入含80µmol/L 紫檀芪的培养基内培养24 h,分别记为紫檀芪+pcDNA 组、紫檀芪+pcDNA-ELFN1-AS1组。
1.2.2 qRT-PCR 检 测 细 胞 中 ELFN1-AS1、miR-1205 的表达水平[8]采用 Trizol 法提取 Caco-2 细胞总RNA,反转录合成cDNA,PCR 扩增反应体系与程序均按照试剂盒说明书操作,并检测ELFN1-AS1、miR-1205相对表达量。
1.2.3 CCK-8 实验检测细胞增殖[9]收集各组Caco-2 细胞接种于96 孔板(1×103个/孔),将CCK-8溶液加入96孔板(10µl/孔),继续培养2 h后检测吸光度值。
1.2.4 平板克隆形成实验[10]收集各组Caco-2 细胞接种于6孔板(1×103个/孔),培养14 d后弃去培养基,然后加入预冷的PBS洗涤,加入甲醇(500µl/孔)后置于−20 ℃环境固定20 min,加入1%结晶紫染色液(400µl/孔)后染色15 min,洗涤后晾干、拍照。
1.2.5 流式细胞术检测细胞凋亡率[11]收集各组Caco-2 细胞加入预冷的PBS 洗涤后弃上清,将500 µl 结合缓冲液加入细胞,沉淀后分别加入Annexin V-FITC(5 µl)、PI(5 µl),振荡摇晃孵育10 min,然后检测细胞凋亡率。
1.2.6 划痕实验[12]将各组 Caco-2 细胞(2.5×105个/ml)加入6 孔板(200 µl/孔),在培养板底部水平方向划线,待细胞培养24 h后观察细胞迁移距离。
1.2.7 Transwell实验检测细胞侵袭[13]Matrigel基质胶稀释液加入小室的上室(40µl/孔)后孵育5 h,加入各组Caco-2 细胞悬液(3×105个/ml,200 µl/孔),下室加入600 µl 含10%胎牛血清的培养液,培养24 h后PBS 洗涤,多聚甲醛固定20 min 后加入0.1%结晶紫染液染色10 min,显微镜下观察侵袭细胞数。
1.2.8 双荧光素酶报告基因检测ELFN1-AS1 与miR-1205 的靶向关系[14]构建含有结合位点的野生型载体WT-ELFN1-AS1与含有突变位点的突变型载体MUT-ELFN1-AS1,miR-NC、miR-1205 mimics 分别 与 WT-ELFN1-AS1、MUT-ELFN1-AS1 共 转 染 至Caco-2 细胞后继续培养24 h,收集细胞后检测其荧光素酶活性。
1.2.9 Western blot 检测 E-cadherin、N-cadherin 蛋白表达[15]提取各组Caco-2 细胞总蛋白,BCA 法测定蛋白浓度后加入上样缓冲液,将其置于沸水中孵育10 min,蛋白变性后取50 µg 进行SDS-PAGE 分离蛋白,转膜、封闭,4 ℃孵育一抗稀释液(1∶1 000)过夜,室温条件下孵育二抗稀释液(1∶2 000)1 h,滴加ECL显影,应用Image J软件分析各条带灰度值。
1.3 统计学处理 采用SPSS21.0统计学软件分析数据,计量资料以表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 紫檀芪对结直肠癌细胞增殖、凋亡的影响与对照组相比,紫檀芪20、40、80 µmol/L 组ELFN1-AS1 表达水平均降低(P<0.05),miR-1205 表达水平均升高(P<0.05),细胞活性降低(P<0.05),集落形成数减少(P<0.05),凋亡率升高(P<0.05),且不同剂量组间各指标比较差异有统计学意义(P<0.05),见图1、表1。
表1 紫檀芪抑制结直肠癌细胞增殖并促进其凋亡(,n=3)Tab.1 Pterostilbene inhibits proliferation and promotes apoptosis of colorectal cancer cells(,n=3)

表1 紫檀芪抑制结直肠癌细胞增殖并促进其凋亡(,n=3)Tab.1 Pterostilbene inhibits proliferation and promotes apoptosis of colorectal cancer cells(,n=3)
Note:Compared with control group,1)P<0.05;compared with pterostilbene 20 µmol/L group,2)P<0.05;compared with pterostilbene 40 µmol/L group,3)P<0.05.
Apoptosis rate(%)8.14±0.50 15.21±0.651)20.05±0.821)2)24.46±1.061)2)3)237.639 0.000 Groups Control Pterostilbene 20µmol/L Pterostilbene 40µmol/L Pterostilbene 80µmol/L F P ELFN1-AS1 1.00±0.00 0.73±0.051)0.45±0.041)2)0.23±0.021)2)3)298.911 0.000 miR-1205 1.00±0.00 1.49±0.081)2.11±0.111)2)3.68±0.191)2)3)298.535 0.000 Cell activity(OD value)1.26±0.09 0.94±0.071)0.71±0.041)2)0.48±0.031)2)3)85.852 0.000 Colony forming number 105.33±3.30 82.67±2.491)65.33±2.051)2)42.67±1.251)2)3)369.891 0.000
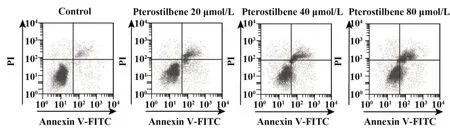
图1 紫檀芪可诱导结直肠癌细胞凋亡Fig.1 Pterostilbene can induce apoptosis of colorectal cancer cells
2.2 紫檀芪对结直肠癌细胞迁移、侵袭的作用与对照组相比,紫檀芪20、40、80µmol/L组细胞迁移距离缩短,侵袭细胞数减少,E-cadherin 蛋白水平升高,N-cadherin 蛋白水平降低,且不同剂量组间比较差异有统计学意义(P均<0.05),见图2、表2。
表2 紫檀芪抑制结直肠癌细胞的迁移、侵袭(,n=3)Tab.2 Pterostilbene inhibits migration and invasion of colorectal cancer cells(,n=3)
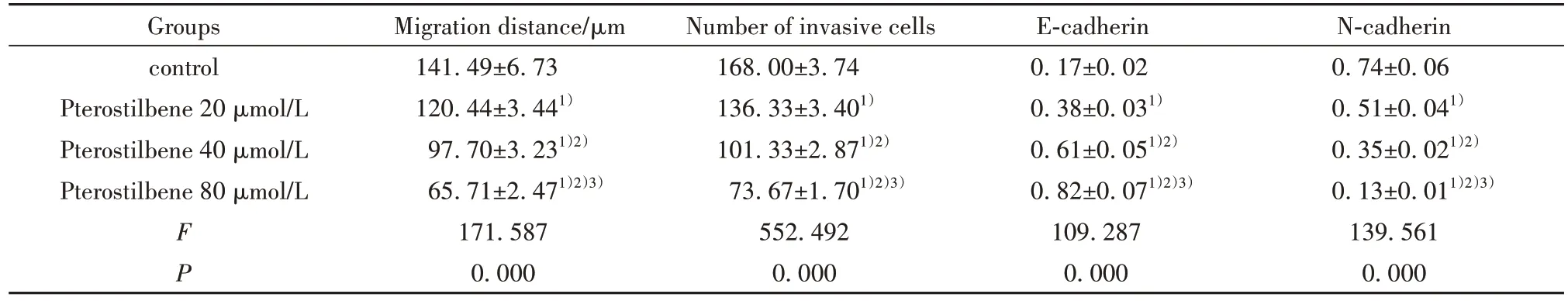
表2 紫檀芪抑制结直肠癌细胞的迁移、侵袭(,n=3)Tab.2 Pterostilbene inhibits migration and invasion of colorectal cancer cells(,n=3)
Note:Compared with control group,1)P<0.05;compared with pterostilbene 20 µmol/L group,2)P<0.05;compared with pterostilbene 40 µmol/L group,3)P<0.05.
N-cadherin 0.74±0.06 0.51±0.041)0.35±0.021)2)0.13±0.011)2)3)139.561 0.000 Groups control Pterostilbene 20µmol/L Pterostilbene 40µmol/L Pterostilbene 80µmol/L F P Migration distance/µm 141.49±6.73 120.44±3.441)97.70±3.231)2)65.71±2.471)2)3)171.587 0.000 Number of invasive cells 168.00±3.74 136.33±3.401)101.33±2.871)2)73.67±1.701)2)3)552.492 0.000 E-cadherin 0.17±0.02 0.38±0.031)0.61±0.051)2)0.82±0.071)2)3)109.287 0.000

图2 紫檀芪对结直肠癌细胞中E-cadherin、N-cadherin蛋白表达的影响Fig.2 Effect of pterostilbene on expressions of E-cadherin and N-cadherin protein in colorectal cancer cells
2.3 干扰ELFN1-AS1 对结直肠癌细胞增殖、凋亡、迁移、侵袭的作用 与si-NC 组相比,si-ELFN1-AS1组miR-1205 表达水平升高,细胞活性降低,集落形成数减少,凋亡率升高,迁移距离缩短,侵袭细胞数减少,E-cadherin 蛋白水平升高,N-cadherin 蛋白水平降低(P均<0.05),见图3、表3、表4。
表3 干扰ELFN1-AS1抑制结直肠癌细胞增殖并促进其凋亡(,n=3)Tab.3 Interference with ELFN1-AS1 inhibits proliferation and promotes apoptosis of colorectal cancer cells(,n=3)

表3 干扰ELFN1-AS1抑制结直肠癌细胞增殖并促进其凋亡(,n=3)Tab.3 Interference with ELFN1-AS1 inhibits proliferation and promotes apoptosis of colorectal cancer cells(,n=3)
Note:Compared with si-NC group,1)P<0.05.
Apoptosis rate(%)8.12±0.49 25.25±1.221)22.567 0.000 Groups si-NC si-ELFN1-AS1 t P ELFN1-AS1 1.00±0.00 0.11±0.011)154.153 0.000 miR-1205 1.00±0.00 4.24±0.151)37.412 0.000 Cell activity(OD value)1.28±0.10 0.39±0.031)14.765 0.000 Colony forming number 105.67±2.62 36.33±1.251)41.372 0.000
表4 干扰ELFN1-AS1抑制结直肠癌细胞迁移、侵袭(,n=3)Tab.4 Interference with ELFN1-AS1 inhibits migration and invasion of colorectal cancer cells(,n=3)

表4 干扰ELFN1-AS1抑制结直肠癌细胞迁移、侵袭(,n=3)Tab.4 Interference with ELFN1-AS1 inhibits migration and invasion of colorectal cancer cells(,n=3)
Note:Compared with si-NC group,1)P<0.05.
N-cadherin 0.74±0.07 0.07±0.011)16.412 0.000 Groups si-NC si-ELFN1-AS1 t P Migration distance/µm 141.73±7.66 53.33±2.201)19.212 0.000 Number of invasive cells 168.67±4.78 66.33±1.251)35.877 0.000 E-cadherin 0.17±0.01 0.89±0.061)20.502 0.000

图3 干扰ELFN1-AS1 诱导结直肠癌细胞凋亡及对E-cad⁃herin、N-cadherin蛋白表达的影响Fig.3 Effect of interference with ELFN1-AS1 on apopto⁃sis and expressions of E-cadherin and N-cadherin in colorectal cancer cells
2.4 ELFN1-AS1 逆转紫檀芪对结直肠癌细胞增殖、凋亡的作用 与紫檀芪+pcDNA 组相比,紫檀芪+pcDNA-ELFN1-AS1 组miR-1205 表达水平降低,细胞活性增强,集落形成数增多,凋亡率降低(P均<0.05),见图4、表5。
表5 ELFN1-AS1可减弱紫檀芪对结直肠癌细胞增殖、凋亡的作用(,n=3)Tab.5 ELFN1-AS1 can attenuate effect of pterostilbene on proliferation and apoptosis of colorectal cancer cells(,n=3)

表5 ELFN1-AS1可减弱紫檀芪对结直肠癌细胞增殖、凋亡的作用(,n=3)Tab.5 ELFN1-AS1 can attenuate effect of pterostilbene on proliferation and apoptosis of colorectal cancer cells(,n=3)
Note:Compared with pterostilbene+pcDNA group,1)P<0.05.
Apoptosis rate(%)24.56±1.05 12.73±0.561)17.219 0.000 Groups Pterostilbene+pcDNA Pterostilbene+pcDNA-ELFN1-AS1 t P ELFN1-AS1 0.23±0.02 0.91±0.071)16.178 0.000 miR-1205 3.68±0.20 1.19±0.061)20.655 0.000 Cell activity(OD value)0.49±0.03 1.06±0.081)11.555 0.000 Colony forming number 42.33±1.25 94.00±2.941)28.014 0.000

图4 ELFN1-AS1 可减弱紫檀芪对结直肠癌细胞凋亡的促进作用Fig.4 ELFN1-AS1 can reduce effect of pterostilbene on apoptosis of colorectal cancer cells
2.5 ELFN1-AS1 可逆转紫檀芪对结直肠癌细胞迁移、侵袭的影响 与紫檀芪+pcDNA 组相比,紫檀芪+pcDNA-ELFN1-AS1 组迁移距离增加,侵袭细胞数增多,E-cadherin 蛋白水平降低,N-cadherin 蛋白水平升高(P均<0.05),见表6、图5。

图5 ELFN1-AS1 可逆转紫檀芪对结直肠癌细胞E-cad⁃herin、N-cadherin蛋白表达的影响Fig.5 ELFN1-AS1 can reverse effect of pterostilbene on expressions of E-cadherin and N-cadherin protein in colorectal cancer cells
表6 ELFN1-AS1可减弱紫檀芪对结直肠癌细胞迁移、侵袭的抑制作用(,n=3)Tab.6 ELFN1-AS1 can attenuate inhibitory effect of pterostilbene on migration and invasion of colorectal cancer cells(,n=3)

表6 ELFN1-AS1可减弱紫檀芪对结直肠癌细胞迁移、侵袭的抑制作用(,n=3)Tab.6 ELFN1-AS1 can attenuate inhibitory effect of pterostilbene on migration and invasion of colorectal cancer cells(,n=3)
Note:Compared with pterostilbene+pcDNA group,1)P<0.05.
N-cadherin 0.14±0.01 0.63±0.051)16.644 0.000 Groups Pterostilbene+pcDNA Pterostilbene+pcDNA-ELFN1-AS1 t P Migration distance/µm 66.47±3.33 130.68±6.531)15.172 0.000 Number of invasive cells 74.00±2.45 153.33±3.091)34.844 0.000 E-cadherin 0.82±0.07 0.23±0.021)14.037 0.000
2.6 ELFN1-AS1 和miR-1205 的靶向关系验证LncBase v.2 预测显示 ELFN1-AS1 与 miR-1205 存在结合位点,见图6。miR-1205 过表达可明显降低野生型载体WT-ELFN1-AS1 的荧光素酶活性(P<0.05),而对突变型载体MUT-ELFN1-AS1 的荧光素酶活性无明显影响,见表7。

图6 ELFN1-AS1和miR-1205的互补序列Fig.6 Complementary sequences of ELFN1-AS1 and miR-1205
表7 双荧光素酶报告实验(,n=3)Tab.7 Double luciferase report experiment(,n=3)

表7 双荧光素酶报告实验(,n=3)Tab.7 Double luciferase report experiment(,n=3)
Note:Compared with miR-NC group,1)P<0.05.
MUT-ELFN1-AS1 0.99±0.08 0.93±0.06 1.039 0.357 Groups miR-NC miR-1205 t P WT-ELFN1-AS1 1.00±0.09 0.27±0.021)13.714 0.000
3 讨论
筛选能够抑制结直肠癌细胞增殖及转移的药物已成为抗肿瘤药物研究的热门。多种草本植物具有抗炎、抗氧化等作用,但药物通过调控何种途径而发挥作用尚需进一步探究[16]。LncRNA 是一类不具备编码蛋白功能的RNA,其可通过多种途径调控肿瘤相关基因表达,参与结直肠癌的发生及发展[17-18]。但中草药是否可以通过靶向LncRNA 而发挥抗结直肠癌的作用尚需进一步验证。
紫檀芪与白藜芦醇具有相似的作用,由于白藜芦醇第3 位与第5 位的羟基替换为甲氧基导致紫檀芪的亲脂性与口服吸收率均明显提高,半衰期延长。研究表明,紫檀芪具有抗肺癌、乳腺癌等多种肿瘤的抗癌作用[19]。紫檀芪可通过调控AMPK通路抑制肺腺癌细胞的增殖并诱导细胞凋亡[20]。但紫檀芪对结直肠癌的治疗作用及其作用机制鲜有报道。本研究结果显示,紫檀芪能够降低结直肠癌细胞活性,促使集落形成数减少,细胞凋亡率升高,且呈剂量依赖性,提示紫檀芪可抑制结直肠癌细胞的增殖及克隆形成并促进细胞凋亡。E-cadherin 在结直肠癌细胞中低表达,而N-cadherin 在结直肠癌细胞中高表达,二者均属于上皮-间质转化(epithelialmesenchymal transition,EMT)中的重要蛋白,EMT 与肿瘤转移能力有关,E-cadherin 表达上调可抑制EMT 抑制细胞转移,而N-cadherin 的作用与之相反[21]。本研究结果显示,紫檀芪能够抑制结直肠癌细胞迁移,减少侵袭细胞数,调控E-cadherin 与N-cadherin表达,且呈剂量依赖性。
本研究结果显示,随着紫檀芪浓度的增加,结直肠癌细胞中ELFN1-AS1 的表达水平随着药物剂量的增加而明显降低。有研究表明,ELFN1-AS1 可竞争性地结合miR-183-3p,上调GFPT1,从而促进食管 癌 进 展[22]。 ELFN1-AS1 通 过 调 节 miR-497-3p/CLDN4 轴促进卵巢癌细胞的增殖、迁移和侵袭[23]。本研究结果显示,紫檀芪干扰ELFN1-AS1 表达能够促使miR-1205 的表达水平升高,降低细胞活性,集落形成数减少,细胞凋亡率增高,迁移及侵袭能力降低;紫檀芪处理后结直肠癌细胞中miR-1205表达水平升高,miR-1205 过表达后紫檀芪对结直肠癌细胞增殖、凋亡、迁移及侵袭的作用明显减弱。进一步证实ELFN1-AS1 可靶向结合miR-1205。与WANG 等[24]报道的 miR-1205 在卵巢癌中表达水平降低,circRNA_102958 通过 miR-1205/SH2D3A 轴促进卵巢癌进展;YANG 等[25]报道的 circ_0039411 通过 miR-1179/ABCA9 和 miR-1205/MTA1 信号通路促进甲状腺乳头状癌的发生和发展;YANG 等[26]报道的circ-POSTN 通过充当miR-1205 的海绵分子进而促进神经胶质瘤细胞生长基本相符。
综上,紫檀芪可降低结直肠癌细胞中ELFN1-AS1 的表达水平,使miR-1205 表达水平升高,说明紫檀芪抗结直肠癌的作用与下调ELFN1-AS1 的表达有关,ELFN1-AS1/miR-1205可参与结直肠癌的形成及发展过程,可能为紫檀芪治疗结直肠癌的潜在靶点,值得进一步研究。
