花旗参在大鼠体内的药代动力学特征研究
2022-08-30朱洪萱黄天养余孝云曹永军张存珍余琳玲刘连生崔国祯
朱洪萱,黄天养,余孝云,曹永军,尚 强,张存珍,余琳玲,刘连生,崔国祯
(1.遵义医科大学珠海校区 生物工程系,广东 珠海 519041;2.国家中药现代化工程技术研究中心,广东 珠海 519090;3.苏州大学 药学院,江苏 苏州 215123)
花旗参是人参的一种,又称西洋参,为五加科多年生草本植物西洋参的干燥根。花旗参原产于北美洲地区,经过引种栽培,我国现已成为世界上花旗参三大主产国之一[1],并收载于《中国药典》。花旗参中含有多种对人体有益成分[2],其功能包括抗氧化[3]、调节脂质代谢紊乱[4]、抗肿瘤[5-6]、防治肠炎[7]和调节免疫力等[8]。有研究表明,其主要活性成分为次生代谢物-人参皂苷(主要是三萜皂苷类化学物质)[9]。目前已分离鉴定的人参单体皂苷有40余种,其中Rhl、Rf、Re、Rc和Rb1为花旗参人参皂苷中的主要成分,各自具有其独特的功能与活性,以上成分的血液含量多少直接影响其药理学功能的产生。2020年版《中国药典》中规定了花旗参中以人参皂苷Rb1、Re和Rg1为质量标志物。
市场上常见的花旗参产品主要有人参口服液、胶囊、饮片等纯参制剂及以花旗参为主要原料的复方制剂。在中药各成分药效作用的发挥中,入血吸收是关键因素之一。花旗参茶是把花旗参经过65%的乙醇浸提浓缩后,再经制粒工艺制备而成的花旗参颗粒制剂。目前,作为颗粒制剂的花旗参茶与纯参制剂的花旗参饮片泡水口服后,入血的有效成分相关的药代动力学研究还未见报道。在本研究中,我们比较了大鼠灌胃相同质量花旗参生药制备的花旗参饮片水提物和花旗参茶水溶液后,观察5种人参皂苷Rh1、Rf、Re、Rc和Rb1入血吸收情况及入血吸收前后浓度随时间的变化,为花旗参制品的制备方法选择和药效物质基础研究提供科学依据。
1 材料与方法
1.1 试验药物 花旗参饮片购自珠海市源春林药业有限公司;鹰牌花旗参茶(后面统称为花旗参茶)由健康药业(中国)有限公司加工生产(G20050764),人参茎叶总皂苷以及人参皂苷单体Rh1(批号:HG027748198)、Rf(批号:HG027172198),Re(批号:HG027169198)、Rc(批号:HG027168198)、Rb1(批号:HG027159198)和地高辛(批号:HD212626)对照品均购自宝鸡市辰光生物科技有限公司。
1.2 动物 雄性SD大鼠(动物合格证:SCXK(粤)2018-0002),体重300~350 g,购自于广东实验中心,按照我们报道的方法[10],饲养于遵义医科大学珠海校区实验动物房。实验伦理审查批准号:伦审[2020]2-075号。
1.3 试剂 甲醇(批号:M116125)、乙腈(批号:A298777)、甲酸(批号:F298780)均为色谱纯和肝素钠(批号:H104201)均购自上海阿拉丁生化科技股份有限公司。
1.4 仪器 安捷伦1290-6530Q-TO超高压液相色谱/四极杆串联(美国安捷伦),XS205DU RE分析天平(梅特勒),Multifuge X1R高速离心机(美国Thermo Scientific),氮吹仪(中国郑州宝晶电子科技有限公司),旋涡器(中国艾卡仪器设备有限公司)。
1.5 花旗参溶液的制备 水泡花旗参饮片溶液的制备:取0.294 g花旗参饮片浸泡于42 mL沸水中浸泡4 h,将其去渣后备用;花旗参茶的制备:取由相同质量制备的花旗参茶1.26 g(每包净重3 g,花旗参生药含量为0.7 g)溶于42 mL水中备用。
1.6 色谱-质谱条件 参考我们报道的方法[11],对色谱和质谱的检测参数进行了优化。Phenomenex C18色谱柱(150 mm×2.0 mm,5 μm),柱温45oC,流动相为0.1%的甲酸水溶液(A)-乙腈(B),梯度洗脱程序:0~10 min,0~95% B;10~12 min,95%~5% B;体积流量0.3 mL/min;进样量2 μL。对于质谱条件,离子化方式采用电喷雾离子化(ESI)(负离子模式);检测电压3.5 kV;雾化气N2体积流量1.5 L/min;干燥气N2体积流量5 L/min;曲型脱溶剂装置(CDL)温度250oC;加热块温度200oC。选择性离子监测(SIM)各人参皂苷的[M+Cl]-或者[M-H]-的准分子离子峰。
1.7 标准品的制备 人参皂苷对照品溶液制备:分别精密称取人参皂苷Rh1、Rf、Re、Rb1和Rc 1.0 mg置于量瓶中,然后加入甲醇溶解并定容至1 mL,制成质量浓度为1 mg/mL的母液对照品溶液,于-20oC保存。内标溶液的配制:精密称取1 mg地高辛置于量瓶中,然后加入甲醇溶解并定容至1 mL,制成1 mg/mL的母液内标溶液,于-20oC保存。
1.8 含药血浆的制备 将18只雄性SD大鼠随机分成花旗参组、花旗参饮片组和空白组,按大鼠体重计算给药量,隔夜禁食后,前两组分别给予花旗参茶以及水泡花旗参饮片溶液,用生药浓度75 mg/kg灌胃,灌胃体积为0.1 mL/kg,空白组灌胃纯净水。然后分别于10、20、30、45 min及1、2、4、6、8、12、24、48、72 h眼底静脉丛取血,置于含有肝素钠的EP管中,每次0.15 mL,1 500 g,离心5 min,取上层血浆,于-80oC保存待用。
1.9 血浆样品的处理 取50 μL血浆,加入1 mg/mL地高辛溶液(内标)5 μL,震荡30 s,加入1 mL甲醇,震荡3 min,13 600 g离心3次,吸取上清液0.8 mL,置于45oC离心浓缩装置氮吹仪40oC吹干;100 μL甲醇溶解样品,过0.22 μm滤膜后,2 μL进样分析。
1.10 方法学考察
1.10.1 专属性考察 取空白血浆和加入人参皂苷单体标准品及地高辛的血浆各50 μL,按1.5.6项血浆样品处理方法处理,并按照1.5.2项色谱条件和1.5.3项质谱条件进样分析,然后根据各人参皂苷单体标准品和内标的相对分子量提取离子色谱(EIC,Extract ion chromatograpy)图,通过比对空白血浆及含有标准品及内标的EIC图,判断方法专属性。
1.10.2 线性关系和定量限考察 取大鼠空白血浆50 μL,加入不同量的混合对照品溶液,质量浓度分别为0.2、1、5、12.5、25 mg/L,按1.5.6项血浆样品处理方法处理,并按照1.5.2项色谱条件和1.5.3项质谱条件进样分析。记录各对照品和内标的峰面积,以对照品质量浓度(X)与对照品和内标峰面积比值(Y)作线性回归,以信噪比S/N > 10的最低浓度作为定量限。
2 结果
2.1 专属性考察 大鼠空白血浆、空白血浆+混合对照品溶液及内标溶液样品的色谱图见图1。人参皂苷Rh1、Rf、Re、Rc、Rb1和内标地高辛在空白血浆中的保留时间分别为4.841、4.352、3.555、4.613、4.503、4.434 min,不加标准品和内标的空白血样无色谱峰。在本试验条件下,人参茎叶总皂苷中5种人参皂苷成分与内标地高辛均有良好的分离度,血浆中杂质不干扰目标化合物的测定,表明方法专属性良好。

A:空白血浆;B:空白血浆+混合对照品溶液及内标溶液。
2.2 线性关系考察 5种人参皂苷成分在0.2~25 mg/L质量浓度与峰面积比线性关系良好。空白重复进样10次以上,测量的信噪比S/N值标准偏差的10倍作为最低定量限,最低定量限在0.2 mg/L。以对照品质量浓度为横坐标(X),对照品和内标峰面积比值为纵坐标(Y)进行线性回归,结果见表1。

表1 人参中5个指标成分的线性关系和最低定量限
2.3 药物动力学试验结果 基于本研究建立的方法对分别给予花旗参茶和水泡花旗参饮片的大鼠后不同时间点的血浆样品进行测定,各人参皂苷单体的血药浓度-时间曲线见图2。由图2的结果可得,12个不同监测时间点花旗参茶处理组大鼠血浆中的人参皂苷单体Rh1、Rf、Re、Rc和Rb1的血药浓度(包括最高血药浓度)均比花旗参饮片处理组的血药浓度高。

A:水泡花旗参饮片和花旗参茶Rc的血药浓度对比;B:水泡花旗参饮片和花旗参茶Re的血药浓度对比;C:水泡花旗参饮片和花旗参茶Rf的血药浓度对比;D:水泡花旗参饮片和花旗参茶Rb1的血药浓度对比;E:水泡花旗参饮片和花旗参茶Rh1的血药浓度对比;如果以上样品的监测浓度超出线性范围外,本实验采用甲醇稀释相应的倍数后进行上样检测。
血药浓度-时间数据通过Winnonlin软件拟合出大鼠给药后非房室模型的药代动力学参数,结果如表2所示。花旗参茶经灌胃给药后,大鼠血浆中Rh1、Rf、Re、Rc、Rb1血药浓度时间曲线下面积(AUC0-t)分别为(857.56±127.01)、(252.75±37.54)、(274.34±41.67)、(380.03±103.84)、(232.88±74.10)mg/h·L;;血药浓度的峰值(Cmax)分别为(109.88±26.79)、(31.18±5.49)、(47.49±8.67)、(42.35±7.26)、(39.74±6.41)mg/L;血药浓度达到峰值所需的时间(Tmax)分别为(1.00±0.17)、(1.00±0.27)、(1.00±0.24)、(0.75±0.23)、(1.00±0.17)h;半衰期(T1/2)分别为(39.83±7.41)、(78.02±22.04)、(123.71±54.17)、(143.85±48.53)、(62.12±24.07)h;在大鼠体内停留时间(MRT)分别为(23.44±1.37)、(27.69±1.94)、(29.38±2.51)、(33.07±3.58)、(30.15±10.17)h。而水泡花旗参饮片经灌胃口服后,大鼠血液内大鼠血浆中Rh1、Rf、Re、Rc、Rb1血药浓度时间曲线下面积(AUC0-t)分别为(119.17±9.80)、(26.03±2.92)、(10.91±1.98)、(25.47±1.80)、(27.85±3.00)mg/h·L;血药浓度的峰值(Cmax)分别为(11.66±1.44)、(1.99±0.45)、(1.17±0.12)、(0.99±0.23)、(0.99±0.28)mg/L;血药浓度达到峰值所需的时间(Tmax)分别为(3.33±1.15)、(3.33±1.15)、(2.00±0.35)、(1.00±0.13)、(1.67±0.58)h;半衰期(T1/2)分别为(34.61±4.98)、(50.79±17.50)、(60.78±23.18)、(41.65±9.14)、(31.47±21.60)h;在大鼠体内停留时间(MRT)分别为(21.87±0.48)、(22.75±1.88)、(24.69±2.14)、(29.26±0.29)、(23.72±1.96)h。花旗参茶组各皂苷的药-时曲线下面积和血药浓度的峰值均大于水泡花旗参饮片组。各皂苷在大鼠体内驻留时间和半衰期都较水泡花旗参饮片组有明显的增加,并能够在更短的时间内达到更高的血药浓度。药代动力学试验结果表明大鼠对花旗参茶中人参皂苷的吸收和代谢明显优于水泡花旗参饮片。
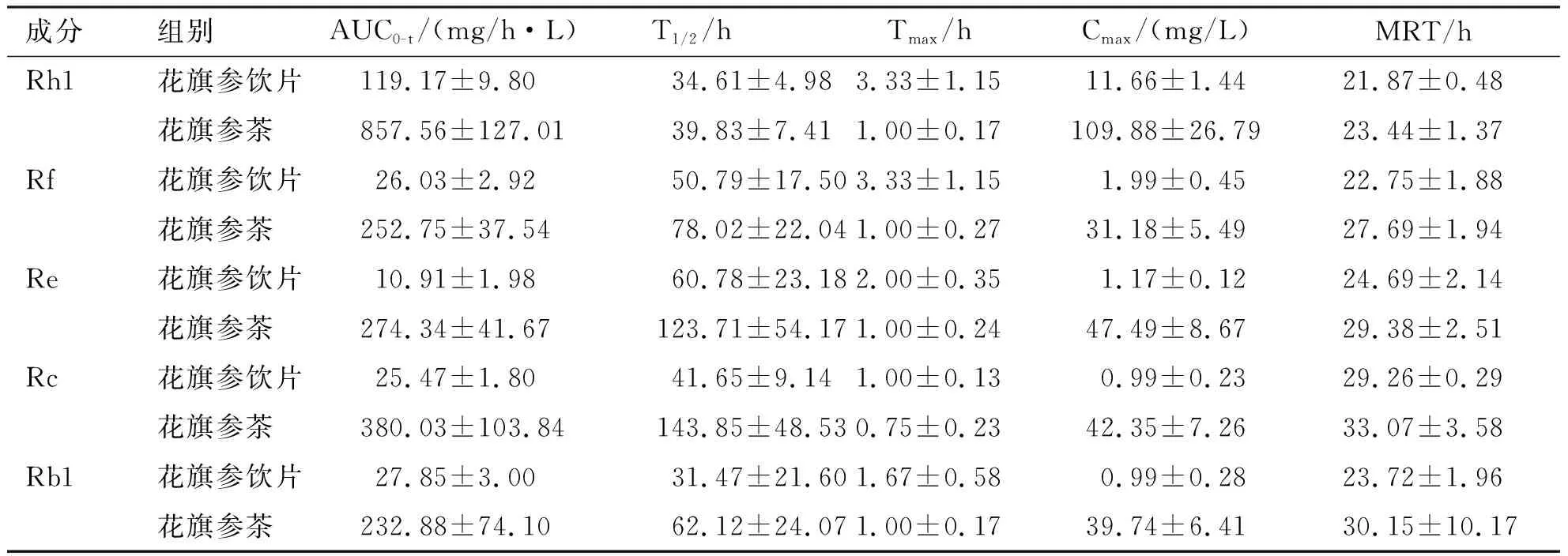
表2 水泡花旗参饮片和花旗参茶的药代动力学参数对比
3 讨论
花旗参的主要活性成分为人参皂苷类化合物,根部中多达几十种。人参皂苷的药理活性,特别是在免疫调节方面的重要作用一直是国内外专家和学者研究的热点[12]。有研究发现,人参皂苷Re能够通过巨噬细胞Toll样受体4(TLR4)途径来表现出免疫调节活性[13]。人参皂苷Rc能够抑制靶向结合激酶1(TBK1)并且对下游信号通路进行调节来减轻炎症反应[14]。人参皂苷Rh1可以显著降低IF-4、IF-5的合成,有效减轻哮喘的炎症反应[15]。然而有研究表明,人参皂苷体内生物利用度较低,难以更好发挥其疗效[16]。因此,研发具有缓释长效、生物利用度高的人参皂苷新剂型具有十分重要的临床意义。
本研究将花旗参通过醇溶剂提取后,使人参总皂苷能够充分提取,单体皂苷成分完全溶解,易被人体吸收,对今后研发人参皂苷新剂型的产品研发具有重要的参考价值。采用LC-MS的检测方法,经花旗参茶和花旗参饮片灌胃干预大鼠后,测定血浆中人参皂苷Rh1、Rf、Re、Rc、Rb1的含量,并通过药代动力学研究花旗参在大鼠体内的代谢。试验结果(见图2、表2)显示,与泡水花旗参饮片组相比,花旗参茶组的血浆中人参皂苷Rh1、Rf、Re、Rc、Rb1达到最高血药浓度的时间更短,达到的最高血药浓度更高,有效成分的血药浓度在相同时间消除率更低,表明花旗参茶有效总皂苷成分更容易被大鼠吸收进入体内,并且在大鼠体内维持的时间更久,有更好的生物利用度。因此,花旗参茶的制备工艺,能提高药材资源的利用率,对实现药材资源的充分利用具有重要的现实意义。
