米曲霉产米黑根毛霉脂肪酶高通量筛选方法的建立
2022-08-29熊志岳郭元昕田锡炜
熊志岳, 许 逗, 郭元昕, 田锡炜, 储 炬
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
米黑根毛霉脂肪酶(RML)是一种α/β型脂肪酶,具有Ser-Asp-His 催化三联体结构[1],不仅可以催化酯类底物水解,还能催化酯合成、酯交换等反应,如合成“结构脂”[2]、丁酸丁酯[3]等。RML 在化妆品、洗涤剂、污染治理、生物柴油、表面活性剂等行业有着广泛应用[4-7]。由于天然米黑根毛霉的RML 分泌量很低,难以满足工业应用需求,而且RML 的外源表达系统多采用巴斯德毕赤酵母(Pichia pastoris),因而无法应用于食品工业。米曲霉(Aspergilus oryzae,简称A. oryzae)因其强大的蛋白分泌和翻译后修饰能力,被广泛用于外源蛋白的表达[8],并且米曲霉是美国食品药品监督管理局(FDA)认证的GRAS 安全菌株,利用米曲霉表达RML 具有巨大的应用潜力。
高产菌株是实现高效生产的基础。高通量筛选技术已经广泛用于工业高性能菌株的选育过程中,能够大大提高菌株的筛选效率[9-10]。高通量培养方法以及产物高通量检测方法是菌种高通量筛选模型中最为关键的两个部分。微孔板(MTP)因其较小的装液量和高平行通量,成为菌种高通量培养的优良平台[11]。微孔板形状可分为圆底和方底,并且有96 孔、48 孔和24 孔等规格,可以根据培养菌种的代谢特性,比如氧气需求、菌体形态、耐剪切水平等进行相应的选择。
对于米曲霉的培养来说,由于米曲霉高耗氧的代谢特点,一般选择24-MTPs 作为高通量的培养装置。另一方面,高通量的检测方法常通过颜色反应、荧光检测等来实现。常用的脂肪酶活力定量测定方法主要有碱滴定法、皂铜法以及对硝基苯酚法。其中碱滴定法需要使用高压匀浆机对底物三酰甘油乳化后才能进行滴定,整个过程操作要求高、时间长,因此难以应用于脂肪酶的高通量测定[12~13]。皂铜法虽然是通过显色反应来进行脂肪酶酶活的测定,但是在操作过程中会把大量有机溶剂苯用于萃取剂[14],效率不高并且存在安全隐患,因此不适用于高通量快速检测[15]。对硝基苯酚法也是通过显色反应来实现脂肪酶酶活的检测,而且测定环节相对简单、快速、灵敏,是应用较多的一种方法。此外,Wang 等[16]提出一种双指示剂法,以橄榄油为底物,经脂肪酶水解后生成游离的脂肪酸,脂肪酸与CaCl2反应生成钙盐沉淀(皂化反应)和盐酸,然后通过溴麝香草酚蓝和苯酚红两种pH 指示剂进行显色,并在630 nm 处有最大的吸收峰。此方法原理简单、可操作性强,能够较好地应用于高通量测定。
本文通过优化基于双指示剂法的RML 高通量检测方法,并且开发24-MTPs 米曲霉高通量培养方法,建立基于孔板培养的米曲霉产RML 高通量筛选模型。最后,采用常压常温等离子体诱变技术(ARTP)对现有生产RML 的米曲霉菌株进行诱变,经过高通量筛选后获得高产菌株。
1 材料和方法
1.1 菌株和试剂
1.1.1 菌株 米曲霉,由国家生化工程技术研究中心(上海)保藏。
1.1.2 试剂的配制 5 mmol/L Tris-HCl 缓冲液(pH=8.5):称取0.605 g Tris 溶于1 L 纯净水中,用3 mol/L浓盐酸调节pH 至8.5;双指示剂溶液:分别称取0.025 g溴麝香草酚蓝和酚红溶解于50 mL、5 mmol/L、pH8.5的Tris-HCl 缓冲液;100 mmol/L 氯化钙溶液:称取1.11 g氯化钙溶解于100 mL、5 mmol/L、pH8.5 的Tris-HCl缓冲液;底物:将橄榄油与二甲基甲酰胺按照体积比为1∶6 配制(现配现用)。
1.1.3 培养基 孔板初筛培养基与摇瓶复筛培养基(g/L):玉米糊精20,玉米浆干粉10,酵母粉10,泡敌粉1, KH2PO41.244, MgSO4·7H2O 0.249, Na2HPO4·12H2O 6。孔板固态斜面培养基(PDA 培养基,g/L):马铃薯200,葡萄糖20,琼脂15。摇瓶验证培养基(g/L):玉米糊精50,大豆蛋白胨30,酵母粉4,泡 敌 粉1,KH2PO41.12,MgSO4·7H2O 0.227,Na2HPO4·12H2O 5.33。
1.1.4 主要仪器与器材 恒温培养振荡器(上海智城分析仪器有限公司,ZWY-2102C 型)、酶标仪(Thermo 公司,MultiSKAN MK3 型)、常压常温等离子体诱变仪(北京思清源生物技术公司,ARTP-II S 型)、24-MTPs(上海甘薇生物科技有限公司,P2410 型)。
1.2 实验方法
1.2.1 米曲霉孢子悬浮液制备 取活化好的成熟单菌落平板(培养约7 d),用孢子铲刮下菌丝,每个平板用10 mL 无菌水洗下孢子,用玻璃珠打散后过滤得到孢子悬浮液,用血球计数板计数。
1.2.2 ARTP 诱变时间的确定 采用氦气为工作气体,功率为120 W,气流量为10 L/min,将孢子悬液稀释至合适浓度后(保证0 s 时培养皿生长约50 个菌落),选择不同的处理时间(0,30,60,70,80,85,90,95,100,110 s)对孢子进行ARTP 诱变,每个时间梯度分别取100 μL 涂布于固体平板,培养到肉眼可见的菌落后计数并计算致死率(RLethality)。致死率计算公式如下:
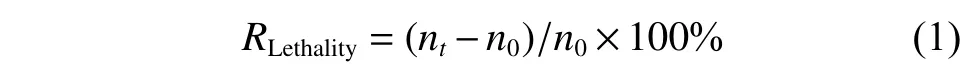
其中:n0表示初始菌落数;nt表示诱变ts 时的菌落数。
1.2.3 高通量孔板初筛方法的建立 采用24-MTPs对米曲霉进行初筛,并对培养条件进行如下优化:通过添加1、2、3 颗直径5 mm 玻璃珠来形成不同的剪切环境;发酵初始pH分别为3、4、5、6,装液量(mL)分别为1.2、1.4、1.6、1.8、2.0,培养基质量分数分别为30%、50%、70%。
确定米曲霉生长条件后,经由ARTP 诱变,将诱变完的孢子悬液直接接入灭菌的24-MTPs,每孔20 μL,(保证每孔含有约30~40 个孢子),装液量为2.0 mL,并在28 ℃,150 r/min 条件下培养4 d。
1.2.4 RML 酶活的高通量检测 初筛培养4 d 后,孔板中每孔吸取50 μL 的上清液,稀释适当的倍数,剩余样品放入4 ℃冰箱中保存备用。将20 μL 双指示剂,80 μL CaCl2溶液加入96 孔酶标板后,再加入现场配好的橄榄油底物。放入孔板振荡培养箱中37 ℃预热5 min,再迅速加入稀释好的酶液20 μL,反应15 min,迅速放入酶标仪中,在630 nm 处测量吸光度。标准曲线测量方法与之相同。利用不同稀释浓度的RML绘制标准曲线,并计算得出样品的相对酶活。
1.2.5 孔板固态培养 孔板固态斜面培养基制作方法:将配制好的液态PDA 培养基(含1.8%(g/mL)琼脂)加入24 孔孔板中,每孔2 mL,包好后放入灭菌锅灭菌,灭菌结束后立即取出,倾斜放置,冷却后即为固态斜面。将初筛中高于对照菌株20%以上的菌株从孔中取出约50 μL,涂布于PDA 培养基上,28 ℃培养24 h,挑选长势良好的单菌落6 株,点种于24-MTPs固态培养基上,继续培养3~4 d 长出孢子后,用孢子铲刮下菌丝放入3 mL 体积分数为20%的甘油中保存。
1.2.6 摇瓶复筛培养 将初筛得到的高产诱变菌株的孢子进行摇瓶培养。采用250 mL 摇瓶,装液量50 mL,接种孢子悬液400 μL,放入摇床于28 ℃、150 r/min条件下培养4 d,发酵液过滤后稀释,然后用碱性磷酸酶检测试剂(p-NPP)法测量酶活。
1.2.7 摇瓶验证培养 将复筛得到的诱变菌株活化制备孢子悬液,然后将300 μL 孢子悬液接入摇瓶复筛培养基中,于28 ℃、150 r/min 条件下培养约28 h,采用250 mL摇瓶,装液量50 mL;然后以10%的接种量接入摇瓶验证培养基中于28 ℃、200 r/min 条件下培养5 d,过滤取上清,稀释适当的倍数,利用p-NPP法测量酶活。
2 结果与讨论
2.1 RML 高通量检测方法建立
双指示剂法是利用氯化钙将三酰甘油水解产生的脂肪酸转化为易于释放的盐酸,经由pH 指示剂显色后,使用酶标仪在630 nm 处检测吸光度。但是在实际应用中受到不同发酵体系、检测环境、数据处理方法等影响,因此需要对操作条件进行优化。
相同样品多次测量时会有不同的吸光度,这可能是由于HCl-Tris 缓冲液的温度效应引起的,4 ℃时缓冲液的pH 为8.4,而37 ℃时pH 为7.4,从而造成测量的误差,因此检测过程中应该严格控制温度。此外,在反应体系配制完全,放入振荡仪中37 ℃预热时发现,在不添加脂肪酶的条件下,预热时间对样品吸光度也有很大的影响(图1)。
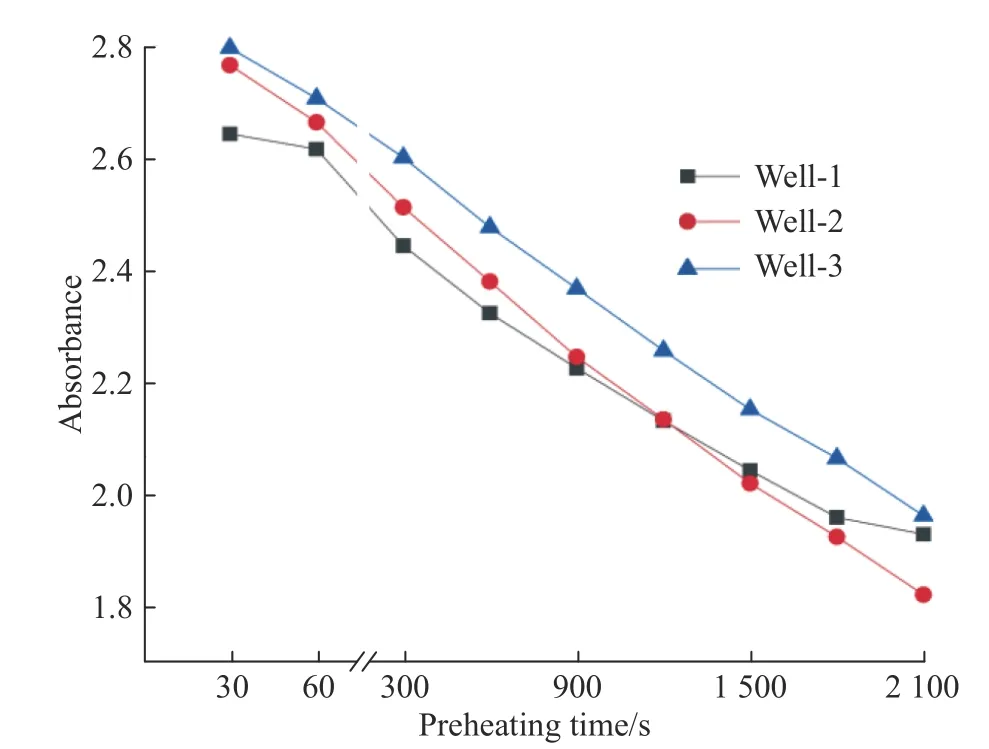
图1 孔板中不同孔的吸光度随预热时间的变化Fig. 1 Variation of absorbance of different wells in the plate with preheating time
由图1 可以看出,在未添加脂肪酶的情况下,随着预热时间的增加,酶标板中孔1、2、3 的吸光度均有所降低。因此在反应过程中,必须对反应体系预热后再加入RML 进行反应,并且反应时间需严格把控。
脂肪酶反应中最核心的问题是底物为油脂,不溶于水,需要将油脂底物用乳化剂乳化形成均一、分散的体系后才能进行反应。双指示剂法采用二甲基甲酰胺乳化剂,在橄榄油与二甲基甲酰胺混合后,用旋涡振荡仪将其混匀。但是静置20~30 min 后混合液会逐渐分层,因此反应必须在振荡条件下进行,预热和反应时间需要控制在20 min 以内。考虑到显色范围和底物稳定性,后续实验中将预热时间和反应时间分别设置为5 min 和15 min。
此外,在加入双指示剂、氯化钙溶液和底物之后,初始颜色并不一致。图2 示出了孔板中不同孔初始吸光度的差异。如图2 所示,不同孔之间的初始吸光度有所差别,最高差值可达到0.2。究其原因是因为橄榄油底物与二甲基甲酰胺悬浊液不太稳定,加入反应体系之后导致pH 不一致,使得颜色出现差异,进而使得反应后测得的标准曲线精度不高,R2只能达到0.979 7(图3(a)),因此需要消除不同孔间吸光度差异的影响。
在加入双指示剂、氯化钙溶液、底物并且预热5 min 之后,迅速将酶标板放入预热好的酶标仪中并读数,得到初始吸光度,然后用8 孔道移液枪迅速添加20 μL 稀释好的RML 样品,反应15 min 后再次迅速测量每孔吸光度,利用两次吸光度的差值进行计算,消除空白差异,这样得到的标准曲线不仅斜率为正,而且R2能提高到0.990 3,从而显著提高方法的准确性(图3(b))。
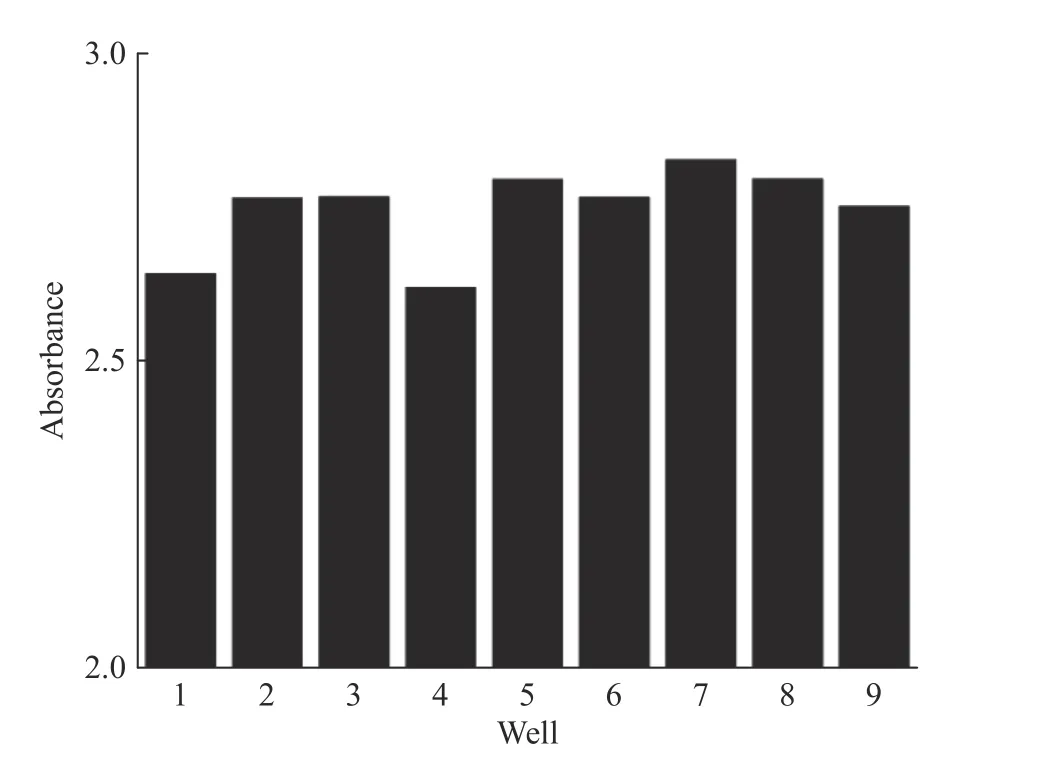
图2 孔板中不同孔初始吸光度的差异Fig. 2 Difference of initial absorbance of different wells in the plate
为了保证测定的稳定性与操作的简便性,摇瓶实验中所有的酶活均采用p-NPP 法进行测定,而24-MTPs 中采用双指示剂法检测RML 的酶活,故需比较这两种方法的一致性。表1 所示为4 株突变株与原始菌株在24-MTPs 中培养4 d 后,分别用p-NPP 法和双指示剂法测定的酶活值,表明突变菌株酶活均比原始菌株酶活高,而且酶活的高低趋势基本一致,计算得Pearson 相关系数达到0.919 5,表明在高通量筛选中,优化的双指示剂法可以作为初筛的酶活检测方法。
2.2 米曲霉24-MTPs 高通量初筛培养方法的建立
米曲霉因其高耗氧的代谢特性,因此采用方孔孔板能提供更高的氧传递效率。米曲霉菌丝生长特别旺盛,在利用24 孔方孔板、装液量2 mL 进行培养时,孔板中会形成致密的菌丝体,而且发酵液体积减少严重(图4),这样的生长状态不宜进行筛选。因此,考虑从控制生长和增大剪切两个方面对其进行优化。一方面,适当地降低培养基浓度和初始pH 可以有效控制菌丝生长;另一方面,培养基装液量会引起供氧水平的差异,从而影响产物合成。玻璃珠的添加可以增大剪切力,同时也能提高供氧水平。
由图4 可以看到,当pH 为5 时,米曲霉在孔板里会形成一个巨大的“菌球”,虽然生长状态较优化前有所改善,但是菌球内部仍很难摄取到养分与氧气。而当装液量为1.6 mL 和培养基浓度调整为初始浓度的一半时,可以看到生长情况改善明显,但形成的“菌球”仍然较大。进一步添加玻璃珠从而增大剪切力,可以看到2 颗玻璃珠能显著改善米曲霉的生长状态,此时会形成均匀而细小的菌球,菌丝膜也明显减少,这与摇瓶培养的米曲霉生长状态类似,能够很好地保证氧气与营养的传递。因此,在后续的实验中,装液量和初始pH 仍选择优化前的2 mL 和6,并通过加入2 颗玻璃珠来进行米曲霉的高通量初筛培养。
在ARTP 诱变完成后,采用混合体培养[17]的方法来进行初筛。为了避免米曲霉菌丝生长不均匀导致的差异,采用一步法发酵,不仅操作简化并且降低了染菌风险。接种时保持每孔接种30~40 个孢子,从而避免了孢子数量过少会导致突变库不足,而孢子数量过大会使混合体难以挑出真正的高产菌株的问题[17]。

表1 双指示剂法与p-NPP 法测量一致性的比较Table 1 Comparison of double indicator method and p-NPP method on measuring consistency
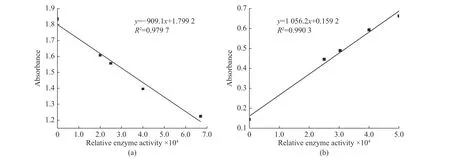
图3 不同计算方式下标准曲线的差异:(a)利用反应15 min 后的吸光度绘制;(b)利用预热5 min 后与反应15 min 后的吸光度差值绘制Fig. 3 Difference of standard curve under different calculation methods: (a) The standard curve drawn by absorbance after reaction for 15 min; (b) The standard curve drawn by absorbance difference between preheating 5 min and reaction 15 min

图4 不同培养条件下米曲霉24 孔孔板生长情况对比Fig. 4 Comparison of the growth of 24-well plates of A. oryzae under different culture conditions
2.3 米曲霉产RML 高通量筛选
按1.2.2 节中所用方法进行诱变,致死率结果如图5 所示。当致死率在90%以上时菌株产生正突变的概率相对较高[18-20],并且在此致死率下回复突变的概率更小。从图5 可以看到,随着诱变时间的增加致死率逐渐增高,在诱变时间为90 s 时,菌株致死率达到了95%,因此,选择90 s 作为ARTP 的诱变时间。
初筛过程共筛选了1 200 孔,每孔30~40 个孢子,部分初筛结果如图6 所示。发酵4 d 后利用双指示剂法检测,获得比原始菌株酶活高出20%以上的孔,再吸取每孔约50 μL 发酵液涂布平板,挑出长势良好的6 个单菌落接入固体孔板中培养,产孢后保种并进行复筛。
将每一轮得到的高产菌株孢子400 μL 接入250 mL摇瓶进行复筛,培养4 d 后利用p-NPP 法测量酶活。经过第1 轮复筛,得到约14 株高产菌株,对这14 株菌进行了第2 轮复筛,结果如图7 所示。
从图7 可以看出,第2 轮复筛获得4 株酶活显著高于原始菌株的诱变菌株,分别命名为Ⅰ7-D6-7(96.72 U/mL),Ⅱ4-4B-5(117.86 U/mL),Ⅲ3-5C-1(107.59 U/mL),Ⅴ7-6C-3(99.96 U/mL),相较于出发菌株(80.47 U/mL),其酶活分别高出20.19%,46.46%,33.70%,24.22%。
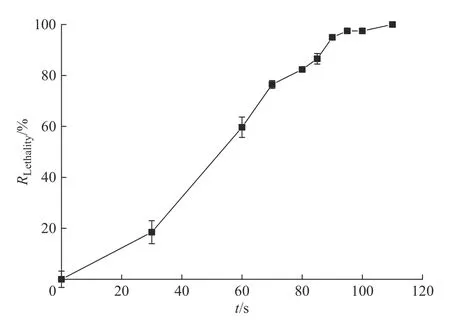
图5 米曲霉的ARTP 致死率曲线Fig. 5 Lethality rate curve of A. oryzae by ARTP
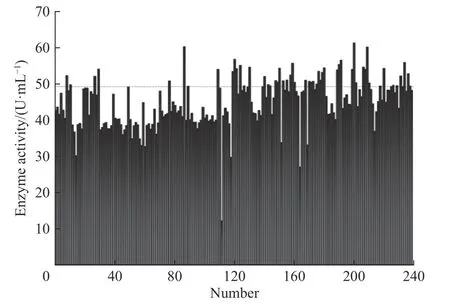
图6 部分突变株初步筛选结果(红线为出发菌株酶活)Fig. 6 Preliminary screening results of some mutant strains(Red line is the lipase activity of the original strain)

图7 第2 轮复筛结果Fig. 7 Results of the second round of re-screening

图8 突变株摇瓶验证Fig. 8 Shaking flask verification of mutant strains
进一步将4 株高产突变菌与出发菌株接入摇瓶进行验证,如图8 所示,突变株Ⅰ7-D6-7、Ⅱ4-4B-5、Ⅲ3-5C-1、Ⅴ7-6C-3 的酶活分别达到了265.98、240.90、253.52、293.50 U/mL,比出发菌株(176.52 U/mL)分别提高了50.68%、36.47%、43.61%、66.27%。
3 结束语
本文通过双指示剂法对检测RML 酶活的高通量方法进行了系统优化,从而有效提高了检测的可靠性和精度。此外,以24-MTPs 作为载体,通过优化培养条件,成功建立米曲霉高通量培养体系。在上述高通量培养和检测的基础上,对ARTP 诱变后的1 200孔(36 000~48 000 个孢子)进行高通量筛选,最终获得4 株高产突变菌株,其中突变株Ⅴ7-6C-3 酶活达到293.50 U/mL,比出发菌株(176.52 U/mL)的酶活提高了66.27%。文献报道中鲜有利用米曲霉表达RML 的研究,王斌等[21]在米曲霉中成功表达了RML,碱滴定法测得发酵上清液酶活为2.5 U/mL,远低于本文所得到的RML 酶活。
本文建立了米曲霉产RML 高通量筛选体系,大大提高了菌株的筛选效率,同时筛选获得的高产菌株能够作为工业化应用的储备菌株。
