喹啉腈荧光微球构建及在荧光免疫层析中对SAA 的检测应用
2022-08-29徐建新郭志前
李 强, 徐建新, 郭志前
(1. 上海奥普生物医药股份有限公司, 上海即时检测医学工程技术研究中心, 上海 200201;2. 华东理工大学化学与分子工程学院, 精细化工研究所, 上海 200237)
聚集诱导发光(Aggregation-Induced Emission,AIE)材料是近年来新兴的热点研究领域,因其具备独特的聚集态发光性质而倍受关注。传统发光材料多受到“浓度猝灭(Aggregation-Caused Quenching,ACQ)”效应的制约,其分子在高浓度下表现出明显的荧光猝灭性质;相比之下,AIE 荧光材料在稀溶液中的分子态下几乎不发光,而当其处于分子聚集态时表现出显著的荧光增强效应[1-3]。AIE 材料具有发光效率高且光稳定性强的特性,因而能在细胞成像及相关生物成像中应用,获得更好的图像分辨率,特别是在高浓度态或聚集态下,AIE 材料表现出更高的灵敏度,并且能通过化学修饰来实现发光波长的调控等[4-6]。AIE 荧光材料的设计及应用等基础研究得到了广泛的关注。
目前,AIE 荧光材料在荧光探针、生物成像、诊断以及治疗等领域具有广泛的应用前景[7-8]。AIE 荧光材料应用于检测的生物分子包括氨基酸、糖类、DNA/RNA、蛋白质、肽等;应用于监测的生物过程有蛋白纤维颤动、细胞凋亡、成骨分化、自噬/有丝分裂等;此外,还可应用于特定细胞器、细胞、微生物、组织甚至动物的成像等方面[9-12]。
由病原菌和病毒等引起的传染病感染,通常是指细菌、病毒、真菌、寄生虫等病原体侵入人体所引起的局部组织和全身性的炎症反应,一直是全球公共卫生关注的重要焦点问题,并且往往伴随着较高的死亡率[13-14]。如何快速、准确地鉴别细菌或者病毒感染的类型是临床医学诊断中面临的最大困难和挑战之一,尽管它们在临床症状表现上缺乏特异性,但在临床用药上却存在显著的差异。传统的感染诊断方法包括红细胞沉降率、病原培养、白细胞计数和聚合酶链反应等[15-18],但这些方法受到检测时间长、样品预处理过程复杂、设备昂贵或技术人员操作水平低等制约,无法满足临床即时检测POCT(Point-of-Care Testing)的需求,从而无法实现快速、便捷、高效的诊断。
血清淀粉样蛋白A(Serum Amyloid A,SAA)[19-21]是一种由肝细胞产生后被分泌到血清中的一种急性时相蛋白,当机体发生感染或损伤时,其浓度可在4~6 h 内迅速升高约1 000 倍,当机体抗原清除后则迅速降低回复至正常水平。目前,临床对于炎症检测的研究主要集中在炎性疾病急性反应期间的SAA类型[22],亦有专家学者发现SAA 异常可以作为新冠患者病症诊断的一个重要指标[23]。临床诊断中SAA具有如下显著特点:(1)SAA 作为急性时相反应蛋白之一,临床上可用于监测急性期反应,是反映机体感染情况和炎症恢复情况的重要灵敏指标之一,已有研究表明在新冠患者中SAA 的变化表现较为明显;(2)与目前临床广泛使用的炎症指标CRP(C-Reactive Protein)相比较,SAA 的升高见于病毒、支原体感染,且其敏感性高于CRP; CRP 升高多见于细菌感染,但对病毒及支原体等病原体感染因其浓度变化幅度小而敏感性较低[24-25],因而SAA 与CRP 的联合检测可以互补应用,能够更有效地提高感染性疾病的检出率。因此,快速、准确地检测到SAA 的含量,可以为医护人员对病患进行有效诊断、评估、监控及治疗提供更敏感的诊断依据。
目前体外快速检测SAA 的方法主要分为金标法、胶乳免疫比浊法、荧光免疫层析法、化学发光法等[26-28]。荧光检测技术[29-30]因其操作简单、灵敏度高、方便携带、可家用等优点受到广泛关注。本文采用溶胀包埋的方法,制备了基于喹啉腈(QM)[31-32]荧光染料衍生物QM-OH 的AIE 荧光微球QM-OH@PS-COOH(羧基聚苯乙烯),发展了基于荧光免疫层析的检测技术,实现了对临床样本中SAA 的定性、定量灵敏检测,以及对病毒感染患者的体外快速诊断。
1 实验部分
1.1 主要材料
实验所用的SAA 标记抗体、涂层抗体均购自莫迪斯公司,SAA 抗原购自上海普欣生物技术有限公司。过硫酸钾、苯乙烯、甲基丙烯酸、四氢呋喃(THF)、十二烷基苯磺酸钠、多聚磷酸钠、硝酸,N-羟基硫代琥珀酰亚胺(NHS),均为分析纯,购自上海泰坦科技股份有限公司;SAA 检测试剂卡购自上海奥普生物医药股份有限公司。
1.2 测试与表征
核磁共振氢谱和碳谱的测定采用德国Bruker公司的超导傅里叶变换核磁共振波谱仪(Bruker AvanceIII 400 MHz),以四甲基硅烷 (TMS,摩尔分数0.03%) 为内标溶剂测定,并以氘代二甲基亚砜(DMSOd6)为溶剂;质谱测试为美国沃特世公司的质谱分析仪(Waters LCT Premier XE);紫外-可见光光谱采用美国安捷伦公司的紫外-可见光吸收光谱仪器(Agilent Cary 60)进行测定。荧光光谱采用日本Horiba 公司荧光光谱仪(Floromax-4 Spectrofluorometer)进行检测;粒度大小采用Malvern 公司粒径仪(Zetasizer Nano S90)进行检测;电导率(G)采用上海雷磁公司的电导率仪(DDS-307A)检测;试剂卡采用上海奥普生物医药股份有限公司MAYA 免疫荧光定量分析仪(MAYA-500)开展检测研究。
1.3 实验方法
1.3.1 喹啉腈衍生物QM-OH 的合成 QM-OH 的具体合成方法参照文献[31]。
1.3.2 荧光微球QM-OH@PS-COOH 的合成 在500 mL 烧杯中,分别加入十二烷基苯磺酸钠0.4 g、过硫酸钾0.25 g 和多聚磷酸钠0.25 g,然后再加入250 mL 超纯水,混合均匀至溶解。将上述溶液倒入500 mL 三颈瓶中(水浴预先加热到85 ℃),在搅拌(300 r/min)和通氮气情况下逐滴加入25 mL 苯乙烯,滴加完全30 min 后再逐滴加入甲基丙烯酸溶液1.5 mL,然后在水浴85 ℃加热搅拌和通氮气情况下持续反应6 h。当反应结束冷却后,用布氏漏斗抽滤,得到的滤液即为PS-COOH。在50 mL 圆底烧瓶中,加入四氢呋喃和水的混合溶液约25 mL,再加入PS-COOH 5 mL和QM-OH 50 mg,在60 ℃水浴中溶胀包埋6 h 后,得到AIE 荧光微球QM-OH@PS-COOH。
1.3.3 QM-OH@PS-COOH 微球羧基含量的测定在250 mL 的烧杯中,加入100 mL 超纯水,称取1 g荧光微球QM-OH@PS-COOH 分散于水相中,用NaOH 溶液调节pH 约为10。以0.2 mol/L 的稀硝酸溶液进行滴定,每次滴定加入20 μL 稀硝酸,记录溶液的电导率变化并作图计算得到QM-OH@PS-COOH荧光微球上的羧基含量。
1.3.4 QM-OH@PS-COOH 和标记抗体偶联储备液的制备 在10 mL 试管中分别加入超纯水1.3 mL、磷酸盐缓冲液(PBS)1 mL、荧光微球QM-OH@PSCOOH 1 mL、标记抗体1.4 mL,在室温下混和均匀15 min;然后加入1 mL 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)溶液(10 mg/mL),室温下继续混匀30 min;接着加入2 mL、0.03 g/mL 的牛血清蛋白(BSA)溶液进行封闭,室温下继续混匀30 min;离心除去上清液,向得到的固体中加入2 mL 荧光恢复液,并将其超声分散,得到单分散的QM-OH@PS-COOH和标记抗体偶联的荧光储备液。
1.3.5 QM-OH@PS-COOH 和标记抗体偶联的荧光储备液检测SAA 移取SAA 抗原5 μL 加入到1 mL 1.3.4 节制备的QM-OH@PS-COOH 和标记抗体偶联荧光储备液中,均匀混合1 min,然后滴加0.3 mL 到试纸卡上,放置1 min 后,再将试纸卡插入MAYA 荧光免疫定量分析仪进行读数。
2 结果与讨论
2.1 QM-OH 的核磁波谱及高分辨质谱表征
在100 mL 的圆底烧瓶中,分别加入QM(1.2 g,5.1 mmol)和4-羟基苯甲醛(671 mg,5.5 mmol),同时加入30 mL 乙腈溶解固体,磁力搅拌下滴加1 mL 哌啶,氩气保护下加热回流反应10 h。反应过程中,反应液逐渐由黄色变为橙红色。反应结束冷却至室温,观察到有大量的橙红色固体析出。用旋转蒸发仪浓缩有机相,并利用硅胶柱层析分离得到粗产品(硅胶200~300 目(48~74 μm),展开剂二氯甲烷和甲醇的体积比为20∶1),最终得到橘色固体对羟基喹啉腈(985 mg,2.9 mmol),产率 56.6%。1H-NMR(400 MHz, DMSO-d6,δ): 10.05 (s, 1H, -OH), 8.94 (d,J=8.8 Hz, 1H, phenyl-H), 8.10 (d,J= 9.2 Hz, 1H, phenyl-H), 7.92 (t,J= 7.6 Hz, 1H, phenyl-H), 7.69 (d,J= 8.4 Hz,2H, phenyl-H), 7.61 (t,J= 7.6 Hz, 1H, phenyl-H),7.39~7.29 (m, 2H, alkene-H), 7.02 (s, 1H, quinoline-H),6.87 (d,J= 8.4 Hz, 2H, phenyl-H), 4.56 (q,J= 6.8 Hz,2H, -CH2CH3), 1.40 (t,J= 8.0 Hz, 3H, -CH2CH3)。13CNMR (100 MHz, DMSO-d6,δ): 13.63, 24.63, 26.28,43.71, 46.24, 46.53, 106.42, 115.82, 116.58, 118.07,120.60, 124.85, 125.09, 126.04, 130.04, 133.60, 137.84,140.06, 149.68, 152.05, 159.80。 Mass spectrometry(ESI for [M + Na]+): Calcd. for C22H17N3ONa: 362.126 9;found: 362.126 8。
2.2 QM-OH 的紫外-荧光光谱图
激发波长(λex)为440 nm 下QM-OH 在水和THF混合体系中的紫外-荧光光谱图如图1 所示。在水和THF 的混合溶液中,QM-OH 的紫外吸收光谱在320~500 nm 之间有一组宽的双重吸收峰(吸收波长(λabs)为365 nm 和440 nm),随着混合溶剂中水体积分数(fw,0~95%)的不断增加,其双重吸收峰位置没有发生明显变化,相比之下其荧光光谱随着fw的增加而显著增强。当fw处于0~70%时,QM-OH 表现为明显的荧光淬灭效应;当fw> 70%时,其在550 nm处的荧光强度表现出显著的增强,并且伴随着fw的逐渐增大其荧光不断增强,当fw= 95%时,荧光强度达到最大值。这些结果表明分子QM-OH 本身具有明显的AIE 聚集诱导发光性质。
2.3 AIE 荧光微球QM-OH@PS-COOH 的结构表征和分析
首先由粒径仪测试得到AIE 荧光微球QM-OH@PS-COOH 的粒径约为100 nm 左右。然后利用扫描电子显微镜(SEM)对荧光微球QM-OH@PS-COOH进行结构表征,结果如图2 所示,该荧光微球呈现出规则的球状形貌。在体外诊断试剂中通常采用球形荧光微球作为修饰材料,通过微球表面修饰羧基后与抗体偶联达到最佳效果,有利于提升检测准确性。图2 插图是AIE 荧光微球QM-OH@PS-COOH的乳液图片,通过肉眼可以清晰地观察到该AIE 荧光微球是亮黄色的,其吸光度变化便于体外诊断过程中的定性判断。
2.4 AIE 荧光微球QM-OH@PS-COOH 的密度、固含量及羧基含量的测定

图1 λ ex =440 nm 下QM-OH 在水和THF 混合体系(不同水体积分数)中的紫外吸收光谱图(a)和荧光光谱图(b)Fig. 1 Ultraviolet absorption (a) and fluorescence (b) spectra of QM-OH in H2O/THF mixtures with different volume fractions of water (fw)under λex = 440 nm

图2 QM-OH@PS-COOH 的TEM 图(插图是QM-OH@PS-COOH 的乳液图片)Fig. 2 TEM image of QM-OH@PS-COOH (Illustrated by emulsion image of QM-OH@PS-COOH)
在干净的小称量杯(质量3.132 1 g)中,加入1 mL制备的荧光微球QM-OH@PS-COOH,称量得到两者总质量为4.135 1 g,然后放入70 ℃的烘箱中烘6 h,将水分烘干,称取质量为3.232 9 g。经计算,荧光微球QM-OH@PS-COOH 的密度为1.003 g/mL,固含量(质量分数)为10.08%。
根据文献[33],对合成的微球进行电导率滴定,具体操作见1.3.3 节。溶液的电导率随着稀硝酸溶液加入体积的不同呈现如图3 所示的变化。羧基含量(DC)的计算公式如下;
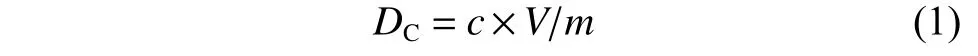
其中:c为滴定稀硝酸的浓度;V为所用稀硝酸的体积;m为滴定中微球的质量。
荧光微球的表面羧基密度(PA)计算公式为:

其中:ρ为该批次微球密度;d为微球粒径。
图3 中AB 段示出了过量碱滴定时的电导率变化;BC 段示出了对微球上羧基滴定引起的电导率变化;CD 段示出了过量的稀硝酸溶液引起的电导率变化。经计算,BC 段所用稀硝酸的物质的量为5.6×10-5mol,微球的羧基含量为0.056 meq/g,PA 值为177.3。
2.5 QM-OH@PS-COOH 在荧光免疫层析中对SAA 的检测
在对AIE 荧光微球QM-OH@PS-COOH 的结构进行表征后,将该AIE 荧光微球用于荧光免疫层析中,对病毒感染中产生的SAA 抗原进行一系列的相关检测,其原理如图4 所示。首先将QM-OH@PSCOOH 与SAA 标记抗体偶联,得到荧光标记抗体(荧光液);然后待测样本在流动相的作用下先与荧光标记抗体结合,并在硝酸纤维素(NC)膜的层析作用下到达检测线再与涂层抗体结合,形成双抗夹心的“三明治”型。检测线处的信号变化采用与设计配套的荧光仪器进行定量测定,其荧光强度变化与样品中SAA 质量浓度呈正相关。通过检测线上的荧光液和质控线进一步获取检测到的荧光信号,利用检测仪器放大信号,得到SAA 质量的具体数值,从而实现对病毒感染患者的体外快速诊断。
SAA 更适用于小儿感染性疾病的诊断,是病毒感染早期检测的灵敏指标。因此,对于病毒感染标志物SAA 来说,高灵敏度的检测至关重要。首先,使用AIE 荧光微球QM-OH@PS-COOH 标记的抗体荧光液对SAA 质控品进行定标,得到如表1 所示的数据。表中数据1 和数据2 分别是2 次的仪器荧光测试值,当SAA 测试值高于50 mg/L 时,适用于定标的A 线;反之,适用于定标的B 线。对应的A、B 定标曲线如图5 所示,由图可见,当SAA 质量浓度从0 升高到216 mg/L 时,荧光强度与质控品中SAA 质量浓度呈正相关,说明AIE 荧光微球QM-OH@PS-COOH 标记的抗体荧光液对SAA 质控品进行了有效定标,其中A 线相关系数为0.992 1,B 线的相关系数为0.984 0,体现了良好的线性关系。
SAA 是反映感染性疾病早期炎症的敏感指标,有助于炎症诊断、评估、监控及治疗。因此在对SAA 质控品进行有效定标后,使用AIE 荧光微球QM-OH@PS-COOH 标记的抗体荧光液对病毒感染的血液样本进行测试。10 份血液样本来自上海中医药大学附属龙华医院。所有的测试均在MAYA 荧光免疫定量分析仪和SAA 样板条上测定,如图6 所示。将使用AIE 荧光微球QM-OH@PS-COOH 标记的抗体荧光液测试的10 份血液样本的测试数值与龙华医院的测试数值进行了对比,结果如表2 所示。临床上,当SAA 质量浓度低于10 mg/L 时为正常水平;当SAA 质量浓度高于10 mg/L 时预示感染;当SAA质量浓度高于50 mg/L 时为阳性高值样本。由表2可知,有4 份阴性样本和6 份阳性样本,其中阳性样本有2 份阳性高值样本。该AIE 荧光微球标记的体系能够有效区分血液样本中的阴性和阳性样本,与龙华医院测试值一致。同时,该体系测试值与龙华医院的测试值偏差在±15%之内,符合测试要求。
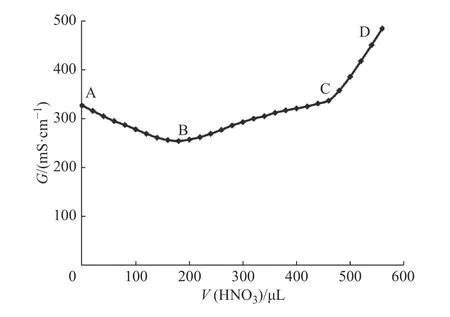
图3 QM-OH@PS-COOH 的表面羧基电导率滴定变化图Fig. 3 Surface carboxyl electric conductivity titration of QMOH@PS-COOH
SAA 样本条上有质控线(C 线)和检测线(T 线)两条。检测合格有效的样本条必须满足以下条件:(1)C 线处有颜色和荧光呈现;(2)阴性样本在T 线处无颜色且无荧光呈现,阳性样本在T 线处有颜色和荧光呈现。
如图6(b)所示,在日光下,可以看到SAA 的阴性样本在样板条上的T 线处没有颜色;阳性低值则在T 线处呈现淡黄色;而SAA 的阳性高值样本在T 线处有较为明显的黄色。在紫外灯下,如图6(c)所示,SAA 的阳性高值(115.14 mg/L)样本在T 线处有较为明显的黄色荧光;SAA 的阳性低值(23.73 mg/L)样本在T 线处呈现较弱的黄色荧光;SAA 的阴性样本则没有荧光呈现。肉眼可见的判定适用于对SAA 的定性分析。荧光数值可以通过MAYA 荧光免疫定量分析仪放大处理得到,适用于对SAA 的定量分析。
目前市面上的体外诊断自测试剂(如新冠自测试纸条)主要是胶体金法和彩色微球法,以定性检测为主,实验结果显示基于AIE 荧光微球的检测SAA试纸条既可以定性检测,还能借助MAYA 荧光仪器来定量检测。该AIE 荧光微球QM-OH@PS-COOH标记的抗体荧光液对SAA 具有良好的检测效果,在体外诊断领域尤其是自测试剂方面具有一定的潜在应用价值。
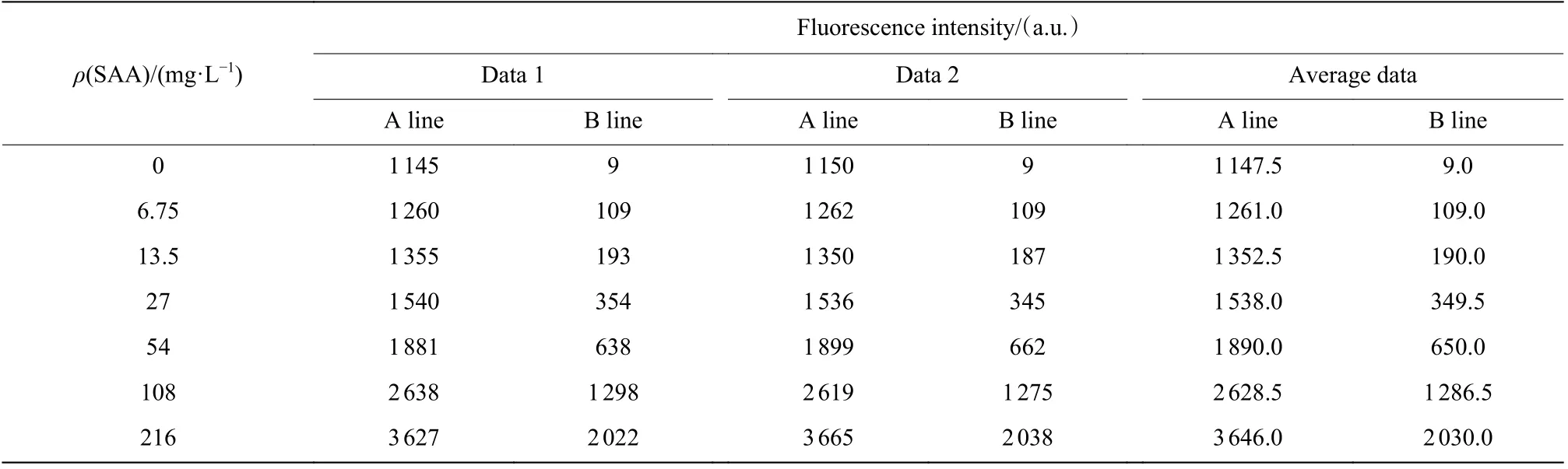
表1 SAA 质控品定标的数据Table 1 SAA quality control product calibration data

图4 喹啉腈AIE 荧光微球QM-OH@PS-COOH 荧光免疫层析检测SAA 原理示意图Fig. 4 Schematic diagram of quinoline-malononitrile AIE fluorescent microsphere QM-OH@PS-COOH for SAA detection in fluorescent immunochromatography
3 结 论
选取AIE 荧光染料QM-OH,通过简单的溶胀包埋方法,得到了能够用于荧光免疫层析的AIE 荧光微球QM-OH@PS-COOH。该AIE 荧光微球大小均一、形状规整,其密度、固含量、羧基含量等与市售荧光微球基本一致,同时与SAA 抗体具有优异的偶联效果,且稳定性好。该AIE荧光微球QM-OH@PSCOOH 作为荧光免疫层析中的主要载体,能够有效区分临床样本中SAA 的阴性和阳性样本,不仅可以肉眼定性判断,还可以对SAA 定量分析得到准确数值,具有潜在的应用价值。
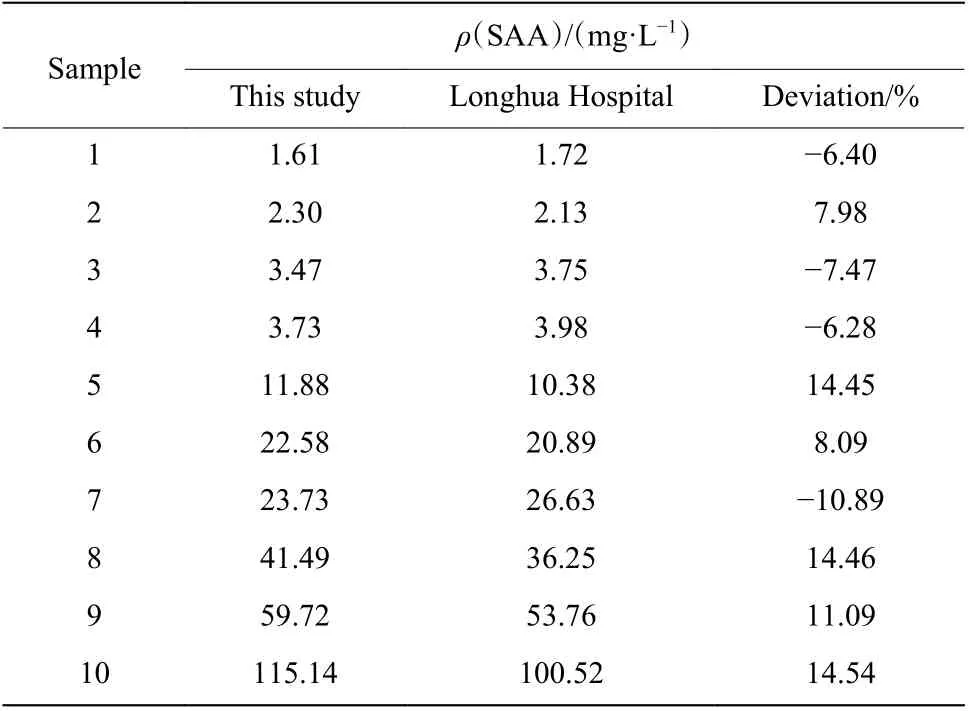
表2 本文和龙华医院临床测试样本SAA 测值比较Table 2 Comparation of SAA value between this study and Longhua Hospital

图5 SAA 质控品定标的曲线Fig. 5 Calibration curve of SAA quality control product

图6 MAYA 荧光免疫定量分析仪(a);日光灯下阴性、阳性低值、阳性高值样本的检测条(b);荧光灯下阴性、阳性低值、阳性高值样本的检测条(c)Fig. 6 MAYA fluorescence immunoquantitative analyzer(a); Test strips for negative, low positive and high positive samples under daylight lamps(b); Test strips for negative, low positive and high positive samples under fluorescent lamps(c)
