基于SIRT3探讨线粒体自噬改善慢性心衰的研究进展并结合中药提出新思路*
2022-08-26刘倩茹朱明军王新陆
刘倩茹,朱明军,崔 琳,王新陆**,杨 田
(1. 河南中医药大学药学院 郑州 450000;2. 河南中医药大学第一附属医院 郑州 450000)
慢性心衰(Chronic Heart Failure, CHF)是多种心血管疾病恶化的终末阶段,其主要表现为心排血量减少,不足以维持机体正常的代谢需求[1]。目前慢性心衰已成为心血管疾病防治的主要内容,当前治疗此病的策略之一就是通过调控线粒体功能使心衰患者心肌的能量供应得到提升,并最终改善心功能。已知SIRT3(sirtuin 3,沉默信息调节因子3)位于线粒体上,在氧化应激和脂质代谢中均有重要作用,诸多实验证明可通过上调SIRT3的表达水平改善线粒体功能并借此改良心衰的病情。因此,该蛋白已成为治疗心衰的新作用靶点,但有关SIRT3 激动剂与抑制剂的研究方面并不充分,而结合中医药进行探索的更是寥寥无几,本文在此对SIRT3 影响心衰的部分作用机制作一综述,并希望能够结合中医药探讨一条新的治疗思路。
1 简述慢性心力衰竭
慢性心衰具备以下两点特征:①患者体、肺循环中存有淤血;②因组织血液灌注的不足,导致患者出现各种心跳加快、呼吸困难、心肌缺血缺氧等现象,并引发严重的并发症[2,3]。因心衰的患病率高、死亡率高,该病已成为全球慢性心血管疾病防治的主要内容。已知慢性心衰发生、发展、恶化的关键病理环节为能量代谢失衡,因此,为治疗心力衰竭,现代医学在改善能量代谢方面做了很多尝试,并取得结论:虽然单位分子量的脂肪酸能产生较多的ATP(Adenosine triphosphate,三磷酸腺苷),但同时也会消耗更多的氧气,故当今治疗的主要手段还是提高葡萄糖利用率和抑制脂肪酸。近年来调解慢性心衰的常用药物主要有曲美他嗪、左卡尼汀、辅酶Q10 等,它们主要通过调节脂质、糖类代谢保护线粒体,进而在细胞能量代谢信号等方面产生影响,并最终改善细胞能量,从而发挥对该病的治疗作用[4]。目前对于线粒体功能损伤、ATP 生成障碍、代谢底物利用障碍等关键环节的治疗则缺乏相关的证据支持,而当前治疗慢性心衰的策略之一就是改善线粒体功能、提高线粒体有氧氧化效率及ATP 利用率,从而提升慢性心衰患者心肌的能量供应,最终使其心功能得到改善[5]。有研究证实[6],SIRT3可以通过调控乙酰化及自噬,改善线粒体的功能,因此目前认为SIRT3能成为治疗心衰的新作用靶点。本文就SIRT3在慢性心衰中的作用及其部分作用机制作一综述,并将其与中医药结合,希望发现一条诊治慢性心衰的新路。
2 线粒体自噬对心力衰竭的作用
众所周知,在人体器官中,心脏具有高耗能、低储能的特点,平均每秒需要消耗1mmol·L-1的三磷酸腺苷(ATP)用于维持心脏的正常生理功能,而ATP 主要被线粒体生产。有研究表明,在由心脏瓣膜病、心肌病等疾病所致的心衰患者中均观察到了线粒体功能异常导致的心肌能量代谢障碍[7]。当线粒体功能异常时,除了会引起能量代谢障碍外,还能形成大量活性氧簇(reactive oxygen species,ROS)[8],而ROS 可引起心肌细胞钙超载并有利于心肌纤维化且可诱导心肌细胞凋亡,这些功能使其在心力衰竭中起关键作用[9,10]。保证线粒体功能的基石是线粒体质量控制,实现线粒体质量控制的重要途径之一是线粒体自噬。自噬是指真核细胞吞噬自身胞质蛋白或细胞器并使其包被进入囊泡形成自噬体,而自噬体又与溶酶体融合形成自噬溶酶体,最终将所包裹的内容物降解的过程[11],该过程是响应细胞信号传导或细胞应激(如营养应激,感染,缺氧和毒性)的重要适应性机制[12]。迄今为止已经发现了三种类型的自噬,即巨自噬,微自噬和分子伴侣介导的自噬。线粒体自噬也可以称为线粒体吞噬,它属于这三种自噬之一,其过程可以选择性的消除受损线粒体[13],而受损线粒体产生的ROS 比健康线粒体所产生的要多十余倍,因此,通过线粒体自噬的方式清除受损线粒体不仅可以稳定内环境而且还可以起到保护细胞的作用。经典的线粒体自噬调节通路目前主要有两种:PINK1(PTENinducedputativekinase1,PTEN 诱导激酶1)/Parkin 通路(帕金森病蛋白)和受体介导的线粒体自噬通路;后者又包含了多种自噬途径,本文在此仅介绍其中报道较多的NIX(Nip3-like protein X,线粒体外膜蛋白NIX)与Bnip3(BCL2/adenovirus E1B 19 kDa protein-interacting protein 3,Bcl2相互作用蛋白3)介导的线粒体自噬途径。
2.1 PINK1/Parkin线粒体自噬通路
哺乳动物中常见的线粒体自噬调解通路为PINK1/Parkin 通路,当线粒体受损并去极化时,PTEN诱导激酶 1(PTEN-inducible putative kinase 1,PINK1)在线粒体外膜(outer mitochondrial membrane,OMM)堆积并因自身磷酸化而被激活。激活的PINK1 募集parkin并将其和关键底物泛素磷酸化,这会导致parkin易位和激活。而parkin作为连接酶会泛素化多种线粒体底物及其自身,紧接着,多聚泛素化的底物会被微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)适配体蛋白识别并与LC3 结合进入自噬体,之后与溶酶体结合形成自噬-溶酶体,最终使受损线粒体得到清除[14]。有研究指出[15],SIRT3通过去乙酰化FOXO3(Forkhead-like protein 3,激活叉头蛋白转录因子3a),促进PINK1/Parkin 通路进行线粒体自噬,并最终改善慢性心衰,其作用机制见图1。
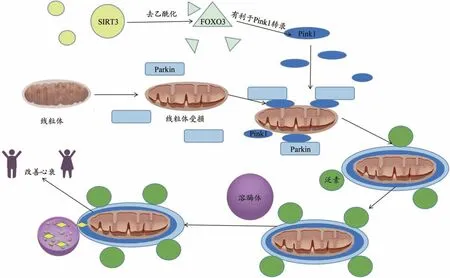
图1 SIRT3通过影响PINK1/Parkin通路调节线粒体自噬图
2.2 受体介导的线粒体自噬通路
线粒体自噬的作用机制和通路并不单一,受体介导的线粒体自噬通路也为其中之一。该通路也被称为受体介导的线粒体自噬途径,与PINK1/Parkin 通路需要激活PINK1 进行后续的反应不同,在此通路中,某些线粒体外膜蛋白上的结构域可与LC3 进行结合,并作为自噬体的受体介导线粒体自噬[16]。目前此通路可细分为NIX 和Bnip3 介导的线粒体自噬途径和FUNDC1(FUN14 domain-containing 1)介导的线粒体自噬途径,二者中报道较多的为前者。
线粒体外膜蛋白NIX(Nip3-like protein X)和BNIP3 (BCL2/adenovirus E1B 19 kDa proteininteracting protein 3)均为 BCL2(B-cell lymphoma-2,B细胞淋巴瘤/白血病基因2)家族的成员,均可以促使细胞凋亡和线粒体自噬。文献报道[17],当BNIP3 含量增高时,将有益于线粒体自噬的发生,而其作用机制与结构域LIR(LC3-interaction region)有关,此结构域存在于NIX 及BNIP3 上,它可以与LC3 结合从而启动线粒体自噬。另有研究指出[18],当细胞中SIRT3 过表达时,促进BNIP3 表达上调,有利于激活线粒体自噬,从而延缓心衰病情的发展。
3 SIRT3可通过调节线粒体自噬改善心衰病情
Sirtuins 家 族 是 一 组 依 赖 NAD+(Nicotinamide Adenine Dinucleotide,烟酰胺腺嘌呤二核苷酸)的去乙酰化酶,它们与心血管疾病的病理生理息息相关[19]。作为去乙酰化酶,Sirtuins可以去乙酰化组蛋白和非组蛋白,并且能改变部分蛋白的功能。但和经典的去乙酰化酶有所不同,它们还能够进行异常化学反应中的乙酰基团,去乙酰化赖氨酸残基,消耗NAD+,释放尼克酰胺和乙酰化底物。此蛋白家族内有7 位成员,它们分别有不同的细胞内定位:SIRT1 与SIRT2 主要存在于细胞质中,在组蛋白去乙酰化和修复DNA(Deoxyribo Nucleic Acid,脱氧核糖核酸)中起重要的调节作用。SIRT3 位于线粒体,在氧化应激和脂质代谢中具有不可或缺的作用。而SIRT4与其他成员的不同之处在于它并没有去乙酰作用。SIRT5则主要存在于线粒体内膜腔和基质中,与它相互作用的底物有细胞色素c、氨基甲酰磷酸盐合成酶1 等。SIRT6 存在于细胞核中,它不仅具有去乙酰的作用,而且在基因表达和DNA 修复中起重要作用。sirtuins 家族中唯一存在于核仁中的蛋白是SIRT7,其功能与rRNA 的转录调控密切相关,并可以影响细胞的增殖和代谢[20]。本篇文章着重讨论SIRT3通过调节线粒体自噬延缓慢性心衰的发展。
3.1 SIRT3的结构与生理学作用
SIRT3 是一种存在于线粒体基质中的可溶性蛋白,与sirtuins 家族的其他成员结构相似,由一大一小两个结构域、大约270个氨基酸残基组成。其中,主要由Rossmann 折叠(罗斯曼折叠模式)形成具有较高保守性的大结构域,而保守性较低的小结构域则含有锌指结构[Cys-X-X-Cys-(X)15,20-[Cys-XX-Cys3]。从微观角度看,此蛋白可以通过调控线粒体上的蛋白质乙酰化水平使线粒体的代谢功能受到影响[21],从宏观上看,SIRT3在延长哺乳动物寿命、抗衰老以及治疗癌症等多方面均有确切的疗效[22-23]。
SIRT3 具有广泛的生理学作用:在线粒体基础生物学、能量转化、细胞能量代谢以及氧化应激、心脏重塑等方面SIRT3均发挥着关键影响。而其主要功能是参与能量的合成,并且在机体内SIRT3 几乎参与所有的细胞代谢信号通路调节[24]。
3.2 SIRT3通过清除ROS影响心衰的发展
SIRT3 可以直接通过去乙酰化锰超氧化物歧化酶(manganese-containing superoxide dismutase, MnSOD)从而增强MnSOD 的抗氧化能力[25]。此外,SIRT3 也可以通过去乙酰化激活叉头蛋白转录因子3a(Forkheadlike protein 3, FoxO3a)促进 MnSOD 和过氧化氢酶(Catalase,CAT)的表达[26],而在正常生理状态下,体内多余的ROS 是通过MnSOD、CAT 等抗氧化酶清除的[27,28]。众所周知,ROS可引起心肌细胞钙超载并促进心肌纤维化和诱导细胞凋亡,这对心力衰竭有关键作用,因此SIRT3可通过去乙酰化作用达到清除ROS、改善心衰病人病情的目的。
3.3 SIRT3 通过调节能量代谢和线粒体自噬影响心衰的发展
机体内能量的正常代谢与SIRT3 的作用密不可分:众所周知,大多数真核细胞中均存在线粒体,而线粒体自身是一种可以携带遗传物质的半自主细胞器,它是细胞进行有氧呼吸的场所,被称为细胞的能量工厂[29]。在线粒体内发生的氧化磷酸化可以为心肌提供大量的ATP 使心肌发挥正常的生理功能[30],而乙酰辅酶A(Acetyl-CoA)是体内代谢的枢纽性物质,对氧化磷酸化有重要作用。已知,SIRT3 可通过去乙酰化激活CoA 合成酶2(AceCS2),增加乙酰辅酶A 的生成,从而起到调节线粒体能量代谢的目的[31]。另外,SIRT3也可去乙酰化呼吸链复合体Ⅰ的亚基NDUFA9、线粒体呼吸链复合体Ⅱ的组成部分琥珀酸脱氢酶(SDH),进而调节细胞内ATP水平并影响能量代谢。
线粒体自噬也可被SIRT3 的表达水平影响:FoxO(Forkhead box O)家族会被SIRT3 的去乙酰化作用影响,并会因此激活自噬相关蛋白LC3 和Bnip3 的表达[32]。在哺乳动物中,FoxOs 蛋白家族具有四个成员,即FoxO1、FoxO3a、FoxO4、FoxO6。FoxO 因子最初被认为是胰岛素途径的下游调节剂,可以调节多种信号通路,它对细胞能量产生、抗氧化应激以及细胞的生存能力和增殖均有影响[33]。FoxOs 可以通过转录、翻译后修饰、表观遗传学调节自噬,使线粒体功能得到改善,但在持续心肌缺血的情况下,激活FoxO 诱导的自噬会导致线粒体代谢障碍并会刺激心肌细胞坏死,而阻断FoxO 自噬轴能够抑制心肌细胞凋亡和纤维化。有研究证实,FoxO家族中的FoxO3a会被SIRT3表达水平的高低影响——当SIRT3 表达增加时,会激活FoxO3a/PINK1-Parkin 通路,这将促进线粒体自噬,而机体会通过自噬对心肌产生保护作用[34]。此外,有文献报道SIRT3 也可以通过与FoxO1 形成的SIRT3/FoxO1 通路调控线粒体乙酰化和自噬,已知FoxO1 是通过抑制组蛋白去乙酰化酶(HDACs)的活性,进而增加FoxO1 基因及蛋白活性,诱导自噬发生;同样,FoxO1 也能以乙酰化酶(KDAC)为靶点,激活其活性,增加FoxO1 的乙酰化,使FoxO1 蛋白在细胞核内过度累计,进而使自噬基因和Sesn3(sestrin 3)过度激活,从而导致mToR-ULK1 通路被抑制,最终促进线粒体自噬的发生[35,36],这会使线粒体超微结构及功能得到改善,进而对心功能产生预期影响。近几年的研究也表明SIRT3 的表达水平同样会影响P53:当SIRT3 缺失时,P53 与Parkin 的结合程度会显著增加,而二者的结合会导致Parkin 转位被抑制,进而降低线粒体自噬的水平[37],从而不利于心衰患者的恢复。上述作用机制总结详见图2。
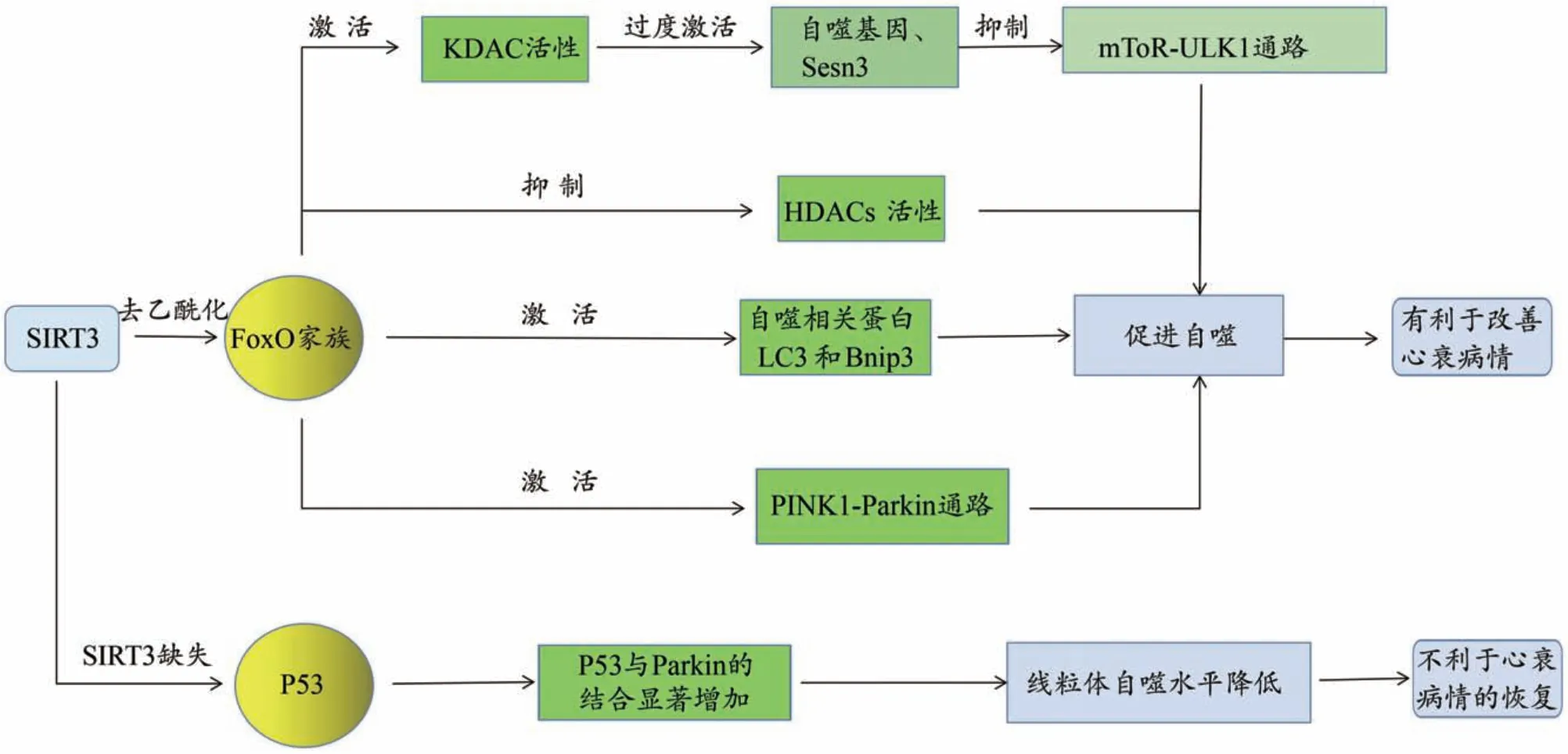
图2 SIRT3通过调节线粒体自噬影响心衰发展的作用机制图
综上所述,机体内SIRT3 对线粒体具有不可或缺的重要作用,而且可以通过提升SIRT3 的表达水平来改善心衰患者的能量代谢问题,并最终起到延缓或改良病情、提高病人的生活质量的目的。根据相关实验的结果可知[38,39],3-TYP(3-(1H-1,2,3-triazol-4-yl)pyridine,SIRT3 抑制剂)可作为 SIRT3 的抑制剂:3-TYP 会增加ROS 的生成和线粒体丙二醛(MDA)的含量,并会降低超氧化物歧化酶(SOD)的活性,同时它也会增加Ac-SOD2和gp91phox的蛋白表达,这最终会导致SIRT3 被抑制。与此相反,栀子黄色素(Gardenia yellow)则可能作为SIRT3 的激动剂:有研究表明[40],栀子黄色素在清除自由基、抗氧化方面具有显著效果,它能降低MDA 的含量并提高SOD 的活性,而且,栀子黄色素同样能增强琥珀酸脱氢酶(SDH)和苹果酸脱氢酶(MDH)的活性,从而促进机体有氧氧化代谢,同时,它也可以推进糖酵解,进而增加ATP;但,目前有关栀子黄色素对SIRT3的作用以及作用机制等方面的研究并不充分。
4 中药可调节SIRT3表达
SIRT3 不仅在心衰中起改善作用,更在其他心血管疾病[41]、肾病[42]、神经系统疾病[43]等多种病症中起重要作用,所以近年来对SIRT3的研究与日俱增,其中包括中药对SIRT3的调控(表1)。有研究报道[44],附子中重要有效成分乌头碱可激活SIRT3,而SIRT3 去乙酰化作用可降低Cyp-D(亲环蛋白D)的乙酰化程度,并减少乙酰化的Cyp-D 与ANT-1(腺嘌呤核苷酸转位酶1)结 合 , 抑 制 m PTP(mitochondrial permeability transition pore,线粒体通透性转换孔)的开放,从而改善线粒体能量代谢,发挥保护线粒体和心肌细胞的作用。除此之外,虎杖中有效成分虎杖苷及白藜芦醇均可影响SIRT3 活性,进而有利于线粒体功能正常运转[45,46]。而中药厚朴含有效成分厚朴酚与和厚朴酚[47],这些成分可防止线粒体损伤和大鼠新生心肌细胞死亡[48],其作用机制与激活SIRT3/KLF15 信号通路有关。香豆素为黑香豆、香蛇鞭菊、兰花等药植物中所含成分,作为SIRT3 活化剂,具有极高的潜在的价值[49]。柴胡主要活性成分柴胡皂甙d,该物质的作用机制可能为调节SIRT3 的表达[50]。姜黄素,中药姜黄中有效成分,属黄酮类,该物质具有抗H9C2 心肌细胞缺血再灌注损伤作用,其作用机制可能为激活SIRT3,抑制氧化应激[51]。五加科植物人参中含有多种活性成分,柯世业等表明人参皂苷Rb1能激活SIRT3/SOD2通路,进而延缓高糖诱导的人脐静脉内皮细胞早熟性衰老[52],王蕾等证明人参糖蛋白能通过上调SIRT3 、Bcl-2 蛋白表达水平,下调Bax 蛋白表达水平,降低ROS 水平,恢复线粒体膜电位,抑制氧化应激损伤等方式改善阿霉素所致的心脏毒性[53]。有文献记载[54],茶叶中的茶多酚可以上调大鼠肾脏中SIRT3 的表达量和活性,并进一步推测绿茶多酚可以通过NAMPT/SIRT3 降低氧化应激水平。此外,赵薇经实验得出结论[55],中药大黄的有效成分大黄酚,可能通过上调SIRT3 的表达,下调AQP4 和Caspase3 的表达,调节机体氧化应激反应,并降低脑水肿和抑制细胞凋亡,对脑缺血再灌注损伤发挥保护作用。高梓琪[56]等的研究结果也显示,重楼的主要活性成分重楼皂苷Ⅰ可能通过影响SIRT3,激活SIRT3/SOD2/ROS,从而减轻氧化应激,发挥其抗氧化作用。另外,李冬平发现[57],中药土三七可通过SIRT3-SOD2-mROS 使肝细胞凋亡。此外,有诸多研究表明,除中药外的其他药品中同样有SIRT3 的激动剂或抑制剂,如:新型阿片受体激动剂羟考酮能减轻心肌缺血再灌注损伤,其作用机制可能与调节SIRT3/SOD2/NF-κB 通路,减轻氧化应激并抑制炎性因子释放有关[58]。胰高血糖素样肽-1 受体激动剂利拉鲁肽可能通过调节Sirt3 诱导自噬,延缓DN 小鼠肾足细胞损伤[59]。SIRT3 激动剂 HKL(Honokiol)可以与 SIRT3结合,增强SIRT3功能活性,使心肌肥厚的发生出现逆转[60]。3-TYP 能使神经元高糖缺氧后的SIRT3 表达降低,并降低神经元高糖缺氧后的细胞存活率,提升凋亡率,是SIRT3的抑制剂[61]。

表1 可调节SIRT3的中药及其有效成分
结合前文可知,“能量缺乏”是心衰发生、发展的主要因素,线粒体结构异常与功能障碍,是心脏能量失衡的驱动力。已知SIRT3可通过调控线粒体改善心衰病情,但与其相关的激动剂与抑制剂报道相对较少,有较大的研究空间,而中药因复杂的成分组成及配伍时诸药之间的相互影响对心衰有确切的疗效,并已有研究表明中药部分有效成分对心衰产的疗效与SIRT3 有关,但缺乏对单味中药及配伍用药的相关研究,因此产生疑问:当单味中药或多味中药配伍使用时,能否比单一有效成分更能使SIRT3的表达上调,进而更有利于治疗心衰。基于上述问题,提出一条思路——相比单一有效成分的作用,能否利用单味中药及配伍用药,使SIRT3表达水平更进一竿,以此调节能量代谢及线粒体功能,最终延缓心衰的病程发展并改善其临床症状。但中药药材的多样性以及中药成分的复杂性会带来一定的阻碍,故,将此思路变为现实需要不断的进行努力。
5 总结与期望
慢性心力衰竭是多种心血管病的终末阶段,该病已经严重影响大众的身心健康。有调查显示,在我国35-74 岁的人群中,慢性心力衰竭的患病率可达到0.9%,住院死亡率可高达4.1%,而此比例在全球范围内逐年递增[62]。在中医传统文献中并无“心力衰竭”这一名词,根据心衰的临床特征可将此病归于中医“喘证”“心悸”“心痹”等范畴[63],该病的病机在中医中可归为本虚标实[64]:本虚为阳虚、阴虛或气虚,标实为血瘀、痰饮、水停,标本俱病,虚实夹杂。迄今为止,针对心衰病每年都有不少研究正在进行。
SIRT3 是一种可以介导去乙酰化-自噬途径的蛋白酶,它可以通过调节线粒体自噬来影响能量代谢并最终达到改善心衰病情的目的。近几年不断有学者对SIRT3进行研究,主要方向集中于心血管疾病、肿瘤及癌症以及神经系统疾病等方面,证实了其对多种疾病均有疗效。但有关SIRT3抑制剂和激动剂的研究并不充足,结合中药及配伍用药的更是屈指可数,希望未来能结合中医药,研究SIRT3激动剂,并将其灵活运用到临床相关疾病的治疗上,使患者的存活率和生活质量得到进一步的提升。
