黄瓜再生和遗传转化体系优化
2022-08-19苗永美张开京
苗永美, 简 兴, 张开京
(1. 安徽科技学院 生命与健康科学学院,安徽 凤阳 233100; 2. 安徽科技学院 建筑学院,安徽 凤阳 233100; 3. 安徽科技学院 农学院,安徽 凤阳 233100)
诱导黄瓜器官离体再分化尤其对于实现转基因研究具有重要的理论和实践意义[1],黄瓜产生愈伤组织的能力和生根能力都很强,尤其生根环节不需要激素刺激。但是愈伤组织再分化、外植体器官直接分化、胚状体诱导等再生途径难度非常大,且存在明显基因型和外植体差异,子叶为常选用的外植体[2-3]。农杆菌介导的遗传转化仍然是目前黄瓜转化的主要方法[4]。本研究选用华北型、华南型、欧洲温室型和美国加工型4种类型共10个黄瓜品种,研究基因型、外植体和生长调节剂对黄瓜器官分化影响;进行筛选标记敏感性试验,同时考察了农杆菌浓度、预培养时间、侵染时间、共培养时间及乙酰丁香酮(AS)对转化率影响,以期建立一个高效稳定黄瓜再生体系和遗传转化体系,为实现黄瓜高效遗传转化奠定基础。
1 材料与方法
1.1 材料
10个黄瓜品种,具体见表1。
1.2 方法
1.2.1 基因型再生能力比较 种子用0.1%HgCl2消毒8 min,无菌水漂洗4次,无菌水浸泡4 h,吸干表面水分,平放在MS培养基上,暗培养至露白后转至光下培养。6 d时两片子叶脱离种皮但未完全张开,切取1.5 cm下胚轴、子叶横切成两份,近轴端沿胚轴纵切,轻轻刮去生长点(带柄子叶)、远轴端切去叶尖(不带柄子叶)、1.5 cm左右胚根,共4种外植体。MS培养基,0.05 mg/L TDZ、1.0 mg/L 6-BA分别与(0、0.1、0.5 mg/L)、IAA 0.1 mg/L NAA随机成8种激素配方,记M1~M8,根据文献及预试验设计培养基M9:MS+1.0 mg/L 6-BA+0.2 mg/L ABA+2 mg/L AgNO3。每处理7~13个外植体,重复3次,30 d统计结果。光周期16 L/8 D,光照强度2 500 lx,温度25 ℃。
1.2.2 细胞分裂素种类筛选 ‘EC5’和‘Chipper’子叶节接种在含TDZ、6-BA和KT的MS上,25 d统计芽分化率。
1.2.3 子叶节不定芽诱导 ‘EC5’和‘Chipper’子叶节,三因素四水平正交设计(见表2),每处理接种50~60个外植体,‘EC5’试验重复4次,‘Chipper’ 试验重复2次,25 d统计结果。
1.2.4 生根培养 将获得的‘EC5’芽苗接种于1/2MS附加IAA和NAA的培养基上,1周后统计生根率、根数及表现。
1.2.5 潮霉素敏感性试验 ‘EC5’和‘Chipper’子叶节,培养基为MS+1.0 mg/L 6-BA+0.1 mg/L ABA+2.0 mg/L AgNO3,添加0、5、8、10、15、20、25 mg/L Hyg,每个处理接种30个外植体,25 d统计诱导率,并观察外植体生长情况。选高度大于2 cm无根苗,接种至含0、5、8、10、15、20、25 mg/L Hyg的1/2MS上,每处理接种15株,统计生根情况及生长表现。
1.2.6 脱菌剂抑菌效果比较 挑选含有pCABIA1304的EHA105农杆菌单菌落,YEB+50 mg/L Rif+50 mg/L Kan培养基中,28 ℃、250 r/min振荡培养,测OD600值,5 000 r/min、4 ℃下离心5 min 收集菌体,MS0重悬、调整OD=0.6。
‘Chipper’子叶节暗预培养2 d,置于侵染液中(OD=0.6)侵染8 min,吸干表面菌液,黑暗下共培养2 d,转至添加羧苄青霉素(Carb)和头孢噻圬(Cef)的培养基上,浓度为0、100、300、500、700 mg/L,15 d统计抑菌效果和芽分化。
1.2.7 转化条件优化 预培养基和共培养基:MS+1.0 mg/L 6-BA+0.1 mg/L ABA+2.0 mg/L AgNO3;选择培养基:MS+1.0 mg/L 6-BA+0.1 mg/L ABA+2.0 mg/L AgNO3+10 mg/L Hyg+200 mg/L Carb。
‘Chipper’子叶节,预培养时间、菌液浓度、侵染时间及共培养时间采用四因素四水平正交设计,每处理接40~45个,25 d统计抗性芽诱导率;子叶块和下胚轴用于瞬时表达鉴定,选择培养7 d后Gus染色,参照Jefferson方法[5]。
1.2.8 AS浓度对侵染效果影响 共培养基中添加0、50、75、100、200 μmol/L AS,预培养1 d,侵染液OD=0.6,侵染12 min,共培养3 d,统计抗性芽及瞬时表达。
1.2.9 结果统计及数据分析 芽分化率(%)=分化的外植体数/外植体总数×100%;平均分化芽数=分化芽总数/接种总数;染色率(%)=呈蓝色外植体数/外植体总数×100%。采用SPSS 18.0软件方差分析,Duncan新复极差法显著差异性检验。不服从正态分布的数据先反正弦平方根转换后再方差分析。Gus染色率采用极差分析。
2 结果与讨论
2.1 外植体对黄瓜再生影响
10个基因型黄瓜子叶节、子叶远轴端、下胚轴和根段在M1~M9培养基上均膨大,颜色变深,但只有子叶节能诱导出不定芽并伴有愈伤组织发生,其它3种仅个别两端或边缘膨大或有愈伤发生,无不定芽产生。
2.2 基因型对子叶节不定芽诱导影响
10个基因型黄瓜子叶节在M9培养基上表现(表1)看出:基因型间差异不大,只有华北型2个品种分化率较低,其它8个基因型的诱导率及分化芽数差异不显著。因此,后期试验选用‘EC5’和‘Chipper’。

表1 不同基因型黄瓜子叶节不定芽诱导情况
2.3 细胞分裂素对两种黄瓜子叶节不定芽诱导影响
图1显示,0.05 mg/L TDZ时,诱导率较低、芽小、愈伤化重,提高至0.1或0.2 mg/L时,‘EC5’外植体黄化死亡,‘Chipper’分化率降低。6-BA诱导能力比KT强,KT培养基上芽少,但个体大。总体来看,6-BA更适合不定芽诱导。

图1 分裂素对芽分化率影响
2.4 不同培养基对‘EC5’子叶节不定芽诱导影响
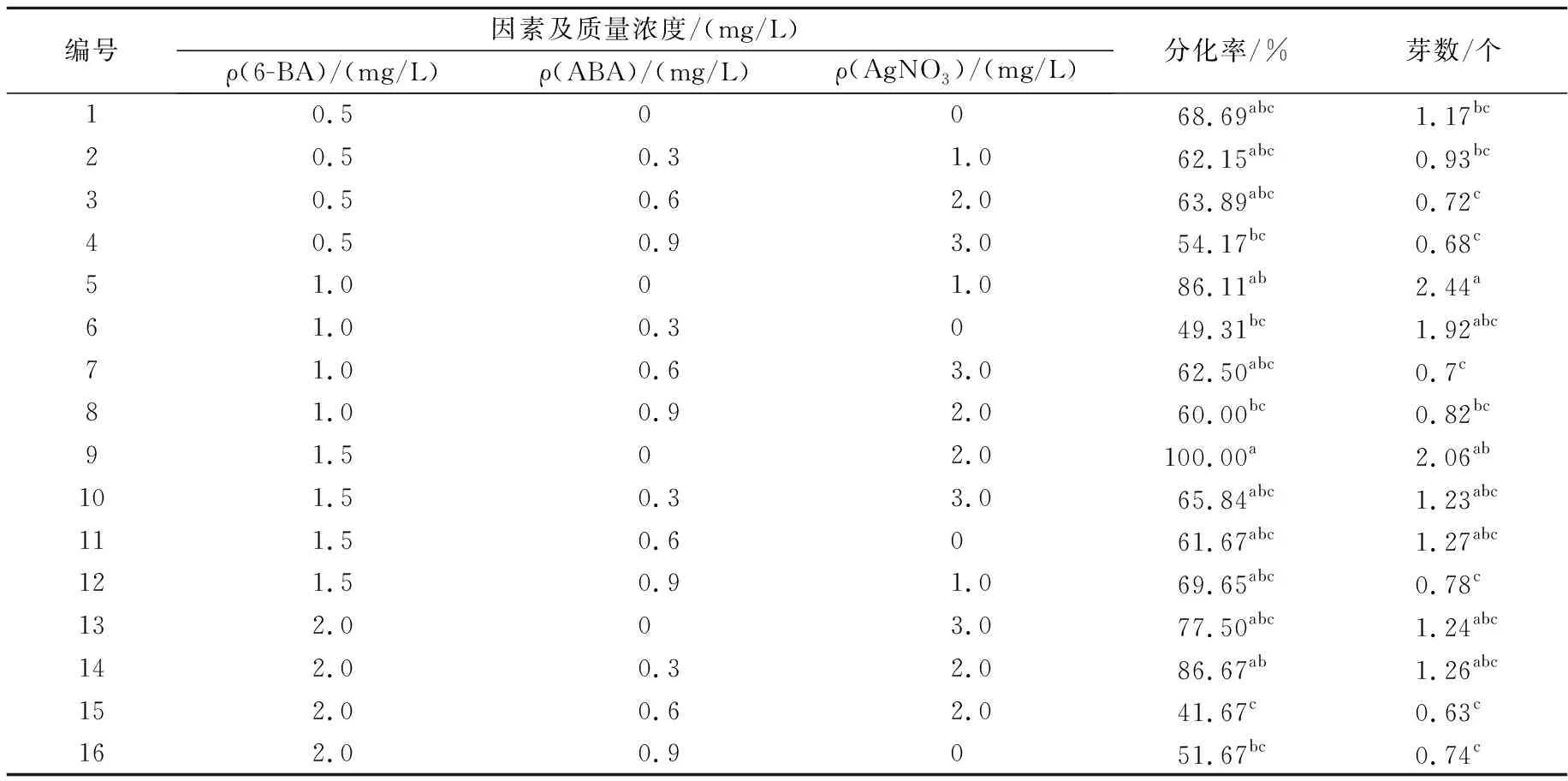
表2 激素组合对‘EC5’子叶节不定芽分化影响
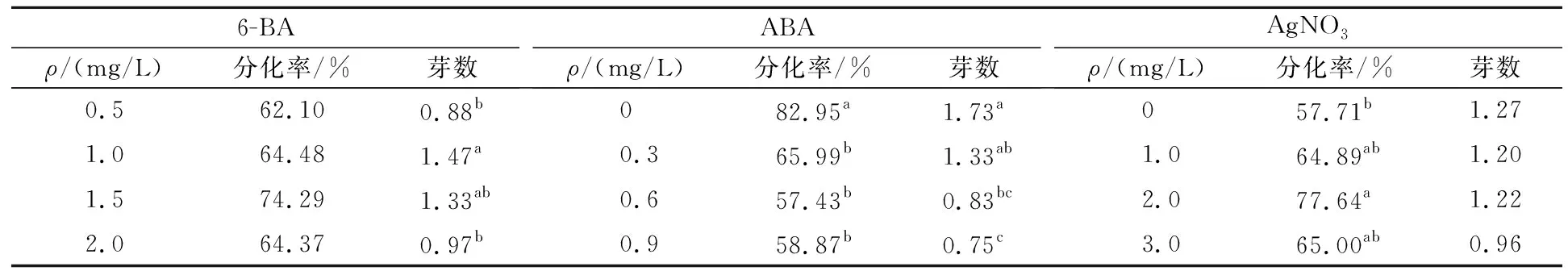
表3 多重比较
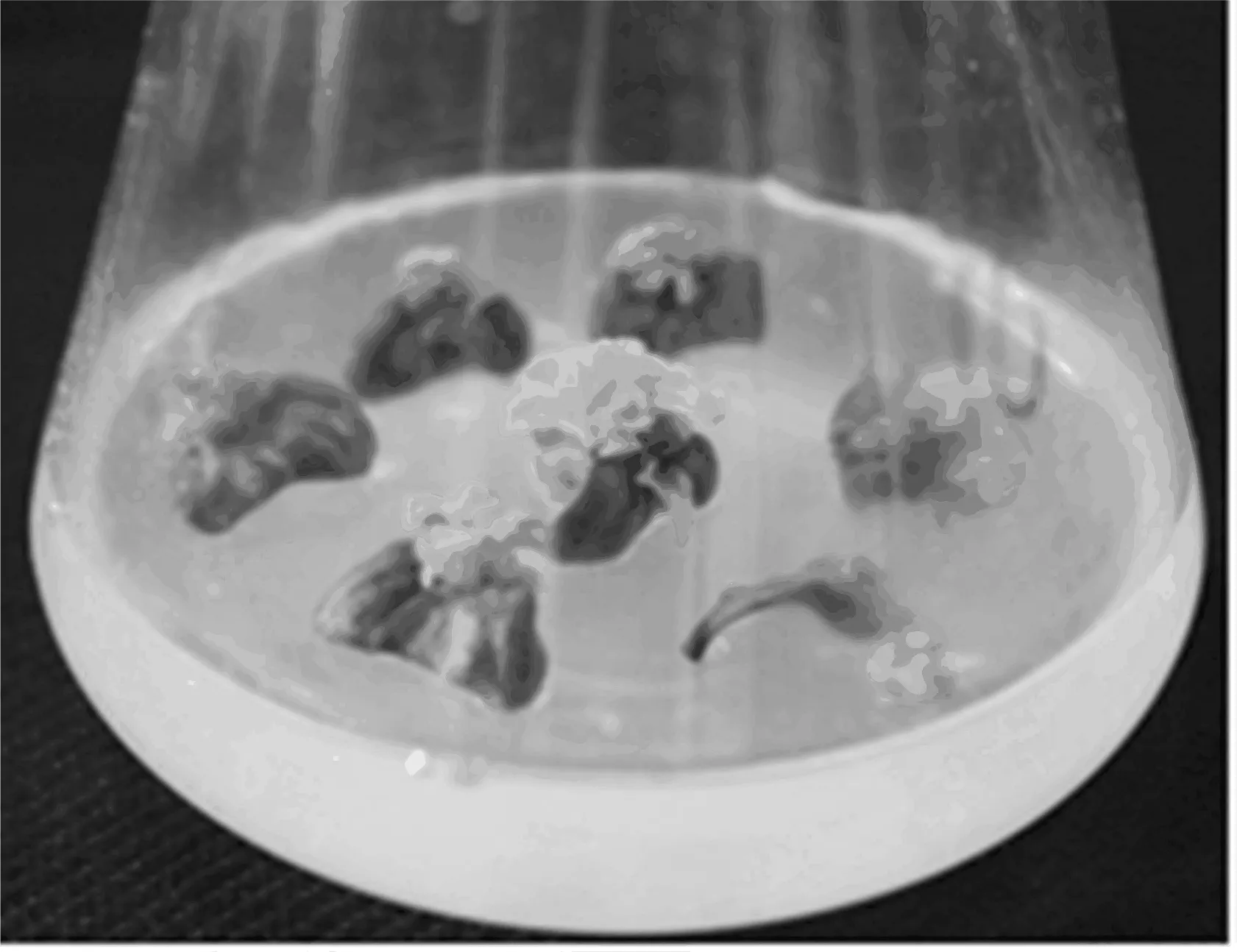
图2 子叶不定芽诱导情况
表2结果做多重比较(表3),0.5~2.0 mg/L 6-BA对分化率影响差异不明显,但芽数受浓度影响大,1.0 mg/L时最多,与1.5 mg/L时差异不显著。0.3~0.9 mg/L ABA会降低芽分化率和芽数,抑制愈伤产生,不加ABA时柄端产生较多愈伤,芽小。2.0 mg/L AgNO3能提高芽分化率,比对照提高了20.13%。综上,‘EC5’不定芽分化激素组合为1.0~1.5 mg/L 6-BA+0~0.3 mg/L ABA+2.0 mg/L AgNO3。
2.5 不同培养基对‘Chippper’子叶节不定芽诱导影响
极差分析看出,对不定芽分化影响最大的是6-BA,其次是ABA,最小的是AgNO3;‘Chipper’子叶节芽分化的培养基为MS+1.5 mg/L 6-BA+0.3 mg/L ABA+1.0 mg/L AgNO3。
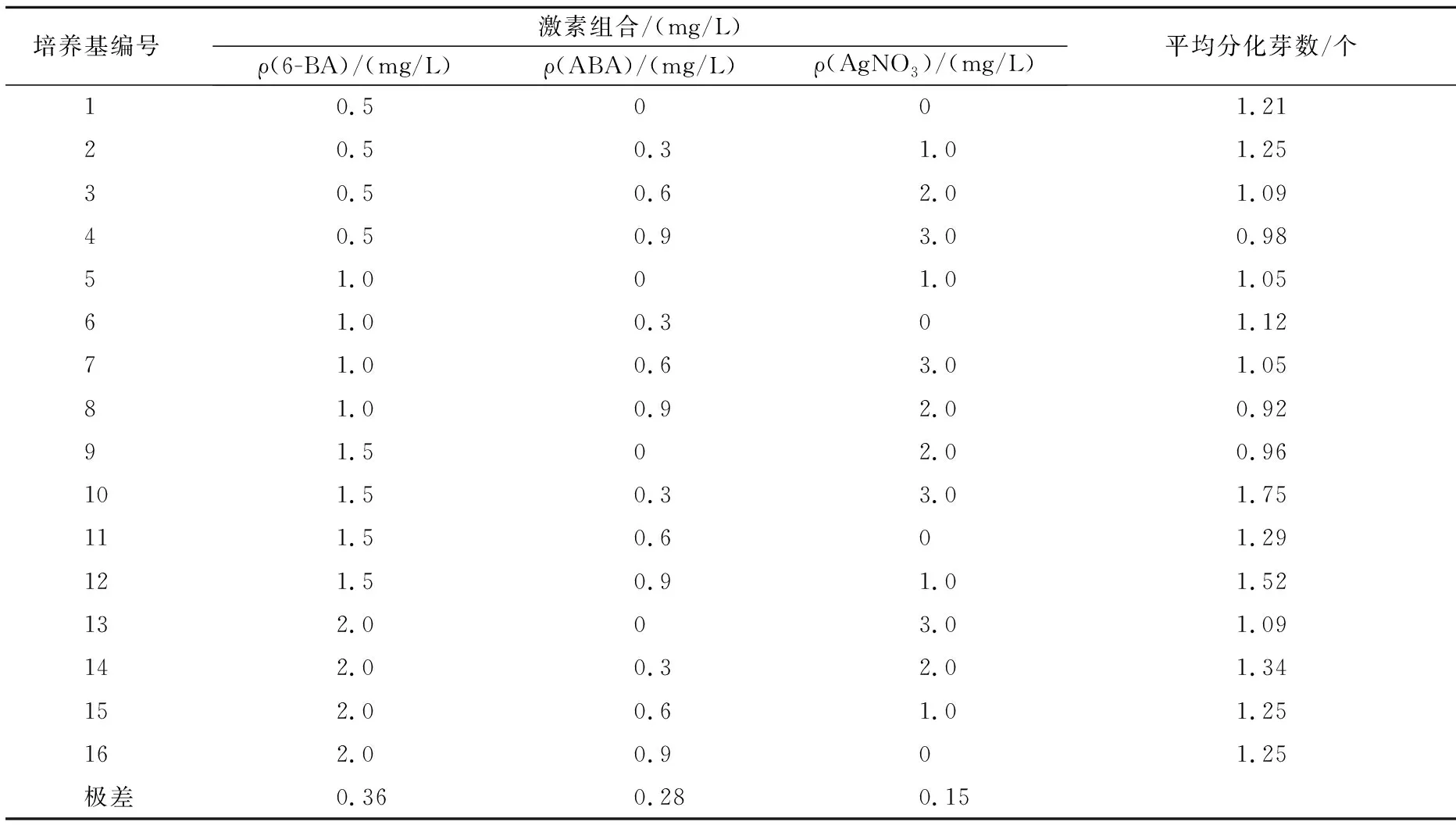
表4 激素组合对‘Chipper’子叶节不定芽分化影响
2.6 生根培养
1周后生根情况见表5,生长素会导致愈伤化,有些整株愈伤化,长势弱;1/2MS培养基上生根率达100%、平均根数为5.70。时间宜短,否则根太长、过细,影响移栽成活。
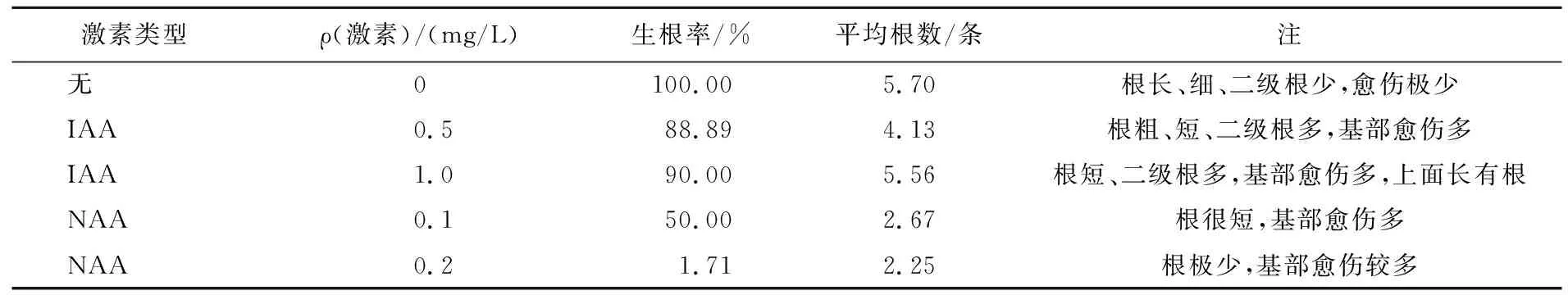
表5 不同生长素对‘EC5’生根影响
2.7 潮霉素筛选浓度确定
从表6看出,5 mg/L Hyg会抑制‘EC5’子叶节芽分化,使颜色变浅,抑制作用随浓度升高更明显,15 mg/L时叶块完全变黄,无分化;‘Chipper’对Hyg耐受力稍强,5 mg/L Hyg对芽分化率影响不显著,但抑制芽生长,浓度增至8 mg/L时明显抑制芽分化,分化率只有43.3%。黄瓜属易生根作物,Hyg会抑制生根,5mg/L培养基上,‘EC5’生根率只有25%,‘Chipper’生根率为33.33%,显著低于对照,8 mg/L的Hyg完全抑制2种黄瓜生根。5~8 mg/L Hyg是‘EC5’芽苗分化和生根的筛选临界浓度,8~10 mg/L Hyg为‘Chipper’的筛选压力。
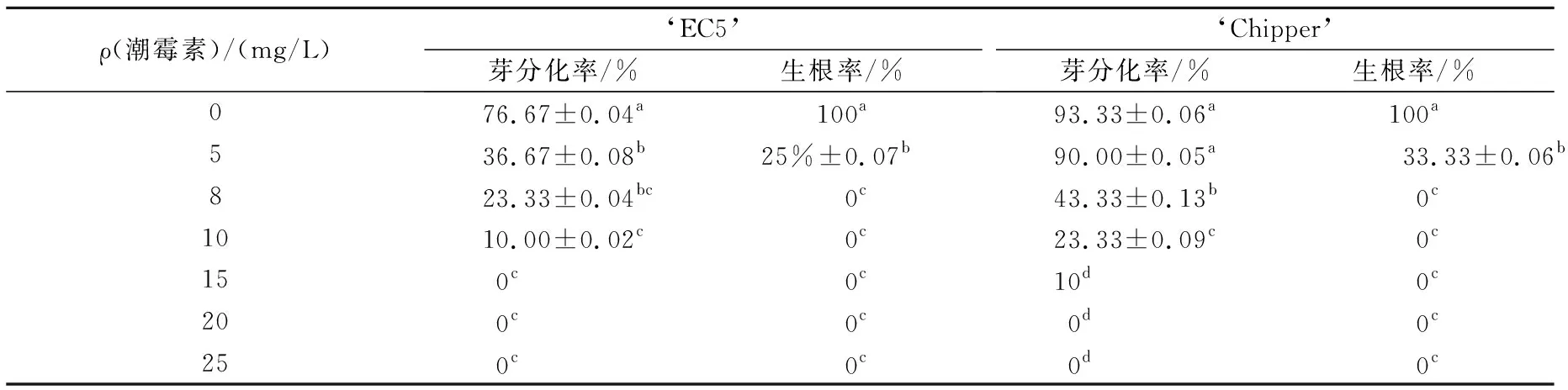
表6 潮霉素浓度对子叶节不定芽分化及生根的影响
2.8 脱菌剂浓度确定
由表7看出,不加抑菌剂时整个培养容器内长满农杆菌且影响到芽分化,2种脱菌剂浓度大于200 mg/L时都能完全抑制住农杆菌,Carb比Cef抑制作用小。所以,后期试验选用200 mg/L Carb。

表7 脱菌剂抑菌效果及对不定芽分化影响
2.9 侵染条件对转化效率影响
预培养时间、农杆菌浓度、侵染时间和共培养时间对芽分化率和染色的影响见表8~10。预培养对分化率影响不显著;随侵染液浓度升高,分化率先升高后降低,OD在0.6~0.8时,芽分化显著高于其它2个浓度;侵染8~16 min比4 min能明显提高分化率;共培养3 d时侵染率最高。根据R值大小,预培养天数对瞬时表达率影响最大,其它3个因素从大到小依次是侵染时间、共培养时间和农杆菌浓度。综合2个考察指标,农杆菌转化条件为:预培养1 d,OD=0.6~0.8,侵染时间12~16 min,共培养3 d。

表8 转化条件对芽分化及瞬时表达的影响

表9 抗性芽分化的方差分析

表10 瞬时表达的极差分析
2.10 AS浓度对转化效率影响
一定浓度乙酰丁香酮(AS)能提高‘Chipper’子叶节转化率(表11),随AS浓度升高,芽分化率和瞬时表达率都表现出先升高后降低趋势,50~75 μmol/L AS转化效率最好。

表11 AS浓度对转化效率的影响
图3 抗性芽的Gus染色
3 结论与讨论
影响植物离体器官分化的主要因素有基因型、外植体和生长调节剂,对黄瓜离体培养的影响已有研究报道。杜胜利等[6]比较了12份黄瓜子叶再生,均能出芽但存有差异,划分3个等次。李建欣等[7]研究了20个黄瓜自交系子叶不定芽诱导情况,诱导率变异范围15%~94%。张若伟等[2]比较了华北、华南、欧洲、日本及美国加工型共8个纯系黄瓜,华南型再生率最高,四川白瓜达100%,其它类型均较低。本研究选用4个生态型10个高代自交系黄瓜,只有华北型两个品种子叶节不定芽诱导能力相对降低,30%左右,其它8个分化能力差异不显著,诱导率都在80%以上。选择合适基因型是建立黄瓜高效再生体系的重要保障。
黄瓜可选用外植体种类很多,有子叶、下胚轴、真叶、子房及胚等,不同外植体分化能力和途径存有差异,其研究结果与本研究结果相似,表明带柄子叶产生不定芽能力最强,其它几种外植体芽诱导能力很弱,大多数不能分化出芽,只有愈伤发生。也有从下胚轴上诱导出不定芽的个别报道[8],可能主要是基因型差异,再生能力强的基因型会扩大再生外植体范围。总体看,外植体种类比基因型对黄瓜再生影响大。
诱导黄瓜直接分化芽或产生愈伤组织,细胞分裂素必不可少,常用6-BA,也有人使用TDZ和KT。6-BA常用浓度为0.5~2.0 mg/L,6-BA浓度过高,会加重愈伤化,芽小,丛生;TDZ因活性强使用浓度要低[3,9],0.05 mg/L时诱导出芽,但愈伤化重,超过0.1 mg/L时子叶黄化死亡。KT诱导能力不及6-BA,芽大,长势壮特点较为突出[10]。
本研究表明虽然少量生长素或高浓度细胞分裂素使外植体愈伤化,但黄瓜愈伤组织难以再分化。梅茜等[11]研究表明ABA 明显提高芽再生能力,1.0 mg/L最适宜,不添加ABA不定芽很难产生。Altman等[12]认为ABA对愈伤组织形成有重要促进作用。张守杰等[13]通过酶联免疫法分析了新泰密刺黄瓜子叶节离体培养中ABA变化,愈伤诱导期为峰值,分化阶段出现低谷,认为ABA对愈伤组织诱导具促进作用,其水平下降利于不定芽分化。也有相反报道,ABA和BA 组合能明显抑制愈伤组织而直接生出丛生芽[14];Sikioka 等[15]研究表明低浓度ABA(0.1 mg/L)促进黄瓜胚状体正常发育,高浓度(1.0 mg/L)显著减少愈伤化,控制胚状体处于球形胚或球形胚后期。本研究0~0.3 mg/L ABA对出芽数没有显著影响,但能减少出愈量,促进芽生长,0.6 mg/L ABA显著降低分化。由此看出,ABA对黄瓜再生调控作用不完全相同,可能与基因型有关。
AgNO3作为乙烯抑制剂能竞争性结合乙烯作用部位常用于植物组织培养,能提高不定芽发生[16]。培养基中添加2~8 mg/L AgNO3可显著提高再生频率,2 mg/L效果最佳[17],也有最佳浓度是1 mg/L和0.5 mg/L[18]的报道。本研究表明,2 mg/L AgNO3促进 ‘EC5’不定芽发生。
Hyg是表达载体pCABIA1304抗性标记基因,Hyg作为选择压力筛选转化细胞。对Hyg敏感程度因植物和生长阶段存有敏感差异,王丹等[19]研究表明山新杨和欧美杨叶片分化芽时敏感浓度为2.0 mg/L,小黑杨为3.0 mg/L;山新杨和小黑杨不定芽生长敏感浓度为2.0 mg/L,欧美杨为1.0 mg/L;山新杨和小黑杨茎段生长和生根敏感浓度为6.0 mg/L,欧美杨为2.0 mg/L。本试验表明 ‘Chipper’比‘EC5’对Hyg临界浓度稍高,生根阶段对Hyg敏感性不存有差异;两种黄瓜生根阶段敏感性都稍高于芽分化阶段。抗性芽在含Hyg培养基上生长较慢,选择培养4周后采用逐步降低Hyg浓度方法,减少Hyg对芽和根生长抑制。预培养目的是刺激细胞分裂分化,易于感受和接纳外源基因,通过正交设计和R分析表明预培养时间对瞬时表达率影响最大,其它因素依次为侵染时间、共培养时间和菌液浓度。蔡诚等[20]也证明预培养对杨树瞬时表达影响最大,不经预培养或时间过短,子叶伤口易褐化、死亡,时间过长,伤口处于愈合和封闭状态不利于侵染。预培养天数(0~4 d)对‘Chipper’抗性芽产生影响不大,但对瞬时表达率影响较大,1 d最好。AS目的是促进农杆菌侵染及激活Vir表达使T-DNA转移插入到受体基因组,加入方式主要有侵染液中加入和共培养中加入2种,共培养添加是常采用的方式。预培养和共培养中添加100 μmol/L AS 利于‘津优1号’黄瓜子叶节分化[21],菌液和培养基中加入50 mg/L AS提高了‘新泰密刺’58.4%抗性芽再生率;本研究共培养阶段添加50~75 μmol/L AS效果最好。