辣椒遗传转化技术的研究
2022-08-19郭红艳隋益虎胡能兵
郭红艳, 隋益虎, 胡能兵
(安徽科技学院 农学院,安徽 凤阳 233100)
辣椒(CapsicumannuumL.)为茄科辣椒属常异花授粉的一年生或多年生草本植物[1],原产于南美和墨西哥等中美洲热带地区,在世界上广泛栽培[2]。在我国,辣椒栽培面积共有3 200万亩、约200万hm2,其生产价值和经济效益都名列前茅,是我国重要的经济蔬菜作物[3-4]。辣椒中有12对染色体,其基因组约3.2~3.9 G,为同为茄科植物中番茄、茄子基因组的3~5倍。辣椒基因组包含着大量的重复序列,占整个基因组的81%,远高于马铃薯和西红柿[5]。与番茄、茄子相比,辣椒生物技术育种方面还存在着较大的差距[6],主要原因在于尚未有简便快捷的辣椒转基因体系,而现有报道的辣椒基因的功能大多都是通过VIGS[7]或借助于外源植物烟草[8]、拟南芥[9]来实现,这极大地限制了辣椒生物技术育种的速度。基于此,本实验对影响辣椒遗传转化的各因素进行研究,为后续的应用提供较好的技术支撑。
1 材料与方法
1.1.1 辣椒材料 BY-1,由安徽科技学院辣椒课题组提供。
1.1.2 根癌农杆菌菌株 使用农杆菌GV3101,植物表达载体为pR101-GFP(卡那霉素抗性),载体所含基因为CYP85A1(图1)。

图1 pR101-GFP载体结构示意图
1.1.3 农杆菌培养基 固/液体LB培养基+50 mg/L Kan(卡那霉素)+25 mg/L Rif(利福平)pH 7.0;植物组织再生培养基:(1) 不定芽诱导:M S+4 mg/L 6-BA(6-苄氨基嘌呤)+3.0%糖+8 g/L琼脂pH 6.5。(2) 芽伸长培养基:MS+4 mg/L 6-BA+3.0%糖+8 g/L琼脂+0.5 mg/L GA3(赤霉素)pH 6.5。(3) 生根培养基:1/2MS+3.0%糖+8 g/L琼脂pH 6.5。

表1 不同阶段培养基成分
1.1.4 实验仪器 高温高压灭菌锅;超净工作台;离心机;恒温振荡摇床;PCR仪;凝胶成像仪。
1.2 方法
1.2.1 培养温度与培养条件 培养温度为(25±1) ℃;光照强度为2 000 lx、16 h/d,白光灯。每次处理含外植体30个,3次重复。
1.2.2 无菌苗的获得 流水清洗辣椒种子3 min,在无菌超净工作台上用75%乙醇中灭菌1 min,用0.1%升汞灭菌2 min,无菌水清洗3~5遍,晾干水分,转接到萌发培养基中,于25~28 ℃培养成幼苗。
1.2.3 外植体的准备 取苗龄14~16 d的BY-1无菌苗,取子叶用于后续试验。
1.2.4 农杆菌侵染液的准备 在50 mg/L Kan+25 mg/L Rif+15 g/L琼脂的固体LB培养基上划线接种带有目的基因的农杆菌,挑取28 ℃暗培养2 d下的单菌落转接至上述的2 mL LB溶液中,在28 ℃、180 r/min条件下振荡培养12 h后,继续扩大培养;5 000 r/min收集菌体,用侵染液(MS+200 μmol/L AS(乙酰丁香酮))将其悬浮至OD600在0.6和0.8之间。
1.2.5 辣椒子叶的侵染 将子叶放入活化农杆菌的侵染液中,摇动0、10、20、30、40、50、60 min,在无菌滤纸上晾干水分,转接到共培养培养基(MS+4 mg/L 6-BA+50 mg/L AS+3%糖+8 g/L琼脂),25 ℃暗培养2 d之后,无菌水清洗3~5遍,一定浓度的特美汀溶液浸泡,无菌滤纸上晾干水分,转接到不定芽诱导培养基(MS+4 mg/L 6-BA+200 mg/L TMT(特美汀)+50 mg/L Kan+3%糖+8 g/L琼脂),每2周统计数据,直至子叶长出芽点。
1.2.6 伸长 将生长出的芽点转接至伸长培养基(MS+4 mg/L 6-BA+10 mg/L IAA+0.5 mg/L GA3(赤霉素)+200 mg/L TMT+50 mg/L Kan+3%糖+8 g/L琼脂)中培养,每2周统计数据,直至植株伸长。
1.2.7 生根 切下约1 cm的伸长小芽插入生根培养基(1/2MS+200 mg/L TMT+50 mg/L Kan+3%糖+8 g/L琼脂)诱导生根。
1.2.8 移栽 将组培苗洗去根部培养基,移植到基质中,在 25~30 ℃下炼苗移栽。
1.2.9 转基因辣椒的分子检测 对获得的转化植株和未转化植株的叶片,采用CTAB法[10-11]提取叶片总DNA,利用引物扩增进行PCR检测。本试验所用的目的基因是CYP85A1,该基因变为1 395 bp。
PCR检测:根据pR101-GFP上基因的序列设计引物,如下:
CYP85A1-F1-SalI:GTCGACATGGCCTTTTTCTTAGTTT ;CYP85A1-R1-PstI:CTGCAGTTAATTAGTTGAAACTCTAATTCG,反应条件为预处理95 ℃ 5 min(95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,每周期35个循环),最后72 ℃延长10 min,1%琼脂糖凝胶电泳检测该基因是否转入至辣椒中。
2 结果与分析
2.1 不同卡那霉素浓度对辣椒子叶诱导的影响
为筛选最佳浓度的卡那霉素,将子叶外植体接种于不同浓度的诱导分化培养基上,观察其生长情况。由表2可知,随着卡那霉素浓度的增加,子叶愈伤组织的发生和外植体抗性芽个数都呈先高后低的趋势。且当Kan浓度为50 mg/L时,其愈伤诱导率与抗性芽数为36.67%和0.90个,效果较好。故本实验中选择以50 mg/L的卡那霉素筛选辣椒抗性芽。

表2 卡那霉素浓度对辣椒子叶的影响
2.2 不同侵染时间对辣椒子叶的影响
在构建高效的辣椒遗传转化体系的时候,合适的侵染时间也是最为关键的过程。由表3可知,随着农杆菌侵染时间的延长,其愈伤诱导和抗性芽的发生呈先高后低的趋势。在侵染时间30 min时,其愈伤诱导与抗性芽个数较大为37.78%和2.10个,明显高于其他处理。而在侵染时间为0和60 min时,愈伤诱导率和抗性芽个数明显低于其他处理。表明侵染时间过短和过长都不利于辣椒的遗传转化,故本实验选择30 min的侵染时间。

表3 不同侵染时间对辣椒子叶的影响
2.3 特美汀(TMT)溶液浸泡时间对农杆菌的抑制影响
适宜的TMT溶液浸泡时间来抑制农杆菌的生成,是决定外植体能否再生的重要过程。由表4可知,随着外植体在TMT溶液浸泡时间的延长,其抗性芽个数呈先升后降的趋势,且外植体生长状况也出现了由污染到失绿的过程。表明过短或过长的浸泡时间都不利于农杆菌的抑制,且较为适宜的浸泡时间为3 min。

表4 特美汀水溶液浸泡时间对农杆菌的抑制
2.4 不同赤霉素浓度对辣椒遗传转化苗伸长的影响
将产生的不定芽点,接种到表5所示培养基上进行培养。随着赤霉素浓度的增加,其褐化诱导率呈先升后降的趋势,而抗性芽伸长个数则呈下降趋势,而添加赤霉素浓度为0.5 mg/L时抗性芽个数伸长达到最大,为0.23个。得出抗性芽点伸长的赤霉素浓度为0.5 mg/L。

表5 不同赤霉素浓度对辣椒抗性芽伸长的影响
2.5 不同激素组合对辣椒子叶遗传转化苗生根的影响
将伸长至1 cm 左右的不定芽,接种至表6所示的培养基中培养生根。3号培养基的外植体生根率最高,达到52.22%;而1~2号上的全部死亡,差异明显;添加NAA的4~6号培养基,产生大量愈伤组织,影响外植体根系发育;故本实验选用3号培养基用来生根。

表6 辣椒子叶遗传转化苗生根效果
2.6 转基因植株的获得与检测
2.6.1 转基因植株 通过本试验中的卡那霉素,农杆菌侵染时间、最佳侵染时间、特美汀溶液浸泡时间、不定芽伸长等各因素来获得转基因植株,具体内容如图2所示。

图2 不同阶段外植体形态状况
2.6.2 转基因植株结果检测 对获得的46个辣椒单株进行PCR检测,结果有8个单株扩增出与阳性对照相同的条带,转基因比例为17.4%。
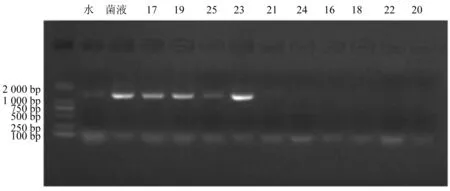
图3 部分转基因辣椒PCR扩增结果图
3 结论与讨论
至今,遗传转化技术已成为获得转基因植物的基本方法,而以农杆菌介导的遗传转化方法在茄科植物中的茄子[12-13]、番茄[14-16]、辣椒[17-19]等已初步取得成功。但由于在辣椒的遗传背景影响较大,目前还存在着一些问题,因此创建一个简洁稳定的辣椒遗传转化体系是很有必要的。本试验以辣椒子叶为外植体,以组织培养再生体系[20-22]为基础来探寻影响辣椒遗传转化的各因素,为下一步外源基因的导入,快速获得辣椒转基因植株,基因功能的研究等创造条件。
在整个遗传转化的过程中,阳性转化的筛选是一个重要的过程。而Kan浓度、农杆菌侵染时间、TMT抑菌时间,芽伸长等都是遗传转化的重要过程。如何选择适宜的Kan浓度来抑制假阳性芽的形成。罗齐军等[23]认为35 mg/L Kan较好,而袁静等[24]则认为50 mg/L Kan对辣椒外植体筛选浓度影响最佳,这与本试验结果相同。适宜的侵染时间也十分重要,若侵染时间过长在后期的培养过程中会出现农杆菌残留,且难以控制导致植株死亡,侵染时间过短菌液与外植体接触不够充分,会降低转化效率导致大量非抗性苗出现;本实验中一定的侵染时间可增强辣椒的再生频率与再生芽效果[25],这与黄妤等[26]的研究大致相同。TMT作为一种新型抑菌剂,可用来抑制农杆菌的发生,这在遗传转化后期添加很有必要。敬国兴等[27]发现,如果浓度过低的TMT也会引起农杆菌的发生造成植株死亡,且用TMT溶液浸泡过后的抑菌效果会更好。植物再生过程中不定芽的伸长是关键,添加赤霉素极为重要,它能使不定芽点得到一定程度的伸长,这与欧阳乐军等[28]研究结果一致。
综上,本实验建立了一个稳定的辣椒遗传转化体系。确定了卡那霉素浓度为50 mg/L,侵染时间为30 min,特美汀溶液浸泡辣椒子叶时间为3 min,不定芽伸长添加赤霉素浓度为0.5 mg/L,使辣椒的遗传转化达到较好效果,为后期的辣椒生物技术育种和基因工程研究提供较好的技术支撑。