红枣多糖的硫酸酯化修饰及其结构特性的研究
2022-08-19符玉霞郭欣魏亚博邓小蓉张建
符玉霞,郭欣,魏亚博,邓小蓉,张建
石河子大学食品学院(石河子 832000)
红枣,又称大枣,鼠李科、枣属植物的成熟果实。作为一种膳食补充剂,红枣是公认的健康食品,含有多种生物活性物质,如蛋白质、氨基酸、维生素、生物碱、皂苷、矿物质和多糖[1]。植物多糖是广泛存在于植物中的天然大分子,由于其独特的特性,近年来在临床上被广泛用于增强机体免疫力、增强机体抗氧化能力、调节机体糖代谢等[2]。红枣多糖是红枣中一种重要的生物活性物质,研究表明红枣多糖具有抗氧化、抗肿瘤、保肝和降血脂等多种生物活性[3],可被广泛用于食品行业和医药行业。
天然植物性多糖的分子修饰是目前研究的热点,对多糖进行不同方法的修饰,可以提高其生物活性,可为保健食品和药物应用提供重要原料[4]。硫酸化修饰是采用化学方法将硫酸基团引入多糖分子结构中,进而使多糖糖链结构中单糖分子的羟基被硫酸基团取代,与天然多糖相比,硫酸化修饰后的多糖生物活性更加广泛和优越[5]。研究表明对洋葱多糖进行修饰,可以显著地提高多糖的抗氧化活性。小分子量的牛膝多糖有免疫增强活性,却无抗病毒活性,经硫酸酯化修饰后,产生较强的抗乙肝病毒活性。
迄今为止,中国已发现7 000多个枣品种,其种植面积超过150万 hm2[6]。随着生活品质的提升和红枣市场规模不断扩大,红枣产品的多样化需求比较明显,这与红枣深加工产业的滞后形成矛盾,因外观不良、未干制加工和腐败变质的红枣浪费严重[7]。另外,由于人们对自由基生物学的兴趣日益浓厚,而对大多数慢性疾病仍然缺乏有效的治疗方法,人们开始研究从植物中提取的天然抗氧化剂对氧化应激相关疾病的治疗效果。通过对红枣多糖的硫酸酯化修饰、结构表征、抗氧化活性的研究,以期提高原有生物活性或增加新活性,扩大多糖利用范围,并应用于功能食品领域,则可实现红枣产业的高值化应用。
1 材料与方法
1.1 材料与试剂
红枣多糖(西安泽郎生物科技有限公司);透析袋(截留分子量8 000~14 000 Da,上海源叶生物科技有限公司);三氧化硫吡啶复合物(酯化剂)、1-苯基-3-甲基-5-吡唑啉酮(5-methyl-2-phenyl-1,2-dihydropyrazol-3-one,PMP)、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF):上海麦克林生化科技有限公司;1, 1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazine,DPPH)、2, 2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)]、抗坏血酸:国药集团化学试剂有限公司;NaOH(天津市鑫铂特化工有限公司);K2SO4(天津市盛傲化学试剂有限公司);聚乙二醇:polyethylene glycol,PEG,艾康生物技术(杭州)有限公司。
1.2 仪器与设备
LC-20AD高效液相色谱仪(杭州赛析科技有限公司);ENK-PRO型酶标仪(美国Bioteck公司);NJF-120-01型扫描电子显微镜(苏州晋松计量仪器有限公司);Nicolet IS 10型傅里叶变换红外光谱仪(美国Thermo公司);HX-10-50B型真空冷冻干燥机(上海圣科仪器设备有限公司);Agilent1260凝胶渗透色谱仪(北京普立泰科仪器有限公司)。
1.3 方法
1.3.1 红枣多糖的硫酸酯化修饰
参考王瑞芳等[8]的方法。称取0.5 g红枣多糖于锥形瓶,磁力搅拌下加入20 mL DMF和10 mL吡啶,搅拌使其充分溶解,加入0.9 g三氧化硫吡啶复合物,放入水浴锅使其反应完全,冷却到室温,用适宜浓度NaOH调节pH到中性,透析72 h,冷冻干燥得到硫酸酯化红枣多糖。
硫酸酯化红枣多糖取代度的测定参考卜丹丹[9]和程浩[10]的方法。分别取0.02,0.06,0.10,0.14,0.18和0.20 mL质量浓度1.0 mg/mL的硫酸钾标准溶液,加1.0 mol/L盐酸补体积至0.5 mL,加入3.5 mL 8%三氯乙酸,分别加入1.0 mL明胶氯化钡溶液和明胶溶液,室温放置20 min,在360 nm处测其吸光度,以硫酸基含量为横坐标,明胶氯化钡溶液与明胶溶液吸光度之差(A1-A2,A1为加氯化钡-明胶溶液后的吸光度;A2为只加明胶溶液后的吸光度)为纵坐标,制作标准曲线。得到标准曲线线性回归方程:y=0.310 6x-0.013 6,R2=0.997 3。
取适量样品于具塞试管,加3 mL浓度为1 mol/L的盐酸,于100 ℃水浴锅水解5 h,待其完全水解,冷却后过滤,取1 mL水解液按照标准曲线制作方法得到(A1-A2),根据标准曲线回归方程计算硫酸基含量(S),取代度按式(1)计算。

式中:DS为硫酸酯化取代度;S为硫酸基的质量分数,%。
1.3.2 红枣多糖结构表征
1.3.2.1 单糖组成
采用高效液相色谱法[11]测红枣多糖各单糖含量。
色谱柱Xtimate C18(4.6 mm×200 mm,5 μm);柱温30 ℃;流速1.0 mL/min;检测波长250 nm:进样量20 μL;流动相为0.05 mol/L磷酸二氢钾溶液(pH 6.70)∶乙腈=83∶17(V/V)。
标准品的制备:精密称取适量甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖、葡萄糖、N-乙酰-氨基半乳糖、半乳糖、木糖、阿拉伯糖、岩藻糖标准品,加水溶解稀释至每1 mL各含50 μg的混合标准品。
标准品的衍生:精密称取250 μL混合标准品,加入250 μL 0.6 mol/L的NaOH溶液和500 μL 0.4 mol/L PMP-甲醇溶液,于70 ℃反应1 h,冷水中冷却10 min,用0.3 mol/L盐酸中和,加入1 mL氯仿旋涡1 min,按3 000 r/min离心10 min,取上清液,萃取3次。上清液进样检测。
待测样品水解与衍生过程:精密称取适量待测样品于10 mL安培瓶中,加入3 mL 2 mol/L的TFA于10 mL安培瓶中,封管,于120 ℃酸解4 h。取出加入甲醇氮吹挥干剩余的TFA,加3 mL水复溶。精密称取250 μL多糖水解液,加入250 μL 0.6 mol/L的NaOH溶液和500 μL 0.4 mol/L PMP-甲醇溶液,于70 ℃反应1 h,冷水中冷却10 min,用0.3 mol/L的盐酸中和,加入1 mL氯仿旋涡1 min,按3 000 r/min离心10 min,取上清液,萃取3次。上清液进样检测。
1.3.2.2 相对分子量的测定
采用凝胶渗透色谱(GPC)法[12]测多糖相对分子量。
色谱柱Waters Ultrahydrogel(7.8 mm×300 mm),柱温30 ℃,流动相为超纯水;流速1 mL/min;进样量10 μL;检测器,RID-20示差折光检测器;标准品,聚乙二醇。
测试方法:将样品溶于流动相,配制成1 mg/mL溶液,使用0.43 μm滤膜过滤,进样测试。进样量10 μL,流速1 mL/min。
1.3.2.3 傅里叶红外光谱(FTIR)
分别称取适量羧甲基化修饰前后的红枣多糖,加入适量KBr粉末研磨均匀,压片处理,分析4 000~500 cm-1波数下红外光谱图。
1.3.2.4 原子力显微镜分析
将1 mg多糖溶解在1 mL超纯水中,在室温下连续搅拌4 h。将溶解完全的样品滴到云母载玻片上,待其干燥,进行测样。
1.3.2.5 热重分析
分别称取10 mg多糖,温度由室温升高到800 ℃,进行热重(TG)分析。横坐标作为温度,纵坐标作为质量,绘制热重曲线。
1.3.2.6 刚果红试验
参考胡月[13]的方法。各称5 mg多糖于6支试管中,分别加2 mL蒸馏水用以溶解完全,加入2 mL浓度80 μmol/L的刚果红溶液,分别加入2 mL不同浓度(0,0.1,0.2,0.3,0.4和0.5 mol/L)NaOH溶液,混合体系在室温下反应25 min后,用紫外分光光度计在200~600 nm范围内扫描得到最大吸收波长(λmax),横坐标为NaOH的浓度,纵坐标为最大吸收波长(λmax),绘制曲线。
1.3.3 抗氧化活性测定
1.3.3.1 DPPH自由基清除活性
配制质量浓度0.04 mg/mL的DPPH溶液和不同质量浓度(1,2,3,4和5 mg/mL)修饰前后红枣多糖溶液。试管中依次加入2 mL DPPH溶液和2 mL不同浓度的红枣多糖溶液,摇匀,室温放置30 min,测定其在517 nm处的吸光度,蒸馏水为空白对照,计算清除率(S,%)[14]。

式中:A1为反应液的吸光度;A2为不加DPPH时多糖液自身的吸光度;A0为空白对照DPPH溶液加蒸馏水的吸光度。
1.3.3.2 ABTS自由基清除活性
准确称取0.038 4 g ABTS定容到10 mL,准确称取0.013 4 g过硫酸钾定容至10 mL,二者按1∶1(V/V)混合,避光保存12 h得到ABTS溶液,稀释到吸光度为0.7待用。取不同浓度(1,2,3,4和5 mg/mL)红枣多糖溶液。试管中依次加入2 mL ABTS溶液和2 mL不同浓度的红枣多糖溶液,摇匀,室温放置10 min,测定其在734 nm处的吸光度,以无水乙醇为空白对照,计算清除率[15](S,%)。

式中:A1为反应液的吸光度;A2为不加ABTS时多糖液自身的吸光度。
2 结果与讨论
2.1 结构表征
2.1.1 单糖组成
图2是未修饰红枣多糖单糖组成液相色谱图。根据峰面积和出峰时间对比单糖标准品液相色谱图(图1),可以确定红枣多糖由1-甘露糖、2-核糖、3-鼠李糖、4-葡萄糖醛酸、5-半乳糖醛酸、6-葡萄糖、7-半乳糖、8-木糖、9-阿拉伯糖、10-岩藻糖组成,说明红枣多糖是一类组成复杂、结构多样的杂多糖[16]。从表1可以得到,红枣多糖主要是由葡萄糖、葡萄糖醛酸和阿拉伯糖组成,占比分别为96.243%,1.269%和1.064%。

图1 单糖标准品液相色谱图

图2 红枣多糖单糖液相色谱图
图3是硫酸酯化修饰的红枣多糖单糖组成液相色谱图。由图3可知,硫酸酯化修饰红枣多糖主要由10种单糖组成,它们是1-甘露糖、2-核糖、3-鼠李糖、4-葡萄糖醛酸、5-半乳糖醛酸、6-葡萄糖、7-半乳糖、8-木糖、9-阿拉伯糖、10-岩藻糖。由表2得,硫酸酯化修饰的红枣多糖主要也是由葡萄糖、葡萄糖醛酸和阿拉伯糖组成的,只是占比与未修饰的红枣多糖不同,分别为96.064%,1.426%和0.938%。结合表1和表2,研究发现未修饰的红枣多糖和硫酸酯化修饰的红枣多糖单糖组分一样,只是各自含量不同。

表1 红枣多糖单糖组成

表2 硫酸化多糖单糖组成

图3 硫酸酯化红枣多糖单糖液相色谱图
2.1.2 相对分子量的测定
图4是未修饰和硫酸酯化修饰红枣多糖高效糖凝胶渗透色谱图。可以看出,红枣多糖峰比较对称单一,说明红枣多糖纯度较高,且分子量分布宽度较小,说明均一性较好[17],多糖的分子量具有相对性,通常所测定的分子量只是一种统计平均值,代表相似链长的平均分布。GPC法测得的未经修饰的红枣多糖的相对分子量为4.865×103Da,硫酸酯化修饰过的红枣多糖相对分子量为7.426×103Da,这可能是因为硫酸酯化修饰引入硫酸基团,使得红枣多糖的分子量增大。

图4 高效凝胶渗透色谱图
2.1.3 傅里叶红外光谱分析
图5为硫酸酯化修饰和未修饰的红枣多糖在4 000~500 cm-1波长范围内的光谱图。3 371.38 cm-1和3 376.70 cm-1是O—H的拉伸振动引起,表明红枣多糖存在分子内氢键。2 921.99 cm-1和2 919.66 cm-1是C—H不对称伸缩振动引起的[18-19],1 720.41 cm-1和1 656.53 cm-1是由酯或羧基中C=O的拉伸振动引起的,表明可能存在糖醛酸或乙酰基[20]。1 411.81 cm-1是对称C—O拉伸振动和C—H耦合作用引起的,1 155.29 cm-1和1 157.06 cm-1是C—O—H和C—O—C结构产生振动吸收引起的。1 024.14 cm-1和1 029.78 cm-1为—OH的O—H变角振动,919.99 cm-1和921.79 cm-1为α-吡喃糖的吸收峰。852.49 cm-1为β-吡喃糖的吸收峰,由此推测红枣多糖是α-和β-构型共存的吡喃型甘露糖苷杂多糖[21]。783.05 cm-1和755.95 cm-1是吡喃型特征吸收峰。1 250 cm-1附近是S=O的不对称伸缩振动,810 cm-1附近是C—O—S伸缩振动,修饰后—OH特征吸收峰明显减弱,说明—OH基团被取代。综上所述,红枣多糖硫酸酯化修饰成功。
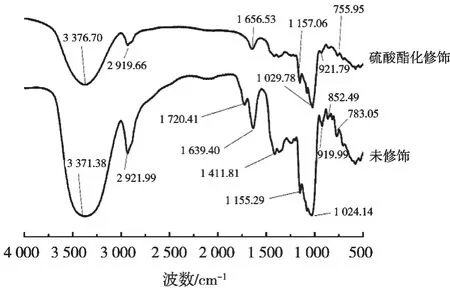
图5 红外光谱图
2.1.4 分子形态学分析
图6是红枣多糖原子力显微镜图,a和b是未修饰的红枣多糖的相图和3D图,a1和b1是硫酸酯化修饰多糖的相图和3D图。从原子力显微镜可以观察多糖分子形貌、网状结构、表面粗糙度及黏弹性,球体、随机线性链和带有分枝和棒状的随机链是常见的植物多糖构象[22]。如图6(a)所示,未修饰的红枣多糖分子排列疏松,颗粒大小不均一,有明显凸起,表面呈颗粒状。图6(a1)中分子排列较密集,颗粒较小且较均一,表面比较平整。图6(b)和(b1)均呈分支状,图6(b1)分支形态大小均一,图6(b)分支分支不均一,这可能是因为硫酸酯化修饰取代多糖中部分羟基,羟基数目减少,多糖分子间的缔合作用减弱,有效降低了多糖的聚合程度,有利于观察多糖的真实形态[23]。

图6 原子力显微镜
2.1.5 热重分析
图7是未修饰和硫酸酯化修饰的红枣多糖热稳定性分析曲线。未修饰和硫酸酯化修饰红枣多糖热降解过程分4个阶段:从室温分别到175和100 ℃为降解的第1阶段,约有9.98%和8.50%的质量损失,主要是由于水分的流失;第2阶段是多糖聚合物的降解,初始降解温度为242和273 ℃,质量损失为22.28%和23.54%;第3阶段约为280~450和316~483 ℃,温度为455和500 ℃时,质量损失率为97.68%和96.56%;在第4阶段,随着温度增高,2组多糖样品就形成碳化结构[24]。从热重分析曲线发现,硫酸酯化修饰的红枣多糖热稳定性更好一些,说明硫酸酯化修饰可以提高多糖热稳定性。
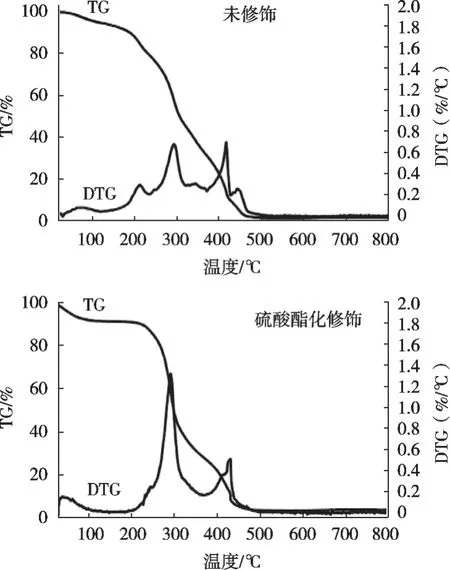
图7 热重分析曲线
2.1.6 刚果红试验分析
刚果红是一种酸性染料,可以与含有三螺旋结构的多糖形成络合物,络合物的最大吸收波长同刚果红相比发生红移,NaOH浓度大于某一数值后,最大吸收波长急剧下降[25]。如图8所示,随着NaOH浓度增大,未修饰和硫酸酯化修饰的多糖最大吸收波长都与刚果红相似,呈现逐渐降低的趋势,并未发生红移现象和急剧下降趋势,所以未修饰和硫酸酯化修饰的多糖都不具备三螺旋结构,硫酸酯化修饰不影响红枣多糖三螺旋链状结构。

图8 刚果红试验
2.1.7 抗氧化活性测定
图9显示红枣多糖对DPPH自由基的清除能力。随着浓度的增大,未修饰和硫酸酯化修饰的红枣多糖对DPPH自由基都有较强的清除作用,并且清除能力随着多糖浓度的增大而逐渐加强,呈现剂量依赖性。此外,硫酸酯化修饰后的红枣多糖的清除能力远高于未修饰多糖,随多糖浓度的增加,羧甲基化修饰的红枣多糖对DPPH自由基的清除作用显著增大。质量浓度为5 mg/mL时,清除率达到84.70%,未修饰的红枣多糖清除率为53.85%。结果表明,硫酸酯化修饰可以显著提高红枣多糖对DPPH自由基的清除作用,这可能是由于新基团硫酸基团的引入,抗氧化活性随之增大。

图9 红枣多糖对DPPH的清除作用
图10显示红枣多糖对ABTS自由基的清除能力。随着浓度的增大,未修饰和硫酸酯化修饰红枣多糖对ABTS自由基都有较强的清除作用,并且清除能力随着多糖浓度增大而逐渐加强,呈现剂量依赖性。硫酸酯化修饰后的红枣多糖的清除能力远高于未修饰多糖,随多糖浓度的增加,硫酸酯化修饰红枣多糖对ABTS自由基的清除作用显著增大。质量浓度为4 mg/mL时,清除率达到98.31%,未修饰的红枣多糖清除率为48.05%。结果表明,硫酸酯化修饰可以显著提高红枣多糖对ABTS自由基的清除作用,这可能是因为硫酸酯化修饰,改变了多糖结构,多糖分子量增大,单糖各组分含量发生变化。

图10 红枣多糖对ABTS的清除作用
3 结论
红枣多糖通过三氧化硫-吡啶法,得到取代度较高的硫酸酯化红枣多糖,通过高效液相色谱法测得未修饰和硫酸酯化修饰后的红枣多糖都由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖组成,只是含量不同,主要成分都是葡萄糖、葡萄糖醛酸和阿拉伯糖,未修饰的占比为96.243%,1.269%和1.064%,硫酸酯化修饰的占比为96.064%,1.426%和0.938%。凝胶渗透色谱法试验发现,未修饰和修饰后的红枣多糖相对分子量相差较大,这可能是因为硫酸酯化修饰后,引入硫酸基团,导致其相对分子量发生变化,从而改变其抗氧化活性。红外光谱分析表明,红枣多糖硫酸酯化修饰成功,修饰后红枣多糖的O—H峰明显减弱。原子力显微镜表明,修饰后的红枣多糖排列较密集,颗粒较小且较均一,表面比较平整。热重分析说明硫酸酯化修饰可以提高多糖热稳定性。刚果红试验表明未修饰和硫酸酯化修饰的多糖都不具备三螺旋结构,硫酸酯化修饰不影响红枣多糖三螺旋链状结构。抗氧化试验表明,硫酸酯化修饰可以显著提高多糖对DPPH和ABTS自由基的清除率。
