基于Gd-EOB-DTPA增强MRI的小肝癌微血管侵犯术前预测研究
2022-08-12陈凤喜张瀚丹李晓明陆军军医大学第一附属医院放射科重庆400038
陈凤喜,蔡 萍,刘 晨,王 健,张瀚丹,王 芳,李晓明 (陆军军医大学第一附属医院放射科,重庆 400038)
小肝癌一般指单个癌结节最大直径≤3 cm的肝细胞癌[1]。随着影像检查技术的发展,小肝癌的早期检出率也越来越高,但仍有18%~37%的患者于切除术后出现复发[2-3],而复发主要与术前存在微血管侵犯(microvascular invasion,MVI)相关[4]。手术切除和射频消融是小肝癌的常规治疗手段,研究表明射频消融可能不适用于MVI阳性的小肝癌患者[2],而采用宽切缘或解剖性肝切除则会改善小肝癌伴MVI阳性患者的生存预后[5]。因此,术前预测MVI将有助于临床选择合适的治疗方案。目前基于钆塞酸二钠(gadolinium-ethoxybenzyl-diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)增强MRI多模态序列[6-7]和影像组学[2]预测小肝癌患者MVI的发生已有报道,然而单纯依靠肉眼影像学特征或单个序列影像组学特征构建的模型相对单一,诊断效能差异大。因此,本研究拟基于Gd-EOB-DTPA增强MRI多模态序列、多维度参数构建临床—影像学特征模型、影像组学特征模型以及多模态融合模型,并比较3种模型预测小肝癌MVI发生的效能。
1 资料与方法
1.1 临床资料
从我院大数据中心搜索2017年6月至2019年12月经术后病理证实为小肝癌患者的临床资料。纳入标准:①临床资料完整;②术前1个月内行Gd-EOB-DTPA增强MRI检查;③单个小肝癌病灶;④无大血管侵犯;⑤MVI经术后病理证实。排除标准:①术前接受过肝癌切除、介入治疗、放化疗、肝移植等其他治疗;②Gd-EOB-DTPA增强MRI图像质量差。共纳入174例患者,其中男146例,女28例;年龄(51.0±9.9)岁;按照7∶3的比例随机划分数据集,训练组122例,验证组52例。分析2组中MVI阳性和阴性患者性别、肝硬化、乙型病毒性肝炎、甲胎蛋白(alpha fetoprotein,AFP)、瘤内出血、瘤内脂肪、肿瘤形态、肝胆期(hepatobiliary phase,HBP)瘤周低信号、动脉期瘤周强化、肿瘤大小、肿瘤假包膜、年龄、中性粒细胞、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素、白蛋白、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)。本研究经陆军军医大学第一附属医院医学伦理审查委员会批准(KY2020086)。
1.2 图像采集
所有患者采用Siemens Trio Tim 3.0T(西门子公司,德国),经肘静脉注射0.1 mL/kg的Gd-EOB-DTPA,速度为1.0 mL/s,MRI增强扫描前序列包括定位像,半傅里叶采集单次激发快速自旋回波序列冠状位、矢状位,化学位移成像及三维容积内插快速梯度回波平扫。MRI动态增强扫描,当对比剂到达胸主动脉下段水平,患者屏气行动脉期扫描,门静脉期(portal venous phase,PVP)扫描延时70 s,平衡期扫描延时180 s,HBP扫描延时15 min。
1.3 图像处理和分割
所有图像均经2名分别有5年和10年腹部诊断经验的放射科医师进行审阅并确认病灶,同时评估小肝癌影像学特征,包括:肿瘤大小,在轴位HBP序列测量病灶最大径;肿瘤形态,在HBP序列观察病灶形态,圆形或椭圆形为肿瘤形态规则,肿瘤周边有萌芽,部分呈分叶状为肿瘤形态不规则;动脉期瘤周强化,即动脉期图像上肿瘤周围可见类似火焰状或不规则形强化;肿瘤假包膜,即门静脉期或移行期肿瘤周围环形高强化区;HBP瘤周低信号,即肿瘤周围楔形或不规则形低信号;瘤内出血,即T1WI序列瘤内高信号,SWI序列呈低信号;瘤内脂肪,即反相位序列瘤内存在信号丢失。所有肿瘤灶的感兴趣区(volume of interest,VOI)由1名放射科医师分别在T2WI、PVP和HBP序列上进行手工勾画,然后由另1名有10年腹部诊断经验的放射科医师仲裁,若意见不一致,则由2名医师讨论后决定。
1.4 特征降维和模型建立及验证
利用人工智能平台进行影像组学特征数据分析。采用方差阈值法对1 409个影像组学特征进行数据预处理,先筛选特征方差大于0.8的特征,随即采用单变量选择法,保留与MVI不同状态之间存在显著相关性的特征;再利用10折交叉验证的最小绝对收缩算子(least absolute shrinkage and selection operator,LASSO)算法,筛选出最佳的预测特征集。
采用非线性支持向量机(support vector machine,SVM)建立MVI预测模型,包括临床—影像学特征模型、影像组学特征模型(T2WI、PVP和HBP的单序列和组合序列影像组学特征模型)、多模态融合模型(临床—影像学特征—影像组学特征综合预测模型)。所有模型均在训练组中进行训练,并于验证组中进行独立验证。采用受试者工作特征(receiveroperatingcharacteristic,ROC)的曲线下面积(areaunderthecurve,AUC)、敏感度、特异度、准确度和F1值评价模型对MVI的预测效能,并采用Delong检验对不同模型的ROC进行比较。
1.5 统计学分析
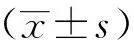
2 结果
2.1 临床—影像学特征分析结果
本研究174例患者中,59例(30.1%)MVI阳性,115例(69.9%)MVI阴性。训练组中MVI阴性和MVI阳性患者间肿瘤形态、HBP瘤周低信号、动脉期瘤周强化、肿瘤假包膜、APTT比较,差异有统计学意义(P<0.05);验证组MVI阴性和MVI阳性患者间肿瘤形态、肿瘤假包膜比较,差异有统计学意义(P<0.05),见表1。
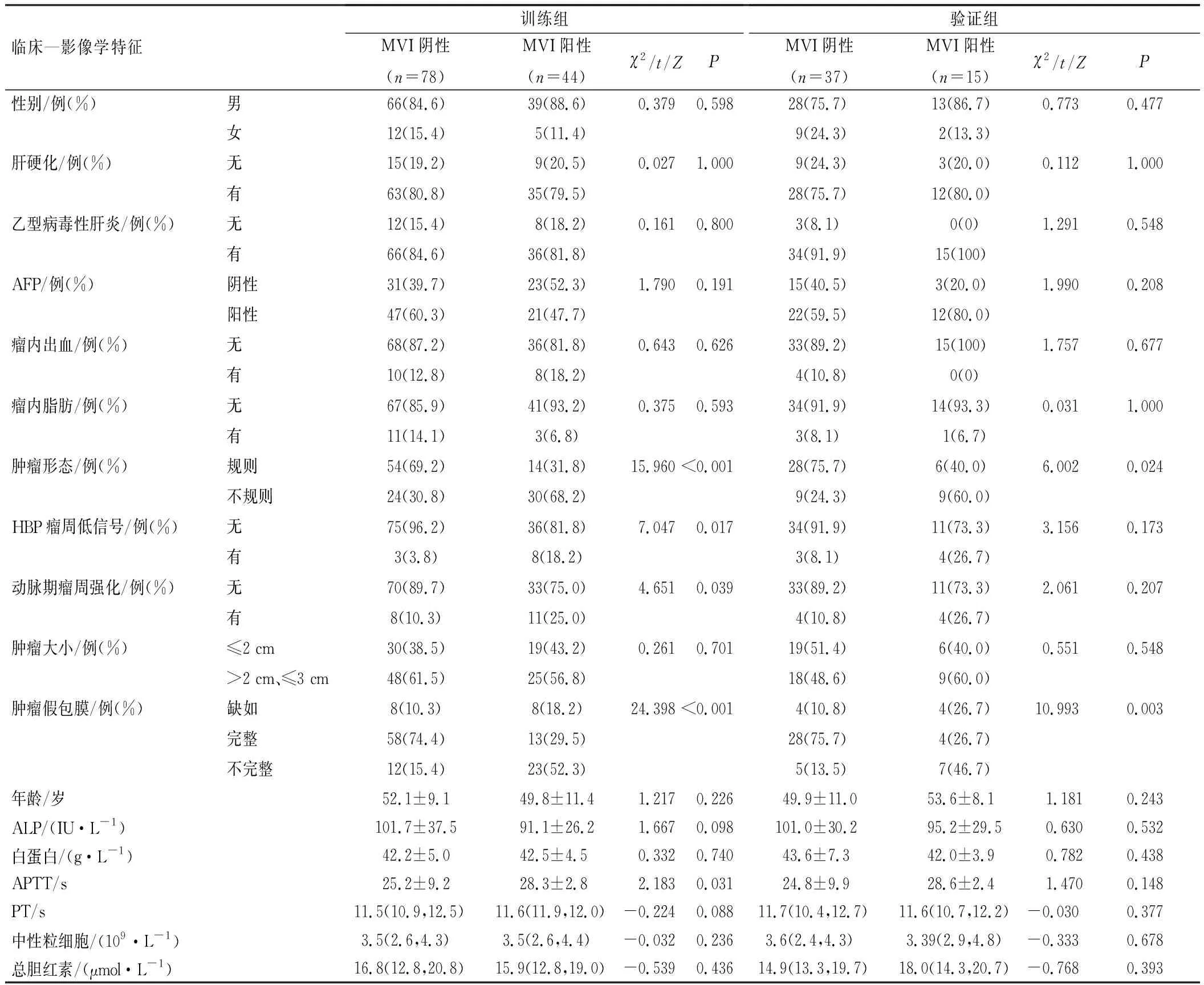
表1 小肝癌患者的临床—影像学特征
2.2 临床—影像学特征与影像组学特征筛选结果
利用LASSO算法进行临床—影像学特征降维后,筛选出与MVI相关的7个最重要的临床—影像学特征,包括ALP、PT、APTT、中性粒细胞、肿瘤假包膜、肿瘤形态、HBP瘤周低信号,其中肿瘤形态、HBP瘤周低信号LASSO系数远大于其他指标,提示这两个指标对预测MVI具有较高的价值(图1)。
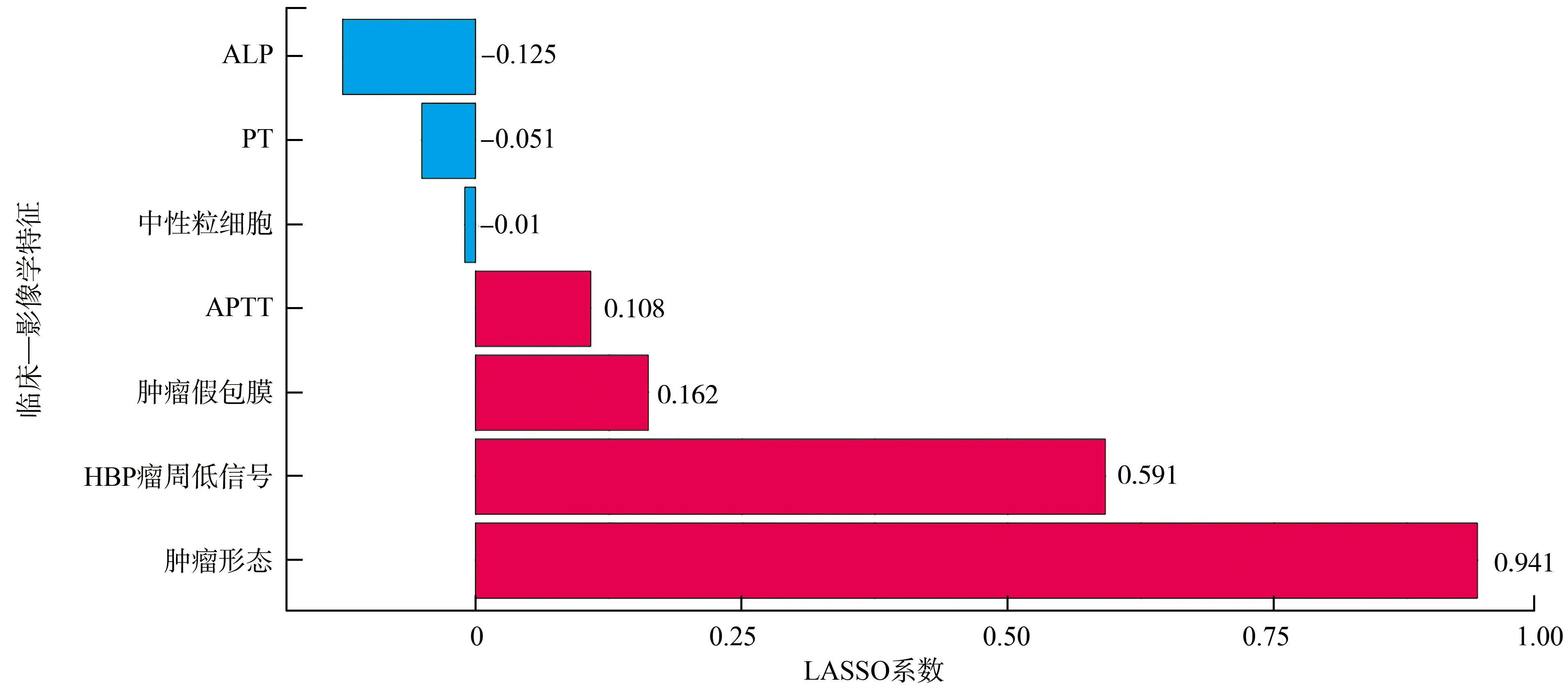
图1 LASSO算法降维后与MVI相关的临床—影像学特征
PVP+HBP组合序列预测MVI的效能最佳(AUC=0.654),见表2。一阶特征、形状特征和纹理特征降维后,最终筛选出18个影像组学特征,包括11个PVP特征(2个一阶特征、1个形状特征、8个纹理特征)和7个HBP特征(3个一阶特征、4个纹理特征),见表3。
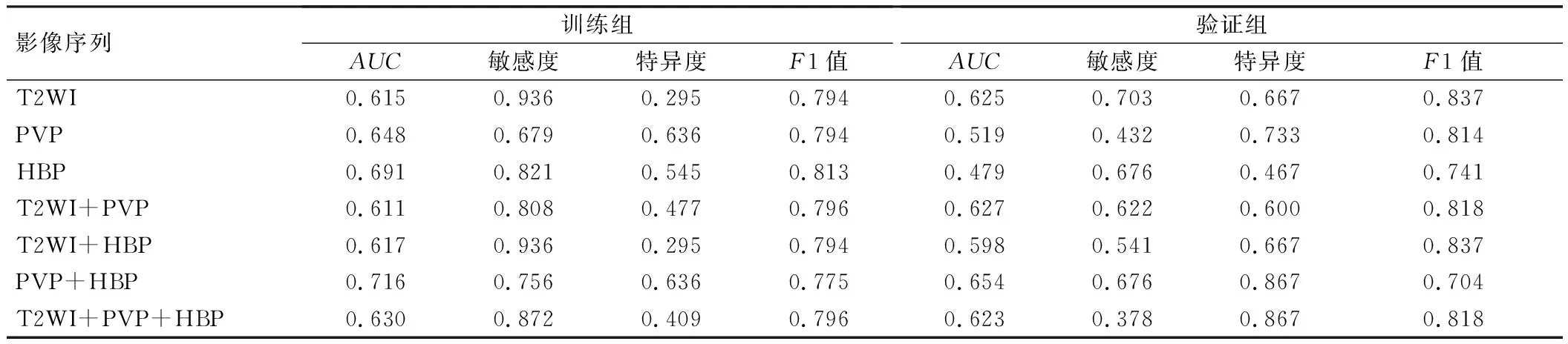
表2 训练组和验证组单序列和组合序列的ROC曲线分析
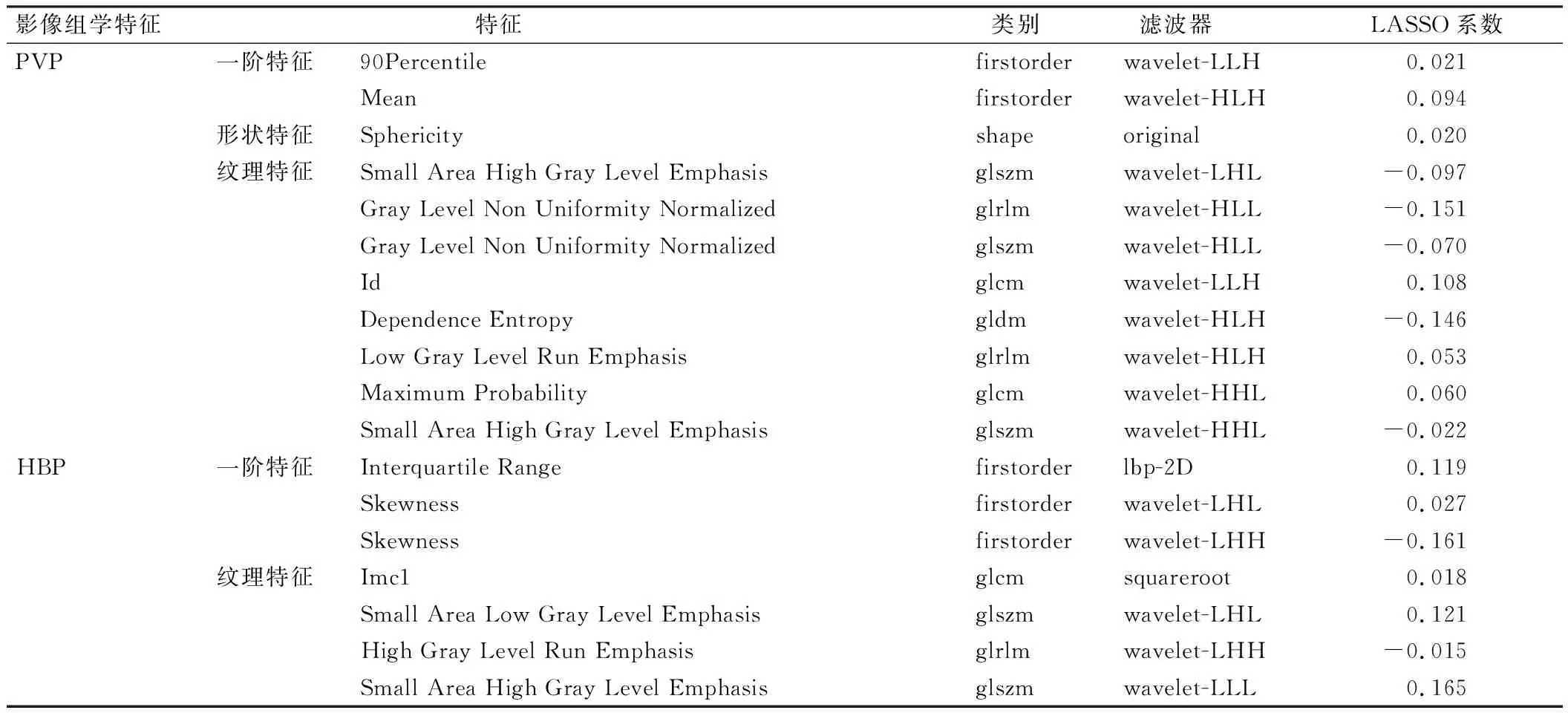
表3 PVP+HBP组合序列的影像组学特征筛选结果
2.3 基于临床—影像学特征、影像组学特征建立的MVI预测模型及模型预测效能对比
验证组结果显示,临床—影像学特征模型预测MVI的效能最佳,AUC、准确度和F1值分别为0.748、0.846和0.868;而影像组学特征模型预测MVI的效能较差,AUC、准确度和F1值分别为0.654、0.735和0.704。Delong检验结果显示,临床—影像学特征模型的ROC诊断结果优于影像组学特征模型(P<0.05),但临床—影像学特征模型与多模态融合模型的ROC诊断结果比较差异无统计学意义(P>0.05),见表4、图2。
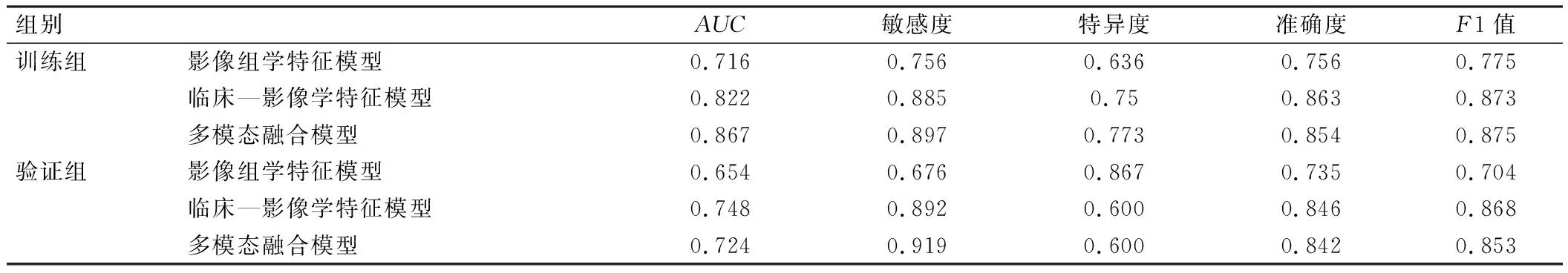
表4 影像组学特征模型、临床—影像学特征模型和多模态融合模型的ROC分析
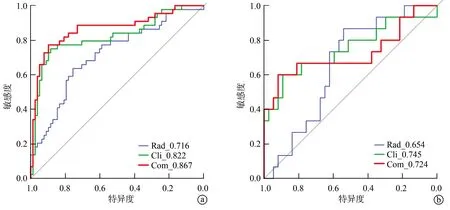
a:训练组ROC曲线;b:验证组ROC曲线 Rad:影像组学特征模型;Cli:临床—影像学特征模型;Com:多模态融合模型图2 基于SVM的MVI预测模型ROC曲线
3 讨论
本研究旨在从大量临床数据和基于Gd-EOB-DTPA增强MRI的影像数据中建立一种高效的术前小肝癌MVI预测模型,结果显示,基于临床—影像学特征构建的模型能够有效预测小肝癌术前MVI状态(AUC为0.748),包括ALP、中性粒细胞、PT、APTT、肿瘤假包膜、肿瘤形态、HBP瘤周低信号7个指标,其中肿瘤形态、HBP瘤周低信号预测MVI的LASSO系数远大于其他指标,预测价值较高,这与以往文献报道一致[8-10]。本研究中肿瘤假包膜预测MVI的权重较低,目前关于假包膜预测MVI的价值仍存争议[10-11],可能原因为PVP或移行期假包膜容易被肿瘤组织掩盖,导致假包膜检出率降低[12]。本研究中ALP、中性粒细胞、PT、APTT异常是导致MVI发生的危险因素,这与文献报道一致[13-16]。ALP和中性粒细胞水平发生改变时,肿瘤生长的微环境也可能改变,进而促进癌细胞的增殖、侵袭,血管生成以及肿瘤转移;但PT和APTT异常是如何介导MVI的发生目前尚未明确。有研究发现凝血参数与实体肿瘤的预后存在相关性,但其机制非常复杂,可能涉及高龄、肿瘤炎症活动等原因,出现凝血和炎症失衡可能会促进肿瘤侵袭性生长[16]。
多项研究发现T2WI、PVP序列预测MVI的效能最佳[17-19],HBP肿瘤与周围肝实质可形成良好的对比[20-21]。因此,本研究基于T2WI、PVP、HBP序列构建影像组学特征模型,但验证组中该模型AUC仅为0.654,效果不太理想,与以往文献报道[22-23]差异较大,原因可能为本研究主要针对小肝癌患者,且样本量较小,数据分布可能不平衡;且本研究病灶VOI勾画软件与其他文献不同,也可能对结果有一定的影响。本研究仅分析了瘤区域影像组学特征,未纳入瘤周1~2 cm影像组学特征进行分析。目前关于瘤周影像组学特征预测MVI的效能仍存争议,有学者认为瘤内影像组学特征预测MVI的效能优于瘤周,若将瘤内和瘤周影像组学特征模型相结合,预测效能反而会下降[22]。
本研究对影像组学、临床—影像学特征及多模态融合模型进行对比发现,在验证组中,临床—影像学特征模型诊断效能(AUC为0.748)高于影像组学特征模型(AUC为0.654),多模态融合模型诊断效能(AUC为0.724)反而低于临床—影像学特征模型,表明相对于临床—影像学特征模型,多模态融合模型在预测MVI发生方面并无显著优势,通过临床—影像学特征即可较好地判断小肝癌患者是否存在MVI,同时也间接表明影像组学特征模型在预测MVI上未能提供额外的附加价值,这与Xu等[23]的研究结果一致。我们认为,影像组学虽已成为研究热点,但是尚处于初步阶段,可重复性较差,多数研究结果存在过拟合,构建的模型泛化能力较差,其临床应用仍面临巨大挑战。
本研究为单中心回顾性分析,样本量较小,缺乏外部验证数据,日后应收集多中心数据、扩大样本量以提高模型的预测效能,此外,本研究所有病灶均为人工手动勾画,对病灶边缘的勾画可能存在一定的人为误差,未来将利用深度学习技术自动提取肿瘤内部纹理特征,以更加客观地预测小肝癌的生物学行为。
综上所述,基于Gd-EOB-DTPA增强MRI构建的临床—影像学特征模型能够较好地预测小肝癌MVI的发生,其效能优于影像组学特征模型,有助于临床制定合适的诊疗方案。