α-细辛醚通过调控NLRP3通路保护氧糖剥夺/再灌注损伤BV2细胞的研究
2022-08-08徐飞飞王立有管雅琪李钦青田雅娟楚世峰贺文彬
徐飞飞,崔 恺,王立有,管雅琪,刘 铭,李钦青,田雅娟,楚世峰,贺文彬
(1.山西中医药大学,中医脑病学山西省重点实验室,山西 太原 030619;2.中国医学科学院药物研究所,北京 100050)
随着国家经济水平的不断发展,国民生活方式的改变以及高压的生活节奏,在对近30年(1990—2017年)来影响中国人疾病负担以及风险因素的大型分析中,脑卒中死亡率逐年升高,成为国民死亡的第一病因,严重威胁国民健康水平[1]。脑卒中(cerebral stroke),又称中风,包括出血性卒中和缺血性卒中,临床称之为脑出血和脑梗死。其中缺血性脑卒中占脑卒中比例约为85%。缺血性脑卒中病因复杂、诱因多,溶栓治疗和神经保护治疗是目前临床常用的两类治疗方法,但均无明显疗效。此外,溶栓治疗后会诱导脑缺血部位继发性损伤,使脑损伤更为严重[2]。
缺血性脑卒中是由于血管堵塞促使血流供应不足诱导的脑血管性疾病,因此中医临床常用活血药和开窍药作为主要治疗药物。其中,已有研究表明,开窍药石菖蒲挥发油中的活性物质α-和β-细辛醚在改善缺血性脑卒中诱导的脑损伤中发挥了明显作用[3-4]。石菖蒲(AcorustatarrinowiiSchott)来源于多年生草本植物石菖蒲的干燥根茎,其性辛,味苦,温,归胃、心经,具有化湿开胃、豁痰镇咳、醒神益智等功效。石菖蒲化学成分多样,包括挥发油、有机酸、萜类、黄酮以及氨基酸等成分。虽然挥发油仅占石菖蒲化学成分的0.7%~1.3%,但它是石菖蒲发挥药理作用的有效成分。体内外研究发现,石菖蒲挥发油中β-细辛醚和α-细辛醚在神经系统疾病中有重要药理活性,尤其在体内实验中发现,β-细辛醚和α-细辛醚凭借其挥发油特性,能快速通过血脑屏障发挥作用。β-细辛醚和α-细辛醚互为同分异构体,药代动力学研究发现β-细辛醚在机体内约22%可转变为α-细辛醚(顺式结构转变为反式结构),使得β-细辛醚的药理作用变得不明确。已有研究表明,α-细辛醚具有保护心脑血管细胞、抑制血小板聚集、降血脂等多种药理活性及特点,这在防治脑血管疾病中具有重要意义[5-6]。
炎性反应作为缺血性脑卒中级联反应中重要部分,在整个脑损伤过程中起到关键作用。炎性因子的过度释放能够诱导白细胞聚集,上调黏附因子阻塞微血管造成血管内皮细胞损伤,大量氧自由基释放,从而引起氧化应激。在炎性反应与氧化应激的双重作用下,血脑屏障破坏,脑组织含水量增多,加重脑损伤[7]。小胶质细胞作为脑内重要的免疫细胞,在脑损伤后迅速激活,释放炎性因子进行组织修复;但过度激活后炎性因子释放过量,导致炎性级联反应的不断发生。小胶质细胞激活后能够向M1型与M2型极化,过度激活的小胶质细胞其M1型极化率不断增加,促进炎性反应的发生,研究发现调节小胶质细胞M1型和M2型极化率能够明显降低脑缺血/再灌注造成的损伤。白细胞介素(interleukin,IL)是由免疫细胞分泌的一类炎症相关细胞因子,其中IL-1β和IL-18是M1型小胶质细胞的分泌性标记物,NOD样受体家族3(NOD-like receptors 3,NLRP3)炎性小体作为这两种促炎因子重要的上游蛋白,调控其成熟与释放。核因子-κB(nuclear factor-kappa B,NF-κB)通路作为IL-1β和IL-18双向调节通路之一,其磷酸化能够也能够调节NLRP3的活化。已有研究证实,α-细辛醚能够抑制钙超载及其诱导的兴奋性神经毒性,还能够阻断NF-κB激酶的降解途径抑制NF-κB信号通路,进而减轻小胶质细胞介导的神经炎症,降低了促炎介质肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β的产生[8-9]。本研究主要以氧糖剥夺/再灌注(oxygen and glucose deprivation/referfusion,OGD/R)建立脑缺血/再灌注损伤模型,通过测定小胶质细胞极型转化及相关炎性蛋白的表达,评价α-细辛醚对脑缺血/再灌注损伤的小胶质细胞的保护作用机制。
1 材料与方法
1.1 材料与仪器小鼠小胶质瘤细胞株(BV2),购自中国医学科学院基础医学研究所细胞资源中心。α-细辛醚(MXUO-AAQ4),中国食品药品检定研究院;连二亚硫酸钠(分析纯),天津市恒兴化学试剂制造有限公司;DMEM高糖培养基(8020251)、胎牛血清(10099141),赛默飞世尔生物化学制品(北京)有限公司;无糖Earle’s平衡盐液(G20609),上海源培生物科技股份有限公司;10×电转液(D1060)、20× TBST缓冲液(T1082)、5×Tris-甘氨酸电泳缓冲液(T1070),北京索莱宝科技有限公司;胰蛋白酶(15H25C15)、蛋白酶抑制剂PMSF(15H14B78)、磷酸酶抑制剂混合物(14L09A83)、增强型RIPA裂解液(15I11B02)、羊抗兔IgG(BA1052)武汉博士德生物工程有限公司;p-NF-κB(SAB4301496)、NF-κB(SAB4502615)抗体,Sigma-Aldrich公司;TNF-α(183218)、TGF-β1/2(ab124894)、NLRP3(ab263899)、caspase 1(ab207802)、β-actin(ab8226)抗体,英国Abcam公司。SDS-PAGE凝胶试剂盒(15L15B38)、CCK-8试剂盒(15I28C60)、BCA蛋白浓度测定试剂盒(15F08A46)、特超敏ECL化学发光即用型底物(15I08A97),武汉博士德生物工程有限公司;IL-1β(MU30369)、IL-18(MU30380)、IL-10(MU30055)、IL-4(MU30385)ELISA试剂盒,武汉贝茵莱生物科技有限公司;ROS试剂盒,上海酶联生物科技有限公司。VERSA max酶标仪(BNRO5709),上海美谷分子仪器有限公司;高速冷冻离心机(Heraeus Multifuge X1R),赛默飞世尔科技公司;全自动多色荧光及化学发光凝胶成像系统(ChampChemi Professional),北京赛智创业科技有限公司;电泳仪(DYY-6D),北京六一生物科技有限公司;电转仪(TE77XP),豪沃生物科技(上海)有限公司。
1.2 方法
1.2.1细胞培养 BV2细胞用含10%胎牛血清(FBS)DMEM高糖培养基常规条件下(37 ℃、5 % CO2、饱和湿度、无菌条件)传代培养。生长状态良好后调整细胞密度约2×108L-1,取对数生长的BV2细胞接种于96孔板中培养24 h,以备药物剂量筛选及模型建立方法对比。
1.2.2细胞给药剂量及模型建立方法筛选 将细胞随机分为正常组、α-细辛醚组(1、2、4、8、16 μmol·L-1)。各组细胞弃去废液后,PBS清洗2遍,正常组细胞每孔加完全培养基100 μL,α-细辛醚组细胞每孔加含药培养基100 μL,培养2 h。以CCK-8试剂盒检测各组细胞活力,读取吸光度值(OD值)进行统计分析筛选出合适药物浓度。
本研究采用化学诱导法损伤BV2细胞。氧化代谢抑制剂主要选择保险粉(连二亚硫酸钠,Na2S2O4),无糖培养基选择无糖厄尔平衡盐溶液,又称无糖Earle’s液(Earle's BSS,EBSS)。配制10、20、30 μmol·L-1剂量的含Na2S2O4无糖Earle’s液。避光条件下用无糖Earle’s液洗细胞2次,加入含Na2S2O4无糖Earle’s液处理,即为氧糖剥夺(OGD)。后换回含血清的DMEM培养基继续培养,即为再灌注(referfusion,R),整个过程可模拟动物实验中脑缺血/再灌注损伤模型,称为氧糖剥夺/再灌注模型(OGD/R)。筛选构建OGD/R细胞模型合适的氧糖剥夺时间和再灌注时间,以及氧化代谢抑制剂Na2S2O4的剂量大小。首先取对数生长的BV2细胞接种于96孔板,细胞密度约2×108L-1,24 h后,以行或列为单位将细胞随机分为6组,分别选取含有10、20、30 μmol·L-1剂量Na2S2O4的无糖Earle’s液对BV2细胞进行处理,处理时间(即氧糖剥夺时间)分别选取2 h和4 h,再灌注时间分别选取0、12和24 h。模型建立完成后由CCK-8试剂盒检测各筛选条件下BV2细胞活力,选择合适的Na2S2O4剂量及氧糖剥夺时间和再灌注时间,确定模型建立方法。
将对数生长的BV2细胞接种于96孔板24 h后,将细胞随机分正常组、OGD/R组、α-细辛醚低、中、高剂量组(1、4、16 μmol·L-1);再以10 μmol·L-1Na2S2O4建立OGD/R模型,先将含有α-细辛醚的完全培养基预处理BV2细胞,2 h后再进行OGD/R模型建立。
1.2.3细胞分组及给药 将对数生长的BV2细胞接种于96孔板,将细胞随机分正常组、OGD/R组、α-细辛醚低、中和高剂量组;24 h后弃去废液,均用PBS清洗2遍,正常组及模型组细胞换为新的完全培养基,α-细辛醚低、中、高剂量组换为分别含有1、4、16 μmol·L-1剂量α-细辛醚的完全培养基;2 h后弃去孔内细胞培养液,除正常组PBS清洗2遍,换为新的完全培养基,模型组及α-细辛醚组均用无糖Earle’s液清洗2遍,换为含有10 μmol·L-1剂量Na2S2O4的无糖Earle’s液;1.5 h后弃去孔内细胞培养液,各组细胞均换为新的完全培养基;12 h后进行细胞形态观察,提取细胞上清液和细胞蛋白进行其余指标的检测。
1.2.4酶联免疫试剂盒检测炎性因子水平 将对数生长的BV2细胞接种于6孔板,接种密度为2×108个·L-1,将细胞随机分正常组、α-细辛醚对照组(16 μmol·L-1)、OGD/R组、OGD/R+α-细辛醚低、中和高剂量组(1、4、16 μmol·L-1);步骤同“1.2.3”细胞给药操作方法。OGD/R模型建立后,吸取细胞上清液至离心管中,离心15 min(12 000 r·min-1,4 ℃),小心吸取上清,分装后-20 ℃冷冻待用。按照ELISA试剂盒步骤以标准品浓度为Y轴,对应的标准品OD值为X轴,得到标准曲线;将各组测得OD值代入标准曲线中,即可得到相应的待测样本中分泌因子IL-1β、IL-18、IL-10、IL-4及活性氧(reactive oxygen species,ROS)的浓度。
1.2.6免疫蛋白印迹法检测炎性相关蛋白表达量 将吸取上清的6孔板中的细胞用冷的PBS清洗3遍,每孔加入已配制的细胞裂解液100 μL(细胞裂解液 ∶PMSF ∶磷酸酶抑制剂=100 ∶1 ∶1),于冰上用细胞刮刀刮至6孔板底部无贴壁细胞,收集到离心管中置于冰上充分裂解,离心30 min(12 000 r·min-1,4 ℃)。吸取上清分装于新的EP管中,每组取10 μL用于测定蛋白浓度,剩余样品加相应体积的5× Loading Buffer变性(100 ℃,10 min)。根据BCA试剂盒说明计算各组细胞蛋白浓度,求出细胞蛋白原浓度(细胞蛋白原浓度=计算的蛋白浓度×10×0.8)。根据细胞上样量为20~60 μg,求得上样体积(上样体积=上样量/蛋白原浓度)。
按说明书配胶,电泳,先80 V后转120 V;结束后,转膜2 h;后放入封闭液中,封闭2 h;用TBST洗液洗3×10 min,放入一抗孵育盒中,4 ℃过夜;洗膜3×10 min,用标记的二抗室温孵育1 h,再洗膜3×10 min。将蛋白印迹膜放置凝胶成像系统暗室中,滴加ECL显色液。ImageJ软件分析曝光后所得条带灰度值,计算目的蛋白。

2 结果
2.1 不同剂量α-细辛醚对BV2细胞活力的影响将1、2、4、8、16 μmol·L-1剂量的α-细辛醚作用于正常细胞2 h,与正常状态下细胞相比,结果见Fig 1,与正常组细胞相比,1、2、4、8、16 μmol·L-1剂量的α-细辛醚进行2 h干预后,BV2细胞出现增殖趋势(1.16±0.08vs1.00±0.13,1.13±0.18vs1.00±0.13,1.17±0.22vs1.00±0.13,1.12±0.09vs1.00±0.13,1.18±0.12vs1.00±0.13),但均无明显差异(P>0.05)。所以α-细辛醚再1~16 μmol·L-1剂量范围内进行药物干预是安全的,本研究选用1、4、16 μmol·L-1作为α-细辛醚低、中、高剂量组进行研究。

Fig 1 Effect of different doses of α-asarone on cell vitality
2.2 OGD/R模型建立方法筛选结果筛选构建OGD/R细胞模型合适的氧糖剥夺时间和再灌注时间,以及氧化代谢抑制剂Na2S2O4的剂量大小,分别选取含有10、20、30 μmol·L-1剂量Na2S2O4的无糖Earle’s液对BV2细胞进行处理,及氧糖剥夺时间分别选取2 h和4 h,再灌注时间分别选取0、12和24 h,各组细胞活力结果详见Tab 3。通过观察10、20、30 μmol·L-1剂量的Na2S2O4,发现随着剂量的不断增加,细胞活力明显降低;通过观察脑缺血时间和再灌注时间,发现随着随着OGD和R时间的增加,细胞活力也明显降低。根据以上结果,所以本研究选择10 μmol·L-1剂量的Na2S2O4进行模型的建立,因各时间段OGD/R条件下BV2细胞活力过低(低于正常组的60%),所以脑缺血时间和再灌注时间仍需要筛选。

Tab 1 Comparison of cell vitality of different OGD/R model establishment methods
经过α-细辛醚给药剂量及OGD/R模型方法筛选后,已确定α-细辛醚给药剂量分为低、中、高剂量组(1、4、16 μmol·L-1);确定以10 μmol·L-1剂量的Na2S2O4建立OGD/R模型。将氧糖剥夺时间选为2和1.5 h,再灌注时间为12和24 h,再次进行筛选。将对数生长的BV2细胞接种于96孔板,分为正常组、OGD/R组、α-细辛醚低、中、高剂量组。
由Fig 2A结果可得,与正常组相比,模型组BV2细胞活力过低(0.47±0.16vs1.00±0.22;0.55±0.08vs1.00±0.19,P<0.01);与模型组相比,α-细辛醚给药组无明显差异。Fig 2B结果可得,与正常组相比,模型组BV2细胞活力接近于60%(0.55±0.05vs1.00±0.08;0.60±0.06vs1.00±0.19,P<0.01);与模型组相比,OGD 1.5 h+R 24 h条件下α-细辛醚给药组无明显差异,OGD 1.5 h+R 12 h条件下α-细辛醚中、高剂量组细胞活力明显提高(0.72±0.05vs0.60±0.06,P<0.05;0.80±0.09vs0.60±0.06,P<0.01)。综上,OGD/R模型筛选结果,氧糖剥夺2 h或再灌注24 h条件下BV2细胞损伤过于严重,所以可将氧糖剥夺时间定为1.5 h,再灌注时间定为12 h,在此条件下,模型组细胞活力约为正常组细胞的60%,符合模型建立的标准。且α-细辛醚也表现出明显的提高细胞活力的作用,这一结果表明,α-细辛醚预处理能够明显改善对OGD/R模型诱导的细胞损伤,促进损伤细胞的恢复。

Fig 2 Effect of α-asarone on cell vitality of OGD/R model cells
2.3 细胞一般形态变化如Fig 3所示,正常组BV2细胞在正常未激活状态下生长状态良好,胞体饱满立体,胞间偶见突触连接,背景清晰;α-细辛醚对照组细胞细胞数目及胞间突触连接增多;OGD/R模型组细胞细胞数目减少,细胞碎片增多,出现胞体较大的“阿米巴样”细胞,且背景不清晰;α-细辛醚低、中、高剂量组细胞随着给药剂量的增加,“阿米巴样”细胞减少,胞体逐渐立体饱满。从细胞形态结果可直观显示,α-细辛醚对正常细胞具有一定的促增殖作用;α-细辛醚预处理对脑缺血/再灌注损伤模型细胞有一定保护作用。

Fig 3 Effect of α-asarone morphological changes on damaged cells of OGD/R model
2.4 BV2细胞促炎因子与抗炎因子水平
2.4.1促炎因子IL-1β及IL-18水平 建立IL-1β标准品梯度浓度与对应OD值标准曲线,标准曲线方程式为Y=491.66X-14.302,R2=0.9944;建立IL-18标准品梯度浓度与对应OD值标准曲线,标准曲线方程式为Y=375.28X-20.713,R2=0.9917。
将各组OD值为X值代入标准曲线中求Y值,即得到各组细胞分泌的促炎因子IL-1β和IL-18的浓度(ng·L-1),结果见Fig 4。与正常组相比,模型组细胞分泌的促炎因子IL-1β水平明显升高,约为正常组细胞的2倍(400.5±28.25vs192.8±18.63,P<0.01);与模型组相比,α-细辛醚低、中、高剂量组细胞分泌的IL-1β水平明显降低(314.2±9.05vs400.5±28.25,301.5±9.17vs400.5±28.25,281.0±12.45vs400.5±28.25),差异均有统计学意义(P<0.01)。与正常组相比,模型组细胞分泌的促炎因子IL-18水平明显升高(263.7±20.66vs143.5±27.25,P<0.01);与模型组相比,α-细辛醚低剂量组细胞分泌的IL-18水平降低(231.3±17.18vs263.7±20.66,P>0.05);α-细辛醚中、高剂量组均表现出极明显差异(P<0.01),IL-18水平降低明显(210.9±16.45vs263.7±20.66,201.2±21.81vs263.7±20.66)。

Fig 4 Effect of α-asarone on IL-1β and IL-18 in OGD/R model cells
根据以上结果,可以发现α-细辛醚对正常细胞炎性因子的水平无影响;OGD/R模型损伤后,BV2细胞的促炎因子水平急剧上升,α-细辛醚预处理能够明显降低脑缺血/再灌注损伤BV2细胞促炎因子IL-1β和IL-18的释放,并且呈量效关系,以α-细辛醚高剂量(16 μmol·L-1)效果最佳。
2.4.2抑炎因子IL-10及IL-4水平 建立IL-10标准品梯度浓度与对应OD值标准曲线,标准曲线方程式为Y=585.37X-25.179,R2=0.994 4;建立IL-4标准品梯度浓度与对应OD值标准曲线,标准曲线方程式为Y=191.01X-16.792,R2=0.994 5。结果见Fig 5。与正常组相比,模型组细胞分泌的抑炎因子IL-10水平升高(308.3±24.61vs242.3±27.47,P<0.001);与模型组相比,α-细辛醚低剂量组细胞分泌的IL-10水平有升高趋势(336.4±27.87vs308.3±24.61),无明显差异(P>0.05);α-细辛醚中、高剂量组细胞分泌的IL-10水平较模型组明显升高(358.5±13.58vs336.4±27.87,P<0.01;392.3±49.89vs336.4±27.87,P<0.01)。与正常组相比,模型组细胞分泌的促炎因子IL-4水平明显升高(118.2±12.36vs95.59±17.95,P<0.01);与模型组相比,α-细辛醚低、中剂量组细胞分泌的IL-4水平明显升高(136.3±8.29vs118.2±12.36,135.1±10.70vs118.2±12.36,P<0.05);α-细辛醚高剂量组也表现出明显差异(139.3±8.00vs118.2±12.36,P<0.01)。

Fig 5 Effects of α-asarone on IL-10 and IL-4 in OGD/R injured cells
根据以上结果,可以发现α-细辛醚对正常细胞炎性因子的水平无明显影响;OGD/R模型损伤后,BV2细胞的促炎因子水平急剧上升外,同时抑炎因子的水平也呈上升趋势;α-细辛醚预处理能够明显升高脑缺血/再灌注损伤BV2细胞抑炎因子IL-10和IL-4的释放,并且呈量效关系,以α-细辛醚高剂量(16 μmol·L-1)效果最佳。
与正常组细胞相比,模型组细胞IL-1β、IL-18和IL-10、IL-4均升高,说明正常BV2细胞在OGD/R激活后,向M1型和M2型均有明显转化趋势。α-细辛醚预处理的损伤细胞,除了能够明显降低促炎因子水平之外,还能够明显提升抑炎因子水平,α-细辛醚能够降低活化的BV2细胞向M1型转化,促进其向M2型转化,起到抗炎作用。
2.4.3促炎介质TNF-α和抑炎因子TGF-β蛋白表达量 如Fig 6所示,与正常组相比,OGD/R模型组细胞TNF-α蛋白表达量有升高趋势(1.209±0.095vs1.000±0.076);与模型组相比,α-细辛醚对TNF-α蛋白表达量有降低趋势(0.945±0.131vs1.209±0.095,0.903±0.068vs1.209±0.095,0.925±0.131vs1.209±0.095),其中α-细辛醚中剂量组与高剂量组表现出明显差异(P<0.05),α-细辛醚低剂量组差异无显著性(P>0.05)。与正常组相比,OGD/R模型组细胞TNF-α蛋白表达量有升高趋势(1.808±0.277vs1.000±0.183),差异明显(P<0.01);与模型组相比,α-细辛醚对TGF-β蛋白表达量有降低趋势(2.008±0.120vs1.808±0.277,2.509±0.177vs1.808±0.277,2.554±0.312vs1.808±0.277),其中α-细辛醚中剂量组与高剂量组表现出差异有显著性(P<0.05),α-细辛醚低剂量组差异无显著性(P>0.05)。

Fig 6 Effect of α-asarone on expression of TNF-α and TGF-β in OGD/R model cells
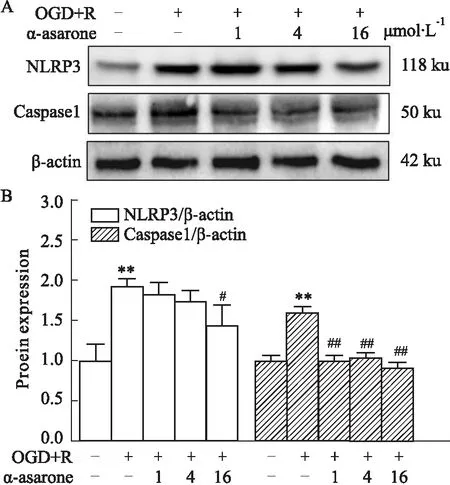
Fig 7 Effect of α-asarone on expression of NLRP3 and caspase 1 in OGD/R model cells

Fig 8 Effect of α-asarone on expression of p-NF-κB in OGD/R model cells
由上述结果可得,α-细辛醚对脑缺血/再灌注损伤BV2细胞能够起到抗炎作用,与ELISA检测结果一致。综上,通过对6种M1型和M2型极型分泌性标记物的检测,发现α-细辛醚可以降低M1型分泌性标记物的分泌,促进M2型分泌性标记物的分泌,所以α-细辛醚对OGD/R诱导的细胞损伤能够起到明显的改善作用,可能与调节活化的小胶质细胞的M1、M2极型转化有关。
2.5 炎症小体NLRP3及caspase 1蛋白表达量与正常组相比,OGD/R模型组细胞NLRP3蛋白表达量有明显升高趋势(1.918±0.104vs1.000±0.207);与模型组相比,各剂量α-细辛醚预处理后NLRP3蛋白表达量有降低趋势,其中α-细辛醚低剂量组和中剂量组差异无显著性(1.826±0.149vs1.918±0.104,1.728±0.1451vs1.918±0.104,P>0.05),α-细辛醚高剂量组明显降低(1.439±0.246vs1.918±0.104,P<0.05)。与正常组相比,OGD/R模型组细胞caspase 1蛋白表达量升高(1.603±0.071vs1.000±0.066),差异有显著性(P<0.01);与模型组相比,α-细辛醚低、中、高剂量均对caspase1蛋白表达量差异有降低趋势(1.004±0.067vs1.603±0.071,1.036±0.065vs1.603±0.071,0.906±0.069vs1.603±0.071,P<0.01)。
由上述结果可得,α-细辛醚能够降低NLRP3和caspase 1蛋白表达。
2.6 核转录因子NF-κB的蛋白表达量与正常组相比,OGD/R模型组细胞p-NF-κB蛋白表达量升高(1.554±0.123vs1.000±0.114);与模型组相比,α-细辛醚低、中、高剂量对NF-κB蛋白表达量降低(1.113±0.068vs1.554±0.123,1.027±0.1822vs1.554±0.123,1.042±0.182vs1.554±0.123)(P<0.05或P<0.01),结果表明,脑缺血/再灌注损伤后BV2细胞出现了NF-κB的过度磷酸化,而α-细辛醚改善OGD/R模型诱导的细胞损伤与其降低NF-κB磷酸化有关。
2.7 ROS活性测定结果如Fig 9所示,与正常组相比,模型组细胞ROS活力明显升高(21.92±3.37vs10.22±2.02,P<0.001);与模型组相比,α-细辛醚低、中、高剂量组细胞ROS活性明显降低(14.84±1.18vs21.92±3.37,12.04±2.634vs21.92±3.37,10.98±2.088vs21.92±3.37),均表现出明显差异(P<0.01)。该结果表明,Na2S2O4结合无糖培养基诱导BV2细胞线粒体损伤,能够产生过量的ROS,各剂量α-细辛醚对线粒体损伤后ROS的活力有抑制作用,通过减少细胞质中过多的ROS产生,以降低其对线粒体及细胞的损伤。

Fig 9 Effect of α-asarone on ROS activity of OGD/R model cells
3 讨论
局部小胶质细胞在缺血发作后几分钟内被激活,脑缺血后48~72 h出现小胶质细胞增殖高峰,损伤后可持续数周,并产生大量的促炎介质,包括IL-1β和TNF-α,加剧脑组织损伤。然而,多种证据表明,激活的小胶质细胞在缺血性脑卒中中起着双重作用,激活的小胶质细胞能产生多种神经营养因子,这些因子参与脑组织的修复,还能够保护大脑免受兴奋性毒性损伤。越来越多的研究认为,引起此现象的原因是由于的小胶质细胞在激活状态下的细胞极型转化[8]。在病理条件下,活化的小胶质细胞能极化为M1型(促炎作用)和M2型(抑炎或保护作用)。M1型小胶质细胞分泌促炎细胞因子,如TNF-α、IL-1β、IL-18和NO等,加重炎症和组织损伤。相反,M2型小胶质细胞分泌抗炎细胞因子,如TGF-β、IL-4、IL-10和RELM-α等,此外还能够分泌VEGF、BDNF和PDGF等,通过抑制炎症促进组织恢复。Kanazawa等[10]认为以促进小胶质细胞向M2型转化为基础的治疗可能是脑卒中的保护性治疗策略。
体外实验研究脑缺血/再灌注损伤主要以建立OGD/R模型为主,该模型通过氧糖剥夺建立脑缺血条件下缺糖缺氧的培养细胞环境,再通过复糖复氧模拟再灌注环境[11]。本研究采用化学试剂 Na2S2O4抑制线粒体氧化磷酸化过程,结合无糖Earle’s液模拟缺糖缺氧环境,但现在研究中对于Na2S2O4剂量及氧糖剥夺/再灌注的时间选择不一,所以本研究增加了剂量筛选实验,确定以10 μmol·L-1剂量的Na2S2O4建立OGD/R模型,氧糖剥夺/再灌注时间分别为1.5 h与12 h。
IL-1β、IL-18作为M1型小胶质细胞的分泌型标记物,本研究对BV2细胞培养液中的促炎因子IL-1β、IL-18进行水平检测。发现OGD/R模型细胞分泌的炎性因子比正常细胞明显升高,而α-细辛醚预处理的损伤细胞分泌的炎性因子明显降低;同时,本研究也检测了抑炎因子IL-10、IL-4水平,发现与正常细胞相比,OGD/R模型细胞分泌的抑性因子明显升高,而α-细辛醚预处理的损伤细胞分泌则更高。该结果与Ding等[12]以及Chen等[9]的研究结论相一致,所以可认为α-细辛醚预给药能够保护BV2细胞,通过降低促炎因子,同时升高抑炎因子水平发挥抗炎作用,从而减轻OGD/R造成的细胞损伤。不过,在Jiang等[13]测得抑炎因子的结果与本研究相反,他们的研究结果显示损伤细胞与正常细胞相比其抑炎因子水平呈降低趋势,出现该结果的原因可能是本研究采用的是小鼠小胶质瘤细胞(BV2细胞),该细胞在活化条件下,向促炎型(M1型)和抑炎型(M2型)均有转化,所以跟正常细胞相比其炎性因子和抑炎因子都会表现出升高趋势。此外,通过对各组BV2细胞蛋白中促炎介质TNF-α及抑炎介质TGF-β进行蛋白表达量测定,得到与ELISA检测相同的结果。可以认为OGD/R损伤后BV2细胞过度激活,向M1型和M2型转化,虽然M2型作起到抗炎作用,但M1型细胞大量释放促炎因子,所以BV2细胞M1型极化率明显高于M2型,仍使得损伤细胞处于过度炎性反应中;α-细辛醚预处理能够使OGD/R损伤后激活的BV2细胞向M2型极化,释放抑炎因子,从而平衡促炎因子过多诱导的炎性反应来保护细胞。
IL-1β、IL-18作为炎症反应的重要参与者,它们的激活和分泌与两条通路密切相关,即 NLRP3炎性小体和 NF-κB信号通路[14]。其中,NLRP3炎症小体是一种大分子多复合蛋白体,NLRP3炎症小体最广泛的特征是控制IL-1β、IL-18前体蛋白pro-IL-1β/18的关键节点。激活后的NLRP3炎症小体在接头蛋白ASC的帮助下募集pro-caspase 1,将其剪切成为有活性的caspase 1,活化后的caspase 1能够将pro-IL-1β/-18剪切成为有活性的IL-1β、IL-18,促进炎性反应的发生。NLRP3与caspase 1作为IL-1β、IL-18上游调节其分泌的蛋白分子。多数体内外研究发现,通过抑制NLRP3的活化能够降低炎性反应发生,减轻脑缺血/再灌注损伤。并且,近年来大量证据表明,调节NLRP3的活性是改善脑卒中的潜在治疗手段[15]。本研究通过测定NLRP3及caspase 1表达量,发现与正常细胞相比,OGD/R模型细胞NLPR3及caspase 1蛋白表达量明显升高,而α-细辛醚预处理能降低它们的过度激活,可以认为α-细辛醚预处理对OGD/R损伤BV2细胞的保护作用,及α-细辛醚能够起到的抗炎作用,与调节NLRP3炎症小体的活化有关。
NF-κB作为一种多向性转录调节蛋白,在脑缺血/再灌注损伤中的作用机制主要通过促进炎症的发生发展来实现。脑缺血时小胶质细胞中的NF-κB被激活后,促使IL-1β、IL-18、TNF-α等炎性因子表达。同时这些促炎因子又可以激活NF-κB,从而使该过程在脑细胞间不断扩散,加重炎症反应。研究发现,NF-κB作为炎性通路TLR/NF-κB的参与蛋白,也能上调NLRP3蛋白的表达,促进NLRP3炎性小体的激活[14]。本研究通过测定NF-κB及其磷酸化蛋白表达量,发现α-细辛醚能明显OGD/R损伤后BV2细胞出现的NF-κB过度磷酸化。综上,可以认为NLRP3炎性小体和NF-κB经典信号通路均参与到α-细辛醚调节炎性反应改善脑缺血/再灌注损伤的作用机制中。不过,α-细辛醚是作为炎性蛋白抑制剂发挥作用,还是在对炎性蛋白上游调控因子产生作用?这些可以简单从OGD/R细胞模型建立的原理推测。
本研究主要采用的是Na2S2O4进行OGD/R细胞模型的建立,其原理主要是通过抑制线粒体产生ATP,作为氧化代谢抑制剂起到细胞除氧的作用。由此看来,线粒体是病理改变最先发生的细胞器。研究表明,活性氧,尤其是来自线粒体的活性氧,参与了NLRP3炎症物质的激活。并且,许多NLRP 3炎症小体激活剂都能在多种细胞中触发线粒体活性氧的产生[16]。 线粒体作为ROS产生的部位,损伤后其能产生大量ROS,而过高水平的ROS又能刺激线粒体和NLRP3,促进其激活后发挥促炎作用[17-18]。本研究经过ROS检测,Na2S2O4结合无糖培养基诱导BV2细胞线粒体损伤,能够产生过量的ROS,α-细辛醚对线粒体损伤后ROS的活力有抑制作用,通过减少细胞质中过多的ROS产生,以降低其对线粒体及细胞的损伤。
综上,α-细辛醚能够改善氧糖OGD/R导致的BV2细胞损伤,其作用机制可能与调节NLRP3炎症小体及BV2细胞M1型与M2型转化有关。相对于OGD/R损伤细胞,α-细辛醚预干预能够提高细胞活力,减轻受损细胞产生的ROS活性,抑制NF-κB的磷酸化,以降低NLRP3炎症小体的过度活化;降低caspase 1对促炎因子前体pro-IL-1β/18的剪切,进而降低IL-1β与IL-18的分泌,促进抑炎因子IL-10与IL-4的分泌,起到保护细胞的抗炎作用。
