HO-1/PGC-1α通路在调控线粒体氧化应激中的作用
2022-08-08郭家彬
张 丽,何 俊,金 虹,贾 栗,郭家彬
(中国人民解放军疾病预防控制中心,北京 100071)
线粒体是细胞内能量的主要来源,也是细胞生长、分化以及信息传递的重要场所。线粒体是药物毒性作用的重要靶位,大量研究提示线粒体氧化应激是许多药物毒性重要的毒性机制[1]。线粒体功能调控是一个复杂的过程,受到多条毒性通路的调控。毒性通路是指在机体受到化学物充分干扰时会导致有害健康效应的细胞信号通路,即化学物暴露达到一定的浓度,对生物信号通路产生扰动作用,当这种扰动达到一定程度时产生不良效应甚至死亡[2]。近年来,随着人们对线粒体氧化应激及其机制的了解和深入研究,线粒体氧化应激通路备受关注。越来越多的研究提示,血红素加氧酶-1(heme oxygenase-1,HO-1)和过氧化物增殖体激活受体γ(PPARγ)共激活因子-1α(PGC-1α)在线粒体氧化应激损伤中发挥重要作用[3-4]。基于线粒体氧化应激在药物毒性中的重要作用以及毒性通路在线粒体毒性的关键地位,本文综述了重要的抗氧化通路HO-1/PGC-1a在线粒体氧化应激中的作用,从HO-1/PGC-1α通路的功能与调控、氧化应激对HO-1/PGC-1α通路的影响、HO-1/PGC-1α通路如何调节线粒体抗氧化能力以及HO-1/PGC-1α通路在脏器线粒体氧化损伤中的作用几个方面具体论述。
1 线粒体氧化应激与毒性通路
线粒体是机体重要的细胞器,除了产生细胞生命活动的直接能源ATP、调控细胞凋亡、维持电解质稳态平衡外,还负责细胞中氧自由基(reactive oxygen species,ROS)的生成,调节细胞氧化还原反应和信号转导。ROS是高反应性氧化物,有一个或多个不成对的自由基电子,如超氧阴离子(O2-)和羟基自由基(OH·),性能十分不稳定,可随时攻击其他分子[5]。生理水平的ROS可作为细胞内的信号分子,调控细胞生长、增殖和凋亡等,并与ROS防御系统维持氧化-抗氧化平衡。而过量的ROS则会引起细胞氧化-抗氧化稳态失衡,引发氧化应激反应。线粒体是ROS产生的主要场所,也是ROS攻击的主要目标。氧化应激可损伤线粒体DNA(mitochondrial DNA,mtDNA)、损伤线粒体蛋白或酶、使线粒体脂质过氧化以及干扰毒性通路。ROS可激活多种细胞内重要的毒性通路,如核因子κB(nuclear factor κB,NF-κB)、磷脂酰肌醇3-激酶(phosphatidylinositol3-kinase,PI3K)/蛋白激酶B(protein kinase,PKB/Akt)、分裂原激活的蛋白激酶(mitogen activated protein kinases,MAPK)信号通路等,参与氧化和抗氧化过程;同时ROS也能激活线粒体相关通路,参与线粒体功能的调节,其中包括的线粒体氧化应激通路HO-1/PGC-1α通路。
2 HO-1/PGC-1α的功能与调控
HO-1是催化血红素代谢的限速酶,可氧化血红素生成胆绿素,同时释放铁和一氧化碳(carbon monoxide,CO),胆绿素通过胆绿素还原酶(biliverdin reductase,BVR)生成胆红素。其中胆绿素是一种抗氧化物,具有抗氧化应激的作用;CO是重要的信号传递分子,可增强细胞抗氧化能力[6]。HO-1是一种应激反应蛋白,可以被多种因素诱导表达,如氧化应激、炎症和缺血等,在调控线粒体氧化应激和线粒体功能中发挥重要的作用[7]。HO-1受转录因子Bach1(BTB and CNC homology 1)调控抑制和Nrf2(NF-E2-related factor 2)的调控激活。Bach1和Nrf2均属于碱性亮氨酸拉链(basic leucine zipper,bZIP)和cap-n-collar(CNC)转录因子家族成员,可与小musculoaponeurotic fibrosarcoma(Maf)蛋白形成异二聚体并结合到靶基因的Maf识别元件(MAF recognition element,MARE),如HO-1基因的抗氧化反应元件(antioxidant response element,ARE),调控靶基因的转录。HO-1基因(HMOX1)启动子的激活具有多种调控方式,其转录具有高度的诱导性。HMOX1启动子在转录起始位点(transcription start site,TSS)的上游的-4 kb(E1)和-10 kb(E2)处有两个增强子区域,有多个ARE,可作为转录因子Nrf2和转录抑制蛋白Bach1的结合位点。在基础条件下,Bach1与HO-1启动子的AREs结合,抑制HO-1基因的表达;在氧化应激时,Bach1从HO-1启动子分离,同时应激导致Nrf2与Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)的解离,与AREs结合,激活HO-1基因的表达以应对氧化应激[8](Fig 1)。

Fig 1 Pathway of ROS-induced HO-1 activation
PGC-1α是一种转录共激活因子,主要存在于肝脏、心脏和骨骼肌等富含线粒体的组织器官。PGC-1α是调控线粒体生物合成的重要分子。线粒体生物合成复杂,包括线粒体DNA(mtDNA)编码蛋白的合成,mtDNA的复制、转录和翻译以及氧化磷酸化复合物的装配等,是保持线粒体数量和维护线粒体功能的重要机制[9]。PGC-1α除了共激活PPARγ外,其还共激活核呼吸因子(nuclear respiratoty factor,NRF)和雌激素相关受体α(ERRα)以共同调控线粒体生物合成。核呼吸因子1和2(NRF1和NRF2)控制细胞色素c和细胞色素c氧化酶亚基编码基因的表达。NRF1调控核氧化磷酸化基因的表达,以及线粒体转录、蛋白导入及相关蛋白质组装的核编码因子的表达,并通过线粒体转录因子A(mitochondrial transcription factor A,TFAM)调节线粒体DNA的转录,诱导线粒体生物合成;NRF2属于鸟嘌呤和腺嘌呤(GA)结合蛋白家族,该家族结合富含GA的DNA序列,并受ERRα调节,以调控线粒体生物合成[10]。PGC-1α分子的调控包括基因调控和转录后修饰。基因水平上,PPARs是PGC-1α的主要调节因子,其可感知多种刺激并调控PGC-1α的表达;另一个重要的调节因子是cAMP反应元件-连接蛋白(cAMP response element binding protein,CREB),其可诱导PGC-1α表达;PGC-1α负调控因子包括受体相互作用蛋白140(receptor interacting protein140,RIP140)、DNA甲基转移酶3b(DNA methyltranserase 3b,DNMT3B)等,可以抑制线粒体生物合成[11]。转录后修饰中,AMP-激活蛋白酶(adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK)、Akt和MAPK磷酸化可以激活PGC-1α;沉默调节蛋白1(Sirt1)去乙酰化也可以激活PGC-1α[12]。氧化应激可诱导PGC-1α表达,激活线粒体生物合成通路,发挥抗氧化作用(Fig 2)。
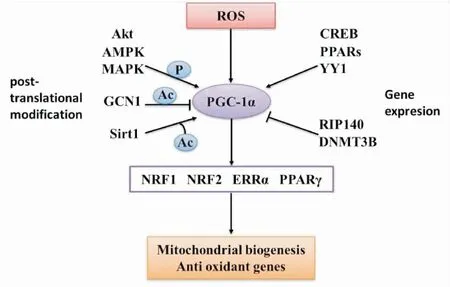
Fig 2 Transcriptional and post-translation modulation
3 氧化应激对HO-1/PGC-1α通路的影响
线粒体ROS影响氧化/抗氧化平衡并参与氧化信号的传导(Fig 3)。线粒体ROS生成能诱导Nrf2-Keap1复合物中的Nrf2与Keap1的解离并转位入核,激活NRF-1和HO-1,HO-1的表达诱导周期性的Nrf2激活并进一步激活HO-1,这一过程是维持线粒体生物合成中PGC-1α/NRF-1/TFAM表达所必需的,也是氧化应激后线粒体生物合成的前馈循环[13]。

Fig 3 Anti-oxidant regulation of HO-1/PGC-1α in response to ROS
激活的HO-1可在多个分子水平上调控PGC-1α的表达。HO-1释放的一氧化碳(CO)可通过Akt、AMPK、MAPK和Sirt1途径,进一步调控NRF-1,PGC-1α和CREB,最终诱导线粒体生物合成中转录因子的表达以及抗氧化酶的生成。Akt、AMPK和MAPK磷酸化可以激活PGC-1α,增加其细胞核易位,启动线粒体生物合成转录过程。Akt是一种由PDH激酶1磷酸化激活的蛋白激酶,该激酶依赖于PI3K和三磷酸磷脂酰肌醇(phosphatidylinositol trisphosphate,PIP3),PI3K被磷酸酶张力蛋白同系物(phosphoatase and tensin homolog,PTEN)拮抗,通过氧化还原修饰失活。HO-1的诱导可增加CO含量,内源性CO水平的升高促进了SOD2的表达和线粒体复合物III中过氧化氢(H2O2)的生成,激活Akt;HO-1可以使PTEN转化为非活性形式,从而促进Akt磷酸化,氧化失活磷酸化酶而激活受体磷酸化和促进细胞内信号转导,并最终诱导线粒体生物合成。Akt的激活使Nrf2核易位,结合NRF-1启动子中AREs启动线粒体生物合成并诱导抗氧化基因表达;Akt还能激活CREB,与PGC-1α共调节基因转录,调节抗氧化作用[14]。MAPK属于一种进化保守的丝氨酸/苏氨酸蛋白激酶的信号转导超家族,包括3个主要的信号途径,细胞外信号调节激酶(extracellular-signal regulated kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal protein kainse,JNK)/应激活化蛋白激酶(stress activatedproteinkinase,SAPK)和p38 MAPK,HO-1来源的CO可以激活MAPK,调节细胞生长、线粒体生物合成和应对环境应激[15]。MAPK可直接激活PGC-1α,调控线粒体生物合成,也可以通过p38和ERK1/2磷酸化,进一步磷酸化激活CREB,调控PGC-1α的表达。AMPK是一种三聚体丝氨酸/苏氨酸激酶,由α、β和γ亚基组成。AMPK是细胞能量代谢的关键调节因子,葡萄糖缺乏、缺血和氧化应激等都会增加AMPK的活性。当细胞氧化应激时,AMPK可通过磷酸化激活PGC-1α,增加线粒体生物合成以增加细胞ATP水平。AMPK还参与了抗氧化酶(硫氧还蛋白还原酶2(TrxR2)、SOD以及GSH-Px等)的转录调节过程[16]。Sirt1去乙酰化可以增加PGC-1α蛋白的活性,增加其对细胞核和线粒体基因转录。
4 HO-1/PGC-1α通路调节线粒体抗氧化能力
HO-1/PGC-1α通路调节可直接激活抗氧化防御系统,也可通过调节线粒体自噬和诱导线粒体生物合成发挥线粒体保护作用[17]。ROS的主要防御系统是内源性抗氧化酶类,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽还原酶(glutathione reductase,GRx)、硫氧还蛋白(thioredoxin,Trx)及过氧化物酶(peroxidase,PX)和非酶ROS清除剂如谷胱甘肽(glutathione,GSH)、辅酶Q、维生素C和维生素E。ROS可激活HO-1/PGC-1α通路以启动ROS的防御系统,减少细胞内的ROS生成,维持线粒体ATP和线粒体膜电位(mitochondrial membrane potential,MMP),保护线粒体免于氧化应激损伤。丁酸钠可通过激活Nrf2/HO-1通路,提高脑内抗氧化酶(CAT、SOD和GSH-Px)活性,缓解线粒体氧化损伤和发挥神经保护作用[18];血科拉多糖可通过激活HO-1通路,抑制心脏毒性药物诱导的SOD、CAT和GSH等抗氧化酶的活性降低,以保护小鼠H9C2心肌细胞免受线粒体氧化损伤[19];缺乏PGC-1α可能导致抗氧化酶SOD2、GSH-Px和CAT下调,破坏细胞氧化还原平衡,导致山羊颗粒细胞线粒体功能障碍,并通过线粒体依赖的途径凋亡[20]。
HO-1/PGC-1α通路的激活可招募线粒体自噬标记物,通过调节自噬缓解线粒体氧化应激损伤。核桃来源的多肽可通过HO-1途径激活PINK1,诱导线粒体自噬,缓解氧化应激,改善东莨菪碱诱导的小鼠认知和学习记忆障碍[21];一氧化碳通过增加肝脏HO-1和线粒体自噬调节蛋白Parkin的表达来改善对乙酰氨基酚引起的肝损伤[22];氧化应激时,HO-1缺失可诱导PGC-1α/NRF-1通路抑制,以及Pink1和Parkin2介导的自噬上调障碍,致心脏细胞损伤和纤维化[23]。ROS激活的HO-1/PGC-1α通路还可诱导线粒体生物合成,通过线粒体的分裂、更新和分化,改变线粒体大小、数量和质量,最终调节线粒体功能。醛糖还原酶抑制剂非达司他通过Nrf2/HO-1/PGC-1α途径调节结肠癌细胞线粒体的生物发生,抑制线粒体DNA损伤,阻止结肠癌细胞的生长[7];四羟基芪葡萄糖苷(TSG)处理可强烈诱导HO-1的表达,并通过上调线粒体生物合成激活因子(PGC-1、NRF1和TFAM)和线粒体复合物IV,增加了线粒体质量[24]。大量研究均证实了HO-1/PGC-1α通路在调节线粒体抗氧化能力中发挥重要作用。
药物暴露可导致ROS过量增加,从而干扰HO-1/PGC-1α表达,抑制线粒体抗氧化作用,损伤线粒体功能,ROS清除剂则可通过诱导HO-1/PGC-1α表达而发挥线粒体保护作用。2型糖尿病的降糖药物二肽基肽酶-4抑制剂(DPP-4i)通过ROS-HO-1轴作用,加快小鼠乳腺癌的转移,ROS清除剂NAC可抑制DPP-4i诱导的乳腺癌转移[25];中药乌头碱可诱导斑马鱼胚胎ROS增多,并下调抗氧化分子Nrf2、HO-1、CAT和SOD-1的表达水平,最终导致ROS介导的线粒体凋亡[26];抗癌药阿霉素可诱导小鼠心肌细胞ROS增多,导致线粒体膜电位降低,线粒体功能紊乱和细胞凋亡增加,PGC-1α通路参与阿霉素诱导的心肌细胞线粒体功能损伤的保护[27]。
5 HO-1/PGC-1α通路在脏器线粒体氧化损伤中的保护作用
线粒体功能障碍可导致多种脏器损伤,HO-1/PGC-1α通路的激活在缓解脏器线粒体氧化损伤中发挥重要作用。在心血管系统疾病中,线粒体氧化应激导致的线粒体功能障碍是主要的病理基础之一,HO-1/PGC-1α通路可调节线粒体功能,维持心脏稳态[28]。病毒性心肌炎、心肌缺血/再灌注损伤、风湿性心脏病、动脉硬化、高血压性心脏病等疾病的线粒体功能障碍,可通过Nrf2/HO-1通路的调控进行治疗;PGC-1α调控线粒体生物合成,为心脏提供足够的ATP输出,PGC-1α缺乏可使心肌对氧化应激敏感性增加,致心肌线粒体损伤,PGC-1α表达则可缓解心肌损伤。线粒体功能在脑神经元能量稳态和脑疾病中也十分重要,其中HO-1/PGC-1α发挥核心作用[29]。帕金森氏病和阿尔茨海默病中PGC-1α功能都有缺失,糖尿病性神经退行性病变中HO-1/PGC-1α发挥抗氧化和抗线粒体凋亡作用,亨廷顿病时PGC-1α调控可预防线粒体功能障碍。HO-1/PGC-1α通路在肝脏线粒体疾病也发挥重要作用,可调节三羧酸循环,肝胰岛素抵抗,脂肪酸氧化等[30]。非酒精性脂肪性肝病时,PGC-1α表达和线粒体生物合成障碍可致线粒体氧化能力和线粒体功能障碍,进而导致肝脂肪变性。肝PGC-1α过表达可增加脂肪酸氧化,减少体内外甘油三酯储备,缓解线粒体氧化损伤。除此以外,HO-1/PGC-1α在肺、肾疾病以及糖尿病等多种疾病线粒体功能障碍中均发挥重要的抗氧化作用。
6 结语与展望
近年来,随着人们对线粒体毒性研究的深入以及基于毒性通路的毒性机制的广泛开展,基于氧化应激毒性通路的线粒体毒性机制的相关研究已经取得了一定的进展。本文从线粒体氧化应激关键通路角度出发,重点阐述了HO-1/PGC-1α线粒体氧化应激通路在线粒体功能中的作用,为线粒体毒性机制的研究提供了理论基础。然而,由于物质多样性、毒性通路网络的错综复杂以及多学科多技术的交叉研究,有关毒性通路的研究仍需要更加深入的探讨,可重点关注毒性通路的识别、多通路共同作用方式、不良结局的确定、化合物暴露剂量和暴露时间对通路的影响以及人个体化差异等等,为基于毒性通路的毒性机制研究和毒性综合测试方法的建立奠定基础。此外,生理状态下的ROS对线粒体生物合成和功能调节的机制和信号通路已经比较清楚了,但线粒体功能障碍时的毒性通路有待研究。病理状态下线粒体功能紊乱是氧化损伤的原因,还是继发反应等问题还需要更科学的解释,问题的解决可以提供改善线粒体功能的新方法。
