季铵盐缓蚀剂的分子模拟与理论实验误差分析
2022-08-05韩曈郭继香赵清张宇
韩曈,郭继香,赵清,张宇
(1.中国石油大学(北京) 非常规油气科学技术研究院,北京 102249;2.中国石油大学(北京) 理学院,北京 102249;3.中海油天津化工研究设计院有限公司,天津 300450)
腐蚀一直是化工工业生产中不可避免的问题,腐蚀使材料发生破坏和失效,导致严重的经济和安全问题[1]。在油田生产过程中,包括酸化、洗井和沥青质解堵等过程都会造成腐蚀,研究人员提出了耐蚀合金、防腐涂层、缓蚀剂和电化学防护等一系列防护方案,其中缓蚀剂由于操作简便、应用广泛、成本低廉等优点,一直被认为是腐蚀防护技术的核心之一[2]。
近年来,计算化学被应用于缓蚀剂研究中,通过计算可以分析缓蚀剂和金属之间的相互作用,预测其腐蚀防护潜力。本文基于分子模拟计算,设计并合成了3种季铵盐缓蚀剂,通过电化学测试和失重实验评价了产物缓蚀性能。在此基础上,分析了理论预测与实际现象之间的误差成因并加以验证,将模拟计算与实际实验相结合,为今后相关缓蚀剂研究提供了思路。
1 实验部分
1.1 试剂与仪器
1,10-二溴癸烷、吡啶、无水乙醇、丙酮、盐酸、双氯甲基联苯、N,N-二甲基十六烷基胺、十六烷基二甲基叔胺、环氧氯丙烷、乙酸乙酯、正丙醇均为分析纯;实验用水均为去离子水;P110钢片(50 mm×13 mm×2 mm,实验前分别使用石油醚、去离子水和乙醇清洗,置于氮气干燥环境下备用)。
CHI660E电化学工作站;Turbiscan多重光散射稳定性测试仪;LKTC-L CONTROLLER数显恒温水浴箱;FA2004C型电子天平。
1.2 缓蚀剂分子设计
1.2.1 分子模拟与计算 计算使用了Material Studio 8.0软件,首先设计分子,并搭建模型,使用DMoL3模块计算获得轨道能量EHOMO和ELUMO。之后根据Koopman的理论,计算有机缓蚀剂与铁原子之间的电子交换数ΔN[3-4]。Lukovits等开展了一系列缓蚀剂分子模拟,认为当ΔN大于0时,分子会表现出良好缓蚀效果;在[0,3.6]区间内,缓蚀性能是ΔN的增函数,超过3.6后,性能随ΔN增加而降低,这一结论仅适用于对缓蚀的初步预测[5]。除了ΔN,还可以计算分子亲电指数ω和亲核指数ε,表征得失电子倾向,较大的ω值表示分子接受电子的趋势较强,Fe原子倾向于失去电子,因此,ω值更高的分子缓蚀潜力更大。
1.2.2 模拟结果分析 通过计算,筛选了3种具有不同基团的双子季铵盐分子结构,图1为计算后这3种分子的结构与前线轨道分布。根据分子的对称性,可以推测在分子另一侧应同样存在HOMO和LUMO分布。同时存在两组电子交换结构,有助于分子更好地与金属原子发生相互作用,实现腐蚀防护。
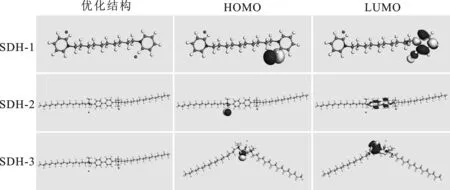
图1 缓蚀剂分子的结构与前线轨道分布Fig.1 The structure and front-line orbital distribution of inhibitor molecules
模拟计算结果见表1。
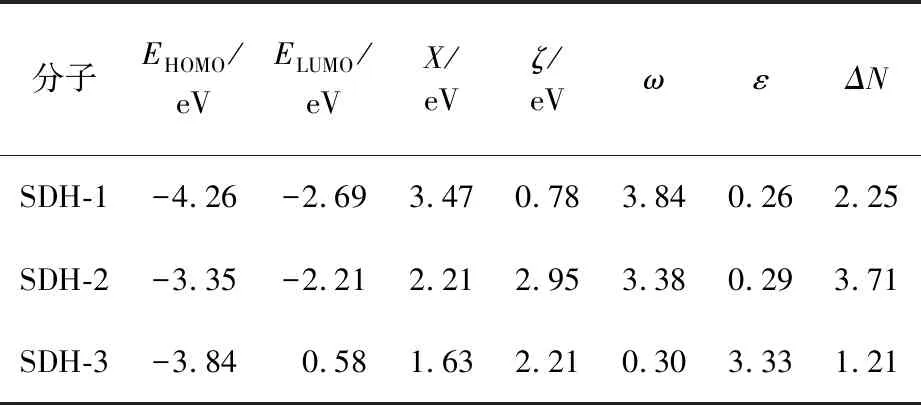
表1 缓蚀剂分子的前线轨道计算参数
ΔN都为正数,除SDH-2外ΔN都在0~3.6区间内,因此可推测3种分子都有缓蚀潜力。硬度ζ都处于较低水平,因此具有较高的反应活性。SDH-1和SDH-2亲电指数更高,分子更容易与铁原子接触,形成吸附作用。综合硬度、亲电性和ΔN,可以判断3种分子都具备成为缓蚀剂的潜力,其中SDH-1和SDH-2的性能相比于SDH-3可能更好,接下来将对分子进行合成并评价其缓蚀性能。
1.3 缓蚀剂合成
根据图2中的合成路线,按照下列步骤合成了3种不同结构的双子季铵盐缓蚀剂。
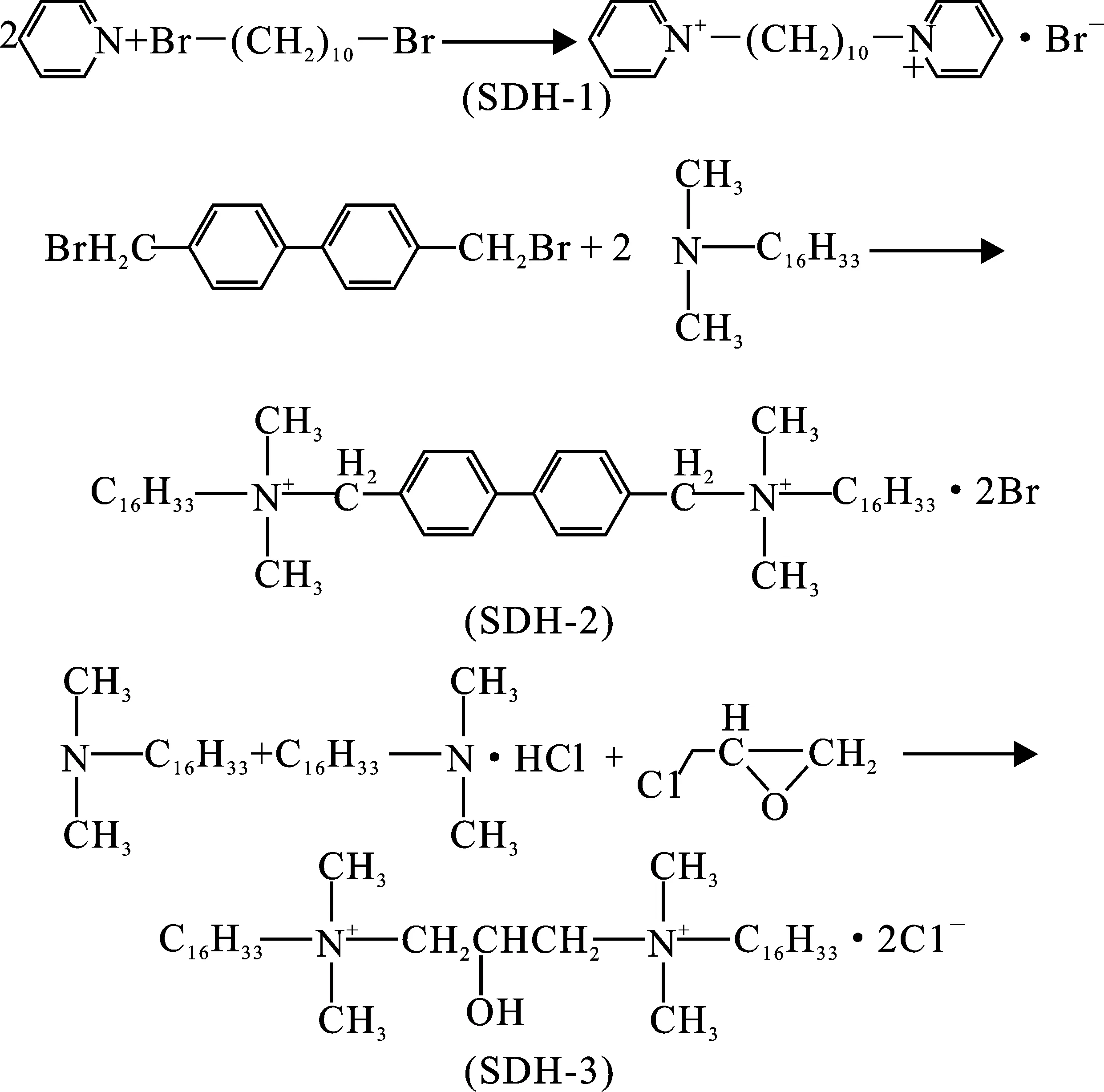
图2 SDH-1、SDH-2和SDH-3的合成过程与结构Fig.2 Synthesis reaction and structures of SDH-1,SDH-2 and SDH-3
1.3.1 吡啶基缓蚀剂SDH-1的合成 按照物质的量比1∶2.1,称取1,10-二溴癸烷与吡啶,加入等体积乙醇,80 ℃下回流反应8 h。减压蒸馏,获得粗产物。用丙酮重结晶,过滤,真空干燥,获得目标产品,命名为1,1’-(癸烷-1,10-二基)双(2H-吡咯-1-鎓),记为SDH-1。
1.3.2 联苯基缓蚀剂SDH-2的合成 按照摩尔比3∶1,称取N,N-二甲基十六烷基胺和4,4’-二溴甲基联苯。将二溴甲基联苯与一定量的乙醇(约十六烷基胺体积的80%)混合,滴加十六烷基胺,80 ℃回流反应3 d。减压蒸馏去除溶剂,得到粗产物。用甲醇和丙酮重结晶,过滤、干燥,获得产品,命名为双-N,N-十六烷基二甲基-对联苯二胺二溴化铵,记为SDH-2。经过前期测试,SDH-2水溶性较差,使用过程中需要滴加微量乙醇助溶。
1.3.3 羟基缓蚀剂SDH-3的合成 混合一定量的正丙醇和十六烷基二甲基叔胺,加入足量浓盐酸,待白雾消失后,加入环氧氯丙烷(物质的量约为十六烷基二甲基叔胺的40%),60 ℃回流反应8 h。减压蒸馏去除溶剂,得到粗产物。使用乙酸乙酯和乙醇进行重结晶,过滤、干燥,获得产物,命名为1,3-双(十六烷基二甲基氯化铵)-2-羟基丙烷,记为SDH-3。
1.4 缓蚀剂性能评价
1.4.1 电化学测试
1.4.1.1 极化曲线 电化学在平板腐蚀电解池中以三电极体系进行测试,工作电极为P110钢样片,测试面积1 cm2;参比电极为Ag/AgCl电极;对电极为1 cm×1 cm的铂片,腐蚀溶液为1 mol/L的盐酸溶液,实验温度30 ℃。测试前首先扫描开路电压至少1 h,至稳定。极化曲线扫描范围为开路电压左右各0.5 V,扫描速率0.01 V/s。得到数据后绘制曲线,并拟合计算腐蚀电流密度,用公式(1)计算缓蚀剂的腐蚀抑制率η(%)。
(1)
式中,i0和i分别是空白腐蚀和加入缓蚀剂后的腐蚀电流密度[6]。
1.4.1.2 交流阻抗 测试初始电位为开路电位,频率范围0.01 Hz~200 kHz,振幅10 mV。数据使用ZSimpwin软件拟合并计算相关参数,绘制奈奎斯特曲线。阻抗测试中缓蚀剂的效率按照公式(2)计算。
(2)
式中,Rct0和Rct分别是空白腐蚀测试加入缓蚀剂后,拟合测试数据得到腐蚀反应体系电荷转移电阻[7]。
1.4.2 失重评价实验 腐蚀环境为30 ℃的1 mol/L盐酸,每次实验前现用现配。
静态失重评价腐蚀时间为7 d,腐蚀结束后,用去离子水和乙醇反复清洗试片表面,确保表面没有明显污物后,放入氮气环境下烘干并称重。每组实验设置3个平行样品,根据试片的平均质量损失,计算腐蚀速率和缓蚀率,使用公式如下:
(3)
(4)
式中Vcorr——试片的均匀腐蚀速率,mm/a;
V0和V1——试片空白腐蚀和加入缓蚀剂后的腐蚀速率,mm/a;
Δm——试片的平均损失质量,g;
S1——试片的表面积,cm2;
ρ——试片密度,取7.86 g/cm3;
t——腐蚀测试实验时间,h;
η1——缓蚀剂在该浓度下的缓蚀率,%[8]。
2 结果与讨论
2.1 缓蚀剂效果评价
2.1.1 极化曲线测试 3种合成产物在1 mol/L盐酸中抑制P110钢腐蚀的极化曲线见图3。
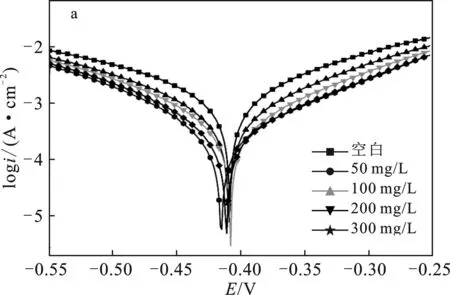
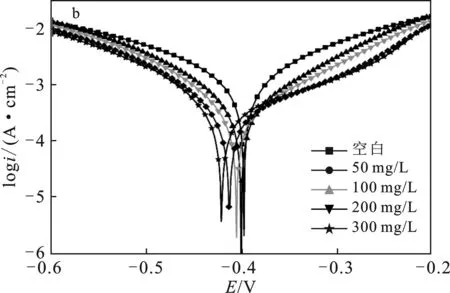
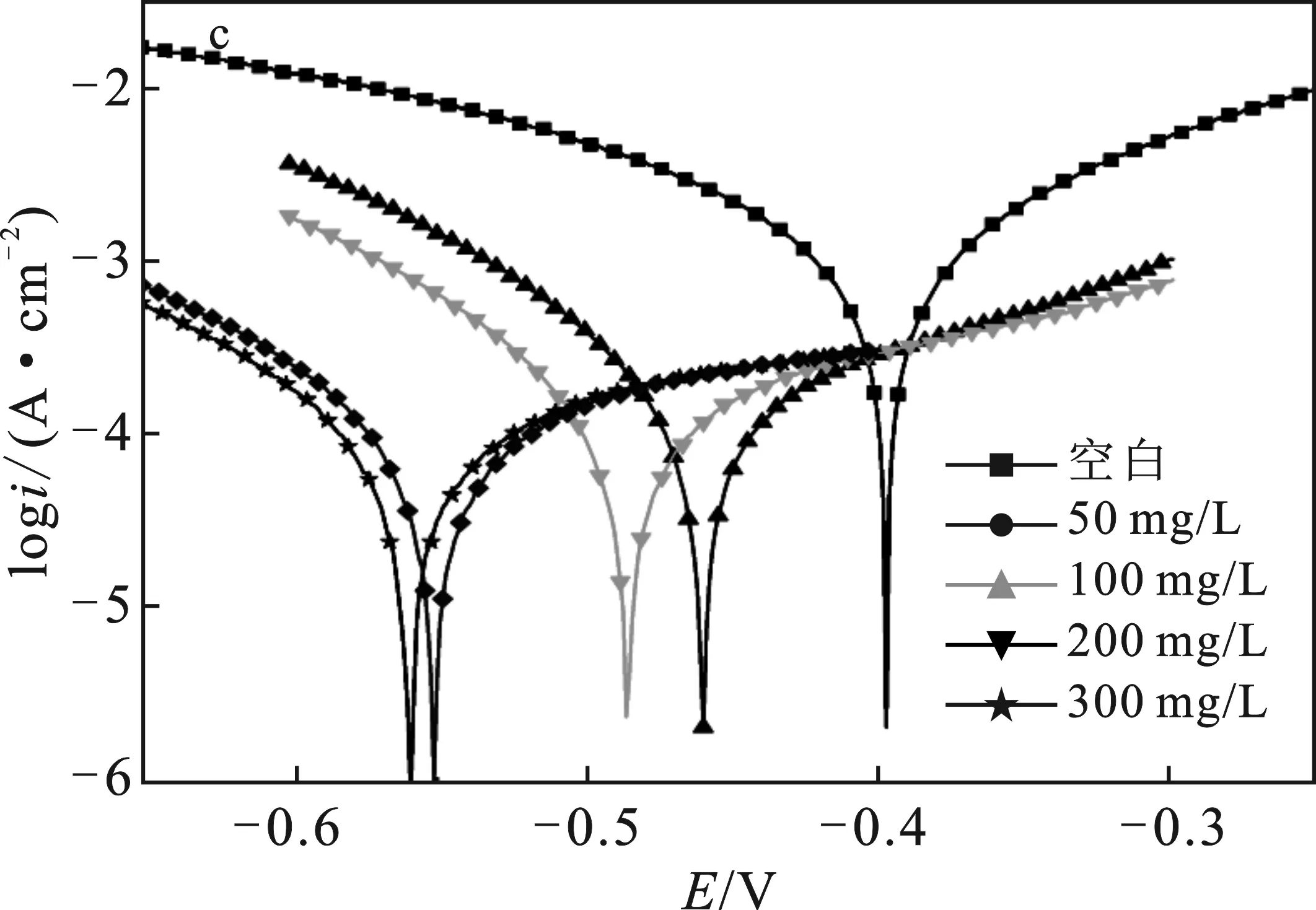
图3 HCl中P110钢腐蚀的动电位极化曲线Fig.3 Potential polarization curves of P110steel corrosion in HCl(a)SDH-1;(b)SDH-2;(c)SDH-3
由图3可知,在3组腐蚀实验中,空白腐蚀的极化曲线都位于所有曲线的最上方,此时溶液体系中的腐蚀电流密度最大,因此腐蚀情况最为严重。在加入合成的季铵盐缓蚀剂后,极化曲线都向下发生了移动,对应着腐蚀电流密度降低,即腐蚀受到抑制。对比加入缓蚀剂前后的极化曲线形状,曲线的阴极和阳极部分形状并未因加入缓蚀剂而改变,说明缓蚀剂没有改变腐蚀反应机理,而是直接降低反应速率[9]。
3种缓蚀剂的腐蚀电流密度、缓蚀效率以及其他极化曲线参数见表2。
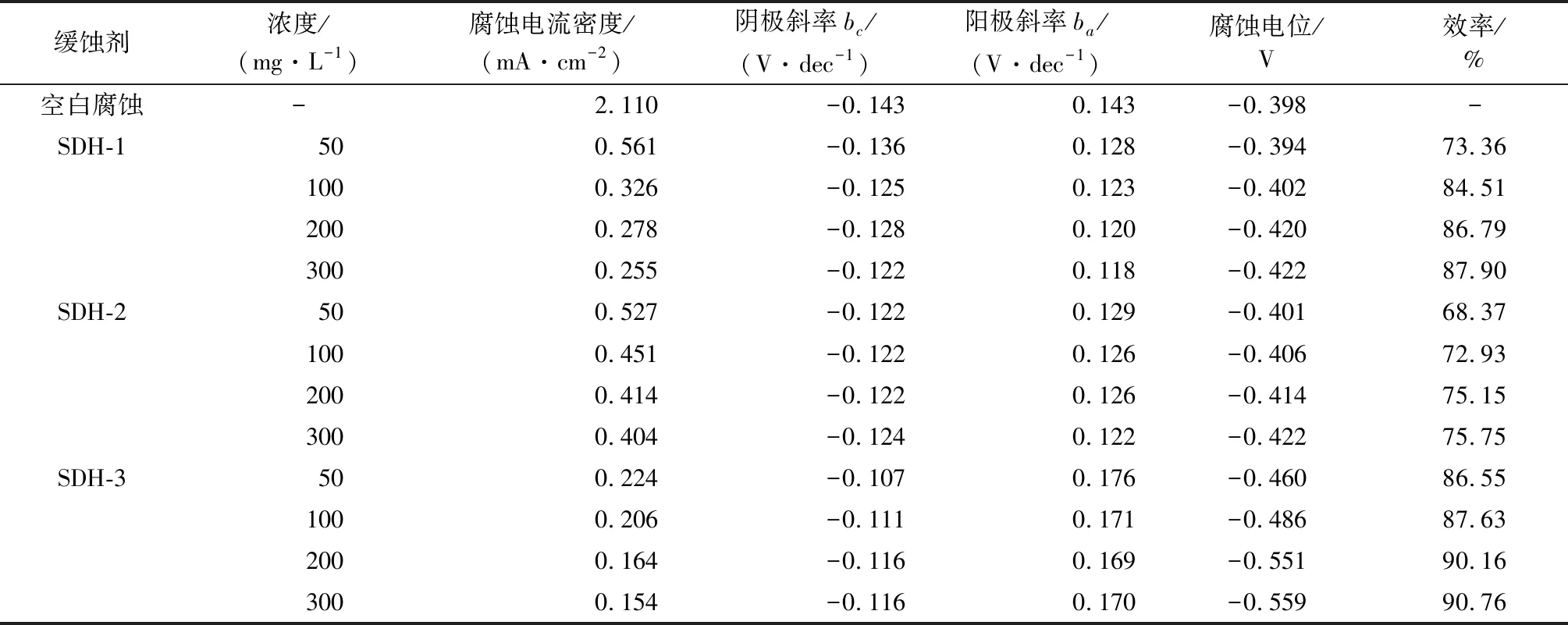
表2 缓蚀剂的极化曲线参数
由表2可知,空白腐蚀电流密度达到2.110 mA/cm2,加入缓蚀剂后,腐蚀电流都发生下降。随浓度增加,抑制效率同步上升:SDH-1、SDH-2和SDH-3在浓度300 mg/L时都达到最大抑制率,分别为87.90%,75.75%和90.76%,缓蚀效果由强到弱顺序为SDH-3 > SDH-1 > SDH-2。
除计算腐蚀电流和缓蚀率外,还可通过曲线阴、阳极斜率和腐蚀电位变化来判断缓蚀剂的作用机理。由表2可知,加入3种缓蚀剂后,极化曲线的阴极和阳极斜率都发生了下降,说明缓蚀剂同时抑制腐蚀的阴极反应和阳极反应[10]。如果缓蚀剂对腐蚀电位影响超过了85 mV,那么缓蚀剂属于阴极型或阳极型,影响小于85 mV时缓蚀剂为混合型缓蚀剂[11]。对于SDH-1和SDH-2,极化曲线最大腐蚀电位偏移均为25 mV,因此二者属于混合型缓蚀剂。对于SDH-3,腐蚀电位的最大偏移为161 mV,属于阴极型缓蚀剂,对腐蚀反应的抑制作用更倾向于抑制腐蚀原电池的阴极。
2.1.2 交流阻抗谱 根据缓蚀剂的盐酸腐蚀阻抗数据,拟合数据绘制了奈奎斯特曲线,见图4(a)、(b)和(c)。使用的模拟电路见图4(d),Rs代表溶液电阻,Rct代表电荷转移电阻,Q为相位角元件,可以用于分析金属表面性质。
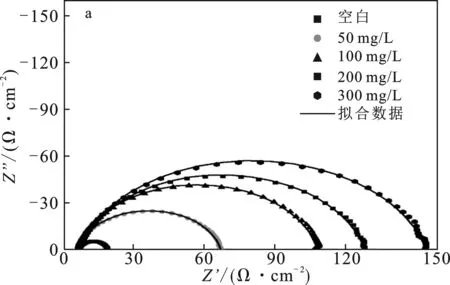
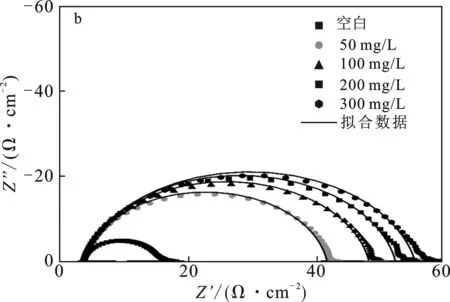
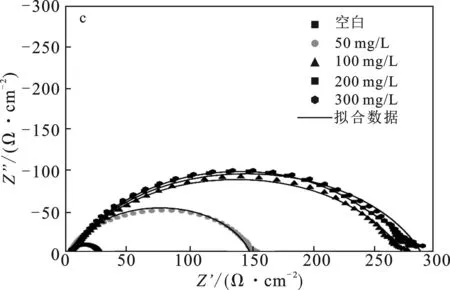
图4 HCl中P110钢腐蚀的奈奎斯特曲线Fig.4 Nyquist plots of corrosion in HCl(a)SDH-1;(b)SDH-2;(c)SDH-3;(d)模拟电路
由图4可知,拟合曲线不是标准半圆,这是测试样品表面的粗糙与不均匀性导致的。加入缓蚀剂后,曲线半长轴长度明显随加入浓度的提升而增加,代表着腐蚀体系中电荷转移电阻Rct上升,宏观表现为腐蚀反应速率的下降[12]。相同浓度下,SDH-3对应曲线的半长轴最长,SDH-1次之,SDH-2最短,这意味着SDH-3腐蚀抑制效果最好。
拟合计算了阻抗曲线的各项参数,结果见表3。
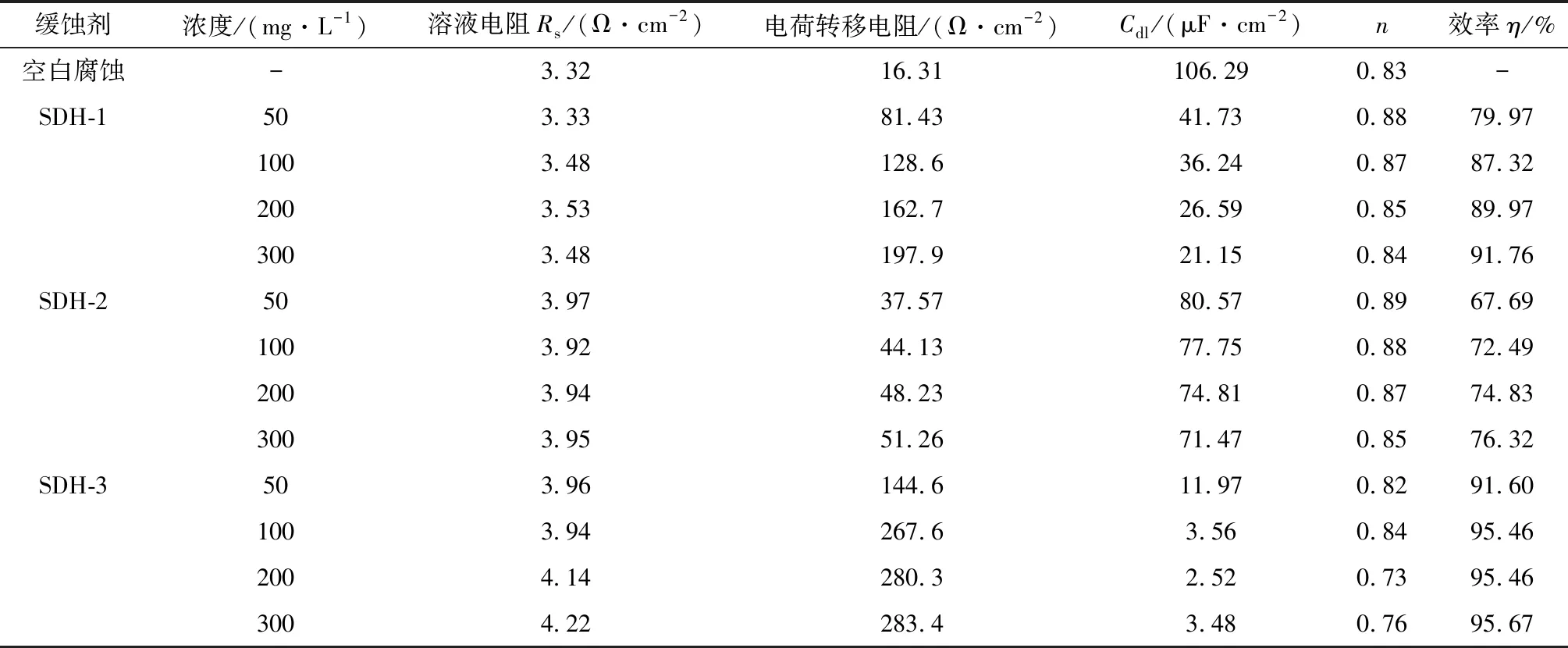
表3 缓蚀剂的交流阻抗拟合结果
由表3可知,加入缓蚀剂后,Rct都随浓度增加而上升,SDH-1、SDH-2和SDH-3在浓度300 mg/L时Rct分别达到了最大值197.9,51.26,283.4 Ω。3种缓蚀剂都达到了最大缓蚀率,缓蚀效果从高到底顺序为SDH-3>SDH-1>SDH-2。通过拟合阻抗数据,可以计算n值来判断Q的性质:n越接近0,Q越接近纯电阻;n越接近1,Q越接近纯电容[13]。由表3可知,n值始终在0.8附近波动,因此可以通过计算双电层电容Cdl来判断缓蚀剂效果:随着缓蚀剂加入量增加,体系Cdl随之下降,代表电子容纳量的降低,此时电子交换速率也会下降,腐蚀反应因此受到抑制[14]。
交流阻抗测试表明,3种合成缓蚀剂都能有效抑制盐酸对P110钢的腐蚀,缓蚀效果SDH-3>SDH-1>SDH-2,与极化曲线测试得到的结论一致。
2.1.3 静态失重实验 表4中给出了静态失重实验得到的加入3种缓蚀剂后P110钢的腐蚀速率和对应缓蚀率。
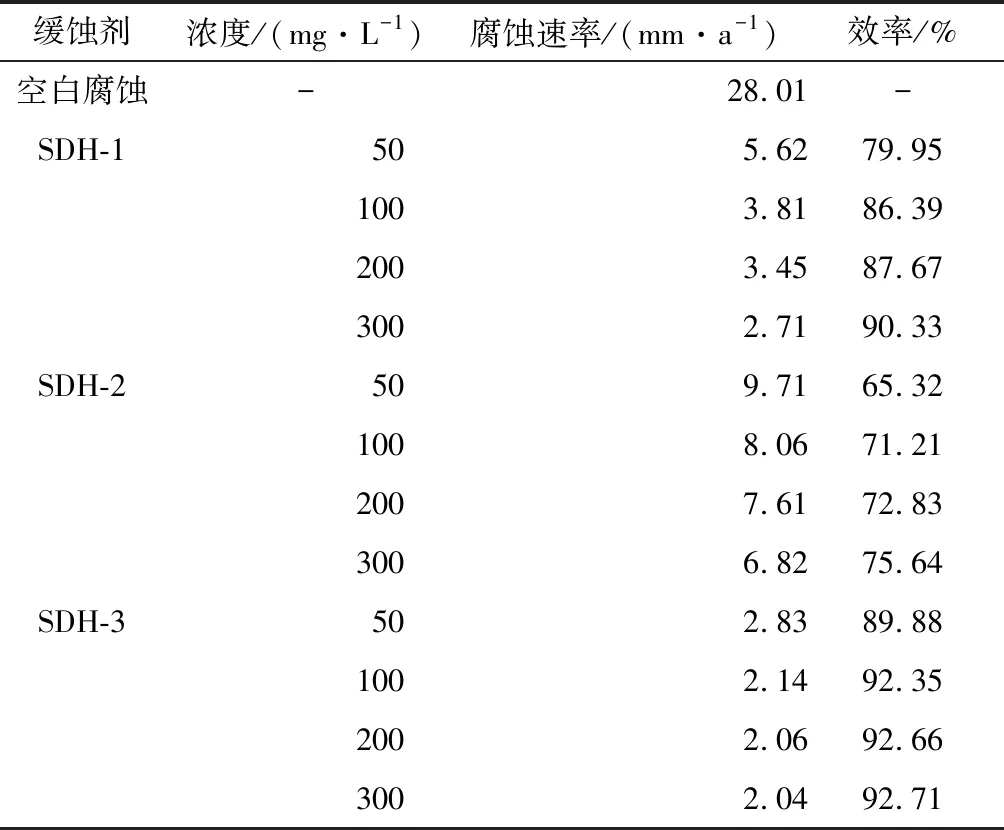
表4 缓蚀剂的静态失重评价
由表4可知,空白腐蚀速率达到了28.01 mm/a,此时钢材会在短时间内穿孔失效[15]。加入合成的3种缓蚀剂后,腐蚀速率都迅速下降,说明合成产物能够有效抑制盐酸腐蚀过程。SDH-3和SDH-1的盐酸腐蚀抑制率都超过了90%,表现出了优秀的抑制效果。SDH-2的保护效果是3种合成缓蚀剂中最差的,所能达到的最低腐蚀速率仍高于5 mm/a。 静态失重评价结果说明SDH-1和SDH-3是抑制盐酸腐蚀的良好缓蚀剂,且SDH-3的效果更好,SDH-2的腐蚀抑制能力并不理想,这与电化学测试得到的结论基本一致。
2.1.4 理论计算与实际实验结论对比 对比分子模拟计算预测结果与实际评价实验数据可知,这3种分子都具备缓蚀效果,其中SDH-1表现出了符合预期的良好缓蚀性能,但是对于SDH-2和SDH-3,理论计算预测和实际实验结果都出现了误差:(1)根据计算,SDH-2理论上应具有较好的缓蚀性能,但是实际实验中SDH-2的效果并不理想;(2)模拟计算结果显示,SDH-3具有较强亲核性,因此预测其缓蚀能力可能是三者中相对较弱的,但实际实验中SDH-3反而表现出了最好的缓蚀效果。接下来将通过其他实验或计算对这些误差的原因进行解释,以便在今后的缓蚀剂相关研究中更好地结合理论与实际。
2.2 误差原因分析与验证
2.2.1 缓蚀剂体系稳定性对SDH-2的影响 SDH-2中存在能增强吸附作用的联苯官能团,其ΔN为3.71,亲电指数为3.38,因此预测SDH-2可能是一种理想的缓蚀剂,这与实验现象发生了矛盾。分析实验过程,推测原因如下:SDH-2的溶解性较差,虽然通过加入微量乙醇助溶,得到了肉眼观测无悬浮物的体系,但仍存在缓蚀剂未完全分散、有效浓度低于加入浓度的可能。稳定性分析仪能测试体系TSI值的变化,TSI值越大,说明体系越不稳定,内部可能存在的微粒越多。因此,使用稳定性分析仪测试了6种不同体系的TSI值,结果见图5。
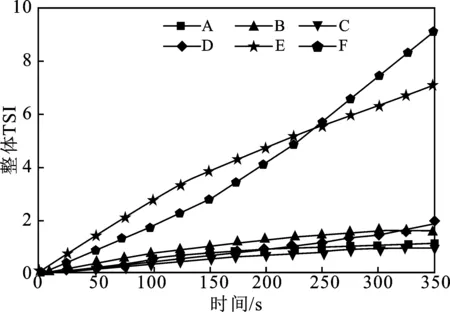
图5 稳定性分析仪测试结果Fig.5 Stability analyzer test results
图5中,A、B分别为去离子水和无水乙醇的测试曲线,TSI值最终都在1.5以下,说明体系稳定。C、D分别为300 mg/L的SDH-1溶液和300 mg/L的SDH-3溶液,两种溶液TSI值与水和乙醇的TSI值相差不大,因此可以认为缓蚀剂已经充分分散,体系中没有悬浮微粒。E和F都是加入300 mg/L SDH-2的体系,其中E使用乙醇助溶,肉眼观测不到明显悬浮物,F未加入乙醇,肉眼可见大量悬浮物,导致了体系F的不稳定,最终TSI值已经超过了9,远高于稳定体系。对于体系E,加入乙醇助溶后,虽然肉眼观测不到明显悬浮物,但是TSI值已经超过6,体系同样处于不稳定状态。可知无论是否加入乙醇,SDH-2体系都存在大量悬浮微粒,缓蚀剂在水相中无法充分分散,有效浓度低于预期值,影响了实际效果。稳定性分析实验结果解释了SDH-2理论计算与实际实验出现矛盾的原因:缓蚀剂在水相中的体系稳定性对性能会产生很大影响,在合成产物应用效果不佳时需要考虑体系稳定性问题,这为后续缓蚀剂相关研究中,类似问题的解决提供了新思路。
2.2.2 质子化作用对SDH-3性能的影响 根据模拟计算结果,BHHP的ΔN值为1.21,可以初步预测分子具有缓蚀效果。但是BHHP亲核指数为3.33,显著高于亲电指数,分子表现出较强的给电子能力,这对于缓蚀剂与金属原子的相互作用是不利的。因此,根据计算结果预测BHHP的缓蚀性能并不出色,这与实际实验出现了矛盾,分析原因如下:实验中选择的腐蚀介质为盐酸,体系为强酸性,BHHP分子中的羟基在这种情况可能发生质子化。质子化后,BHHP性质发生了改变,因此表现出了与计算预期不同的优异的缓蚀效果。为了证实这一观点,计算了BHHP发生质子化后的有机结构及参数。质子化后,BHHP的前线轨道分布情况变化不大,但是分子性质已经发生了改变,计算结果见图6。
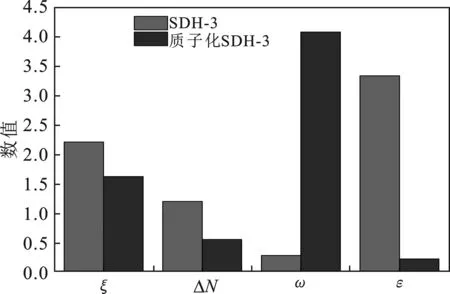
图6 质子化前后SDH-3的分子性质对比Fig.6 Comparison of molecular properties before and after protonation of SDH-3
质子化后,SDH-3分子硬度有所降低,说明分子的反应活性增强。ΔN值相比于质子化前有所减小,但仍为正数,说明质子化后SDH-3依然具备成为缓蚀剂的潜力,质子化并不会导致SDH-3失去缓蚀性能。质子化后SDH-3的亲电指数ω显著提升,亲核指数ε大大降低,说明质子化导致分子结构变得倾向于获得电子,这有利于发挥缓蚀效果。根据质子化前后SDH-3分子性质的对比可以得出结论,质子化作用是导致SDH-3模拟计算预测与实际实验出现矛盾的原因:强酸环境下质子化提升了有机结构的腐蚀抑制,SDH-3更适用于强酸性环境下的腐蚀防护。因此,在类似强酸环境的缓蚀剂分子设计过程中,对于容易质子化的有机分子,需要考虑强酸环境下质子化的影响,避免预测出现错误,影响缓蚀剂研究。
3 结论
(1)基于分子模拟计算,筛选了3种具备高效缓蚀剂潜力的有机分子结构,根据理论计算结果,合成了3种季铵盐缓蚀剂SDH-1、SDH-2和SDH-3。
(2)通过电化学测试和静态失重实验,研究了合成缓蚀剂对P110钢在30 ℃、1 mol/L盐酸中腐蚀的抑制效果,结果表明,3种合成缓蚀剂都能降低P110钢的腐蚀速率,其中SDH-3和SDH-1的缓蚀效果明显,缓蚀率分别可达92.71%和90.33%,SDH-2效果并不理想,最大缓蚀率仅达到75.64%。
(3)针对理论计算与实验现象矛盾这一问题,通过稳定性测试证实缓蚀剂水相体系稳定性导致SDH-2实际性能低于理论预期出现矛盾的原因;通过计算质子化前后SDH-3的分子性质,证实强酸环境下的质子化是SDH-3性能超出预期的原因导致BHHP由亲核转为亲电,提升有机分子缓蚀性能;有机分子分散性和强酸质子化作用是导致理论计算和实际现象出现矛盾的重要原因;这部分研究对理论计算与实验的结合进行了探索,对于后续有机缓蚀剂的分子设计与相关研究提供了思路。
