miR-208a 通过调控QKI5 表达对大鼠心肌缺血再灌注损伤的影响
2022-07-30陈洪艳陈文栋王燕琼白向锋
杨 伟 ,陈洪艳 ,陈文栋 ,王燕琼 ,白向锋
(1)昆明医科大学第一附属医院麻醉科;2)超声科;3)心脏大血管外科,云南 昆明 650032)
心肌缺血再灌注损伤(myocardial ischemiareperfusion injury,MIRI)是心肌冠状动脉闭塞后,当血流恢复时再灌注可能导致比缺血本身更严重的心肌损伤,包括缺血损伤和再灌注损伤[1]。在心肌缺血再灌注时还会伴随着大量炎性因子的释放,当血流再灌注时随着血液循环可对未受累心肌细胞造成损伤,也可加重受累心肌细胞的损伤,常常导致严重的不良后果,如心力衰竭、心律失常,甚至心脏骤停[2]。
microRNAs(miRNAs)是在真核生物中发现的一类内源性的具有调控功能的非编码RNA,可与多个靶信使 RNA(mRNA) 结合进而调节靶基因的表达,近来有研究显示miRNAs 在心肌缺血再灌注损伤中起着重要的调控作用,表明miRNAs 参与了心肌缺血再灌注损伤过程[3]。miR-208a 是一种心肌特异性miRNA,由α-心肌肌球蛋白重链基因(Myh6)的内含子编码,可以参与多种心脏疾病的发生和发展。在大鼠缺血再灌注损伤模型中发现上调miR-208a 可引起心肌细胞凋亡增加,沉默miR-208a 可以减轻心肌细胞凋亡和心脏功能障碍[4]。
RNA 结合蛋白(QKI)属于信号转导与RNA 活化蛋白家族(signal transduction and activation of RNA,STAR)中的一员,是一类具有信号转导功能的蛋白质,此外还具有与mRNA 结合的功能,QKI 有三种主要亚型,即QKI5、-6 和-7[5]。QKI 蛋白的表达分布及功能在神经系统的研究较多,有研究确认该蛋白在脑和心肌中均有高丰度表达,而QKI5 在心脏组织中大量表达,可以抑制缺血/再灌注(I/R)诱导的心肌细胞凋亡[5]。
根据miRNA 靶基因预测数据库发现心脏疾病相关基因QKI5 是miR-208a 候选靶基因,因此,笔者初步研究miR-208a 在大鼠心肌缺血再灌注损伤中表达变化对QKI5 的影响,探索miR-208a在MIRI 中的作用机制,为以后心肌缺血再灌注损伤寻找新的治疗方向。
1 材料与方法
1.1 主要材料与试剂仪器
miR-208a antagomir(广州锐博生物有限公司)、Trizol 试剂(美国Invitrogen 公司)、DNA 逆转录试剂盒(日本Takara 公司)、荧光定量检测试剂(大连宝生物)、苏木素染色(福建迈新公司)、RTqPCR 试剂盒及相关试剂(广州东盛生物科技有限公司)、cTnT 及CK-MB 检测试剂盒(上海佰晔生物公司)、IL-6 及IL-1β 和肿瘤坏死因α(TNFα)试剂盒(上海酶联生物公司)、兔抗人QKI5 单克隆抗体(武汉Bioswamp 公司)、RNA 提取分离试剂盒(北京天根生化公司)、伯乐qT-PCR 仪(美国Bio-Rad 公司)、TUNEL 凋亡试剂盒(ROCHE公司)、Bradford 蛋白浓度测定试剂盒(碧云梯生物研究所)、PVDF 膜(美国Millipore 公司)。
1.2 实验方法
1.2.1 实验动物分组选择32 只SPF 级的雄性SD 大鼠(6~8 周龄,220~250 g),采用简单随机分组将大鼠分为Sham 组、I/R 组、I/R+anta-miRNC 组及I/R+anta-miR-208a 组,每组8 只。实验动物购自于昆明医科大学动物实验中心,在动物舍中保持约22 ℃的室温、55%的相对湿度和12 h 的交替光照,清洁养殖和饮用水定期供应。本研究动物实验及处置符合昆明医科大学实验动物中心动物实验伦理要求。
1.2.2 实验动物模型构建称重SD 大鼠,用2%戊巴比妥钠(40 mg/kg)麻醉大鼠后,将大鼠固定住;行气管行插管术后连接RWD-407 小动物呼吸机,设置通气频率为60~80 次/min,潮气量50 mL/kg,呼吸比2∶1,并将针刺电极插入四肢皮下进行全程监测大鼠的肢体II 导联心电图(迈瑞)。将SD 大鼠胸前区去毛后,皮肤擦拭碘伏消毒,纵行切开皮肤在胸骨左缘第3~4 助间处,依次纵深行进。最后将心包剪开,心脏暴露后用6/0 线迅速在距离冠状动脉前降支(left anteriordescending artery,LAD)的根部约2~3 mm处系一个拌,其间穿过一根塑料管后将拌拉紧,大鼠心电图ST 段的抬高,缺血区域的左室壁颜色发绀或呈浅红色,并伴有室壁运动减弱。结扎LAD 45 min 后,拔出塑料管,使冠状动脉恢复血流,随后迅速关闭胸腔,再灌注120 min。Sham组开胸后即缝合,I/R+anta-miR-NC 组和I/R+anta-miR-208a 组先经尾静脉连续注射antagomir miR-NC 和miR-208a antagomir 2 d 后于第3 天构建心肌I/R 模型。
1.2.3 实验动物心功能检测和标本采集再灌注120 min 后,使用Vivid 7.0 高频探头检测左心室的长轴和靠近胸骨的左心室的短轴,记录LVEF、LVFS 和SV。并在超声检测后常规麻醉,分离大鼠腹主动脉血液,离心(3 000 r/min,10 min),取血清,编号后存于-20 ℃冰箱内,按照酶联免疫吸附法(ELISA)检测心肌损伤标志物CK-MB 及cTnI 和炎性因子IL-1β、IL-6、TNF-α。分离出心脏,一部分置于4%多聚甲醛中固定,另一部分暂存于-80 ℃冰箱中保存。
1.2.4 HE 染色检测心肌组织损伤及TUNEL 检测心肌组织细胞凋亡取留置于多聚甲酸固定的心肌组织,一部分进行常规的切片制作和HE 染色,另一部分进行TUNEL 染色,严格按照试剂盒说明进行操作,光镜下观察心肌组织病理变化和心肌组织细胞凋亡。
1.2.5 RT-PCR 检测心肌组织miR-208a 表达取存于-80℃冰箱内的心肌组织,匀浆后根据miRNA 提取试剂盒的说明书提取缺血心肌组织中总miRNA。再使用miRNA RT-PCR 试剂盒对miR-208a 的3' 末端加多聚A 尾Poly A,并对Poly A 修饰的miR-208a 进行逆转录反应生成1st Strand cDNA,再行RT-PCR 反应,操作参照试剂盒说明书。miR-208a 上游引物为 5 '-ATAAGACGAGCAAAAAGCTTGT-3',下游引物为5 '-GGAACGATACAGAGAAGATTAGC-3 ',以U6 为内参,采用2-△△CT法检测miR-208a 的相对表达量,每个样品重复3 次。
1.2.6 RT-PCR 检测心肌组织QKI5 mRNA 表达根据mRNA 提取试剂盒说明书提取缺血心肌组织中总mRNA。再使用mRNA 逆转录试剂盒对总mRNA 进行逆转录反应生成相应的cDNA,再进行RT-PCR 反应,操作参照试剂盒说明书。QKI5 上游引物5' -AACATTAAATCACCAGCCCT TGC-3',下游引物为 5' -CAGCTGGCGTAGGA GTACG-3',并以β-action 为内参,采用2-△△CT法检测QKI5 mRNA 的相对表达量,每个样品重复3 次。
1.2.7 Western blot 检测心肌组织中QKI5 和Caspase3 蛋白表达取存于-80 ℃冰箱中的大鼠心肌组织,提取总蛋白,进行凝胶电泳、转膜,质量分数5%脱脂牛奶室温封闭30min,加入一抗稀释液(QKI5,1∶1 000;Caspase3,1∶500),4 ℃孵育过夜,次日洗膜后加HRP 标记的二抗,室温孵育1 h,添加化学发光试剂,于暗室中显影分析。采用TANON GIS 软件进行灰度分析,以GAPDH 为内参计算总蛋白相对表达量。
1.3 统计学处理
采用SPSS 21.0 统计软件对实验所得数据进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,多组间应用单因素方差分析,两两比较采用 SNK-q检验。以P< 0.05 为差异有统计学意义。两变量之间的相关性采用Pearson相关性分析。
2 结果
2.1 miR-208a 对I/R 大鼠心脏功能的影响
心脏超声对心脏功能检测结果显示I/R 组大鼠LVEF、LVFS 和SV 值低于Sham 组(P< 0.05),I/R+anta-miR-208a 组大鼠的LVEF、LVFS 和SV明显高于anta-miR-NC 组和I/R 组(P< 0.05),而I/R+anta-miR-NC 组与I/R 组大鼠LVEF、LVFS和SV 差异无统计学意义(P> 0.05),见图1。

图1 miR-208a 对大鼠心脏功能的影响Fig.1 Effect of anta-miR-208a on cardiac function in rats(±s,n=8)
2.2 各组I/R 大鼠心肌组织病理变化
Sham 组大鼠心肌组织HE 染色中未见明显异常的心肌细胞;而I/R 组和I/R+anta-miR-NC 组中显示心肌细胞有明显的的变性坏死,且伴有大量的炎性细胞浸润;I/R+anta-miR-208a 组中变性坏死的心肌组织细胞较I/R+anta-miR-NC 组和I/R 组明显减少,见图2。

图2 各组心肌组织病理变化(HE ×200)Fig.2 Pathological changes of myocardial tissue in each group (HE ×200)
2.3 miR-208a 对I/R 大鼠心肌损伤标注物和炎性因子的影响
I/R 组大鼠血清中的心肌损伤标志物CK-MB、cTnI 以及炎性因子IL-1β、IL-6、TNF-α 水平高于Sham 组(P< 0.05),I/R+anta-miR-208a 组血清中的CK-MB、cTnI 以及炎性因子IL-1β、IL-6、TNF-α 均 低于I/R+anta-miR-NC 组和I/R 组(P< 0.05),而I/R+anta-miR-NC 组与I/R 组血清中的心肌标志物CK-MB、cTnI 以及炎性因子IL-1β、IL-6、TNF-α 水平差异无统计学意义(P>0.05),见图3。
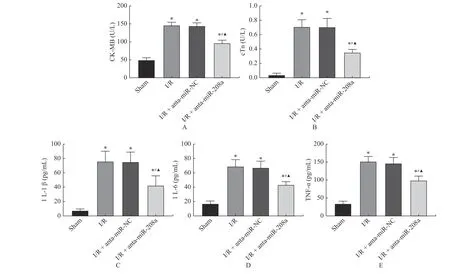
图3 miR-208a 对I/R 大鼠心肌损伤标注物和炎性因子的影响Fig.3 Effects of miR-208a expression on myocardial injury makers and inflammatory factors in I/R rats(±s,n=8)
2.4 miR-208a 对I/R 大鼠心肌组织细胞凋亡的影响
采用TUNEL 染色发现I/R 组大鼠心肌组织细胞的凋亡率高于Sham 组(P< 0.05),I/R+antamiR-208a 组大鼠心肌组织细胞的凋亡率低于I/R+anta-miR-NC 组 和 I/R 组(P< 0.05),而I/R+anta-miR-NC 组与I/R 组心肌组织细胞凋亡率差异无统计学意义(P> 0.05),见图4。

图4 各组心肌组织细胞凋亡情况(TUNEL×200)Fig.4 Apoptosis of myocardial tissue cells in each group (TUNEL×200)(±s,n=8)
2.5 各组心肌组织miR-208a 及QKI5 mRNA 表达水平
利用RT-PCR 检测各组心肌组织中miR-208a 和QKI5 mRNA 的表达后发现,与Sham 组相比,I/R 组中miR-208a 的表达水平升高,而QKI5 mRNA 的表达降低(P< 0.05);与I/R+antamiR-NC 组 和I/R 组相比,I/R+anta-miR-208a 组中miR-208a 表达水平下降,QKI5 mRNA 表达水平升高(P< 0.05),I/R+anta-miR-NC 组和I/R 组miR-208a 和QKI5 mRNA 的表达差异无统计学意义(P> 0.05),见图5。

图5 各组大鼠心肌组织miR-208a 和QKI5 mRNA 相对表达水平Fig.5 Relative expression levels of miR-208a and QKI5 mRNAin myocardial tissue of rats in each group(±s,n=8)
2.6 miR-208a 对大鼠心肌组织中QKI5 和凋亡蛋白表达的影响
利用 Western blot 检测4 组大鼠心肌组织中QKI5 蛋白和凋亡信号通路蛋白Caspase3 的表达水平。与Sham 组相比,I/R 组QKI5 蛋白的表达水平降低,而Caspase3 蛋白的表达明显升高(P<0.05),与I/R+anta-miR-NC 组和I/R 组相比,I/R+anta-miR-208a 组中QKI5 的蛋白表达增加,而Caspase3 蛋白的表达降低(P< 0.05),I/R+anta-miRNC 组和I/R 组蛋白表达差异无统计学意义(P>0.05),见图6。

图6 各组大鼠心肌组织中蛋白的相对表达Fig.6 Relative expression levels of protein in myocardial tissue of rats in each group(±s,n=8)
2.7 miR-208a 与QKI5 的相关性分析
使用DIANA 数据库预测了QKI5 可能是miR-208a 的靶基因(图7A),通过对两者的表达相关性分析发现,miR-208a 与QKI5 蛋白表达呈负相关,miR-208a 表达越高,QKI5 表达越低(P<0.05),说明miR-208a 可以调控QKI5 在心肌I/R中发挥作用(图7B)。
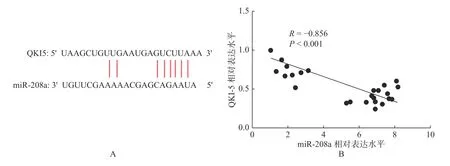
图7 miR-208a 和QKI5 的相关性Fig.7 Correlation between miR-208a and QKI5
3 讨论
MIRI 是心血管疾病中常见的临床病理现象,多发生于经皮冠状动脉介入治疗术(PCI)、冠脉搭桥术、体外循环下的心脏直视手术等冠脉血流恢复过程中。MIRI 涉及钙超载、炎症反应、氧化应激、内质网应激、线粒体功能障碍和蛋白酶激活等[6]。目前临床上还没有预防和治疗心肌缺血再灌注损伤的特效药物和方法。miR-208a 属于MyomiRs 家族,具有心脏特异性,几乎只在心脏表达[4]。在体内外实验以及临床研究中均发现在心肌缺血再灌注损伤时组织或血清中miR-208a有着明显的升高,其升高的水平与心肌损伤的程度相关[7-9]。本研究中也探讨了miR-208a 在I/R大鼠心肌中的表达变化,结果显示在I/R 大鼠心肌组织中miR-208a 表达较Sham 组明显增加,而给予miR-208a antagomir 后可以降低I/R 大鼠心肌组织中miR-208a 的表达,且miR-208a 在心肌组织中的表达变化和心肌损伤标志物CK-MB、cTnI 的水平基本一致。CK-MB、cTnI 是临床判断心肌损伤常用的指标,广泛存在于心肌细胞中,可以反应心肌细胞损伤的程度。本研究结果表明,抑制miR-208a 表达时可以降低血清中CK-MB、cTnI 水平,改善缺血再灌注损伤大鼠的心脏功能,同时可以减轻I/R 损伤大鼠心肌组织病理变化,降低心肌细胞的凋亡。
由于miR-208a 在MIRI 过程中对心肌细胞凋亡起着重要作用,笔者进一步研究了它的下游通路,通过生物信息学分析发现QKI5 可能是miR-208a 的靶基因。有研究[10-11]发现QKI5 是主要的心脏内源性保护蛋白,可以抑制FOXO1 的表达,这是一种重要的转录因子,可以调节心肌细胞的代谢、增殖、氧化应激、免疫功能和细胞死亡。在增加QKI5 表达时,可以降低心肌组织中导致细胞凋亡的因子Bax、Cas-3 以及FOXO1 的表达,从而可以减轻心肌细胞的损伤。在本究中同样发现抑制miR-208a 可以增加心肌组织中QKI5 的表达,减轻大鼠MIRI。在心肌缺血时可激活炎症反应系统,急性炎症反应又引起继发性心肌损伤,而再灌注又加重心肌急性炎症反应的程度,心肌缺血再灌注引起机体炎症反应激活炎症细胞释放IL-1β、IL-6 和TNF-α 等大量炎性因子,而这三种因子是机体严重炎症反应的关键因子,可以加重心肌功能紊乱、组织纤维化和心肌细胞的坏死[12]。过度炎症刺激导致心肌细胞凋亡级联途径激活,促进凋亡蛋白Cas-3 的表达和激活。Cas-3 可以水解各种细胞内蛋白质并引起细胞凋亡。此外,心肌细胞中Bax 和Bcl2 表达水平的比值也随着炎症水平的增加而增加,从而促进心肌细胞的凋亡[13]。本研究结果显示I/R 大鼠血清中IL-1β、IL-6 和TNF-α 水平高于Sham 组,表明心肌缺血再灌注大鼠体内存在持续性炎症反应,与相关文献报道[14]一致,而抑制miR-208a 表达可以有效降低炎性因子水平及心肌组织中凋亡蛋白Cas-3 的表达,减轻心肌组织缺血区域细胞的坏死和炎性细胞的浸润,增加心肌组织中QKI5 蛋白的表达,从而达到保护I/R 大鼠心肌细胞的作用。
在大鼠MIRI 模型中QKI5 的表达水平显著降低,而给与miR-208a 抑制剂后QKI5 出现明显升高,这说明两者之前存在调控关系,QKI5 可能是miR-208a 在MIRI 过程中的靶基因。笔者利用Western blot 检测了QKI5 的蛋白表达水平,与mRNA 表达相似,QKI5 蛋白在MIRI 中表达下降。通过分析miR-208a 和QKI5 蛋白表达的相关性分析发现miR-208a 与QKI5 表达呈负相关,miR-208a 表达越低,QKI5 表达越高,说明miR-208a很可能是通过QKI5 在MIRI 中发挥作用的。
本研究初步探索了miR-208a 在大鼠MIRI 中的作用及机制,提示其可能是通过调控QKI5 蛋白的表达在心肌缺血再灌注中发挥作用的,这可能成为心肌缺血再灌注损伤一种新的有前途的治疗靶点。但是本研究仍存在一点局限性,目前只是在动物模型中发现两者相关,未进行双荧光素酶实验进行验证,在后续的研究中笔者将进一步深入研究。
