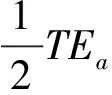IFCC互通性评价更新方案在胱抑素C标准物质互通性评价中的应用*
2022-07-29孙江漫尹显艳于洪远
邵 燕,李 敏,孙江漫,马 婷,尹显艳,于洪远,徐 丽
北京航天总医院:1.检验科;2.科教处,北京 100076
互通性是标准物质的一个重要属性。有报道指出,标准物质的互通性是“对于给定标准物质的规定量,由两个给定测量程序所得测量结果之间关系与另一指定物质所得测量结果之间关系一致程度表示的标准物质特性”[1]。标准物质与临床样本在测量程序间具有互通性是保证临床患者结果可溯源的关键环节,也是标准物质用于量值传递的前提条件。目前标准物质互通性评价方法有两类,分别是2010年和2014年,美国临床和实验室标准化协会(CLSI)发布的文献[2-3]和2015年、2018年国际临床化学与检验医学联合会(IFCC)工作组介绍的互通性评价方案[4]和更新方案[5-7]。目前,国内外尚没有文件明确规定在进行互通性评价时应选用哪种方案。由于目前没有胱抑素C参考测量方法,本研究将两种常规检测方法组成比较对为例,介绍2018年IFCC工作组介绍的互通性评价新方案。
1 材料与方法
1.1仪器 日本日立7170A全自动生化分析仪,德国赛多利斯 LA120S型电子天平,德国艾本德Eppendorf reference移液器。
1.2两种血清胱抑素C常规检测方法基本信息 见表1。

表1 两种血清胱抑素C常规检测方法基本信息
1.3实验样本
1.3.1临床样本 收集42份0.5~8.0 mg/L的无溶血、乳糜、黄疸的单人份人血清样本,每份样本分为两份,置于-80 ℃冰箱保存,文中记为CS1~CS42。
1.3.2标准物质 4个浓度冰冻人血清胱抑素C标准物质,编号为GBW(E)091173~091176,认定值±不确定度分别为(0.89±0.1)、(1.82±0.13)、(3.55±0.28)、(5.25±0.29)mg/L,k=2,文中记为RM1~RM4。
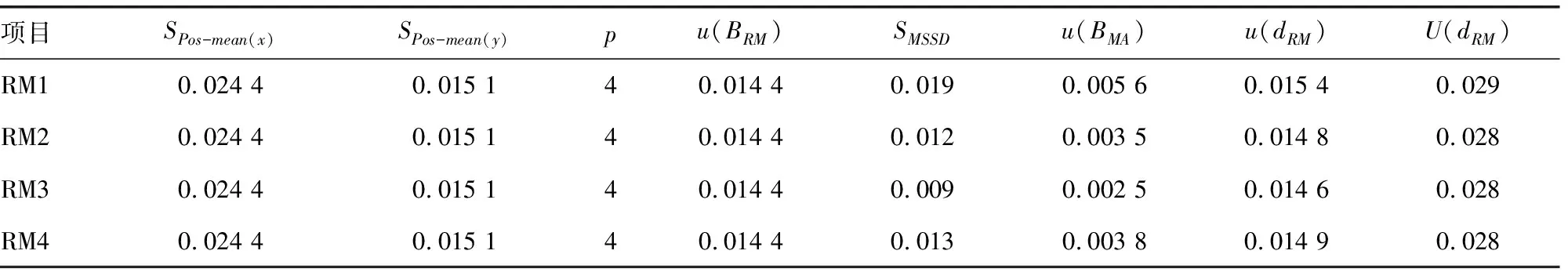
1.4测量方法 在日立7170A全自动生化分析仪上建立2个血清胱抑素C常规检测系统,所有参数均由厂家提供。使用厂家提供的校准品校准,配套质控品测量结果在控后进行临床样本和标准物质的测量。依据方案要求,为了评价标准物质的测量位置对测量结果的影响(位置效应),将标准物质按RM1~RM4的顺序穿插在42例单人份血清标本中测量,每测量2份血清标本后测量1份标准物质,每份实验样本重复测量3次,本研究中设置的每个浓度标准物质的位置数量p=4。
1.5统计学处理
1.5.1绘制临床样本的测量标准偏差图与两种方法之间的偏倚图 使用Excel 2019软件分别计算每种方法测量每份临床样本的浓度均值、标准偏差及Ln(浓度)的标准偏差,以浓度均值为X轴、浓度的标准偏差或Ln(浓度)的标准偏差为Y轴绘制临床样本的测量标准偏差图;计算两种方法测量每份临床样本的浓度均值、浓度差值及Ln(浓度)差值,以两种方法浓度均值为X轴、浓度差值或Ln(浓度)差值为Y轴绘制两种方法之间的偏倚图;判断有无离群值,若有,去除离群值,重新作图。观察偏倚图中偏倚的分散宽度或偏倚随样本浓度的变化趋势,初步判断用浓度值还是Ln(浓度)值用于后续数据处理。偏倚值相对固定、分散宽度较窄、无趋势性变化或趋势性变化较小的情况最理想。

1.5.4标准物质和临床样本在两种方法之的间偏倚差值(dRM)计算 标准物质在两种方法之间的偏倚为BRM,临床样本在两种方法间的平均偏倚为BCS、移动均值记为BMA,则dRM=BRM-BCS或dRM=BRM-BMA。

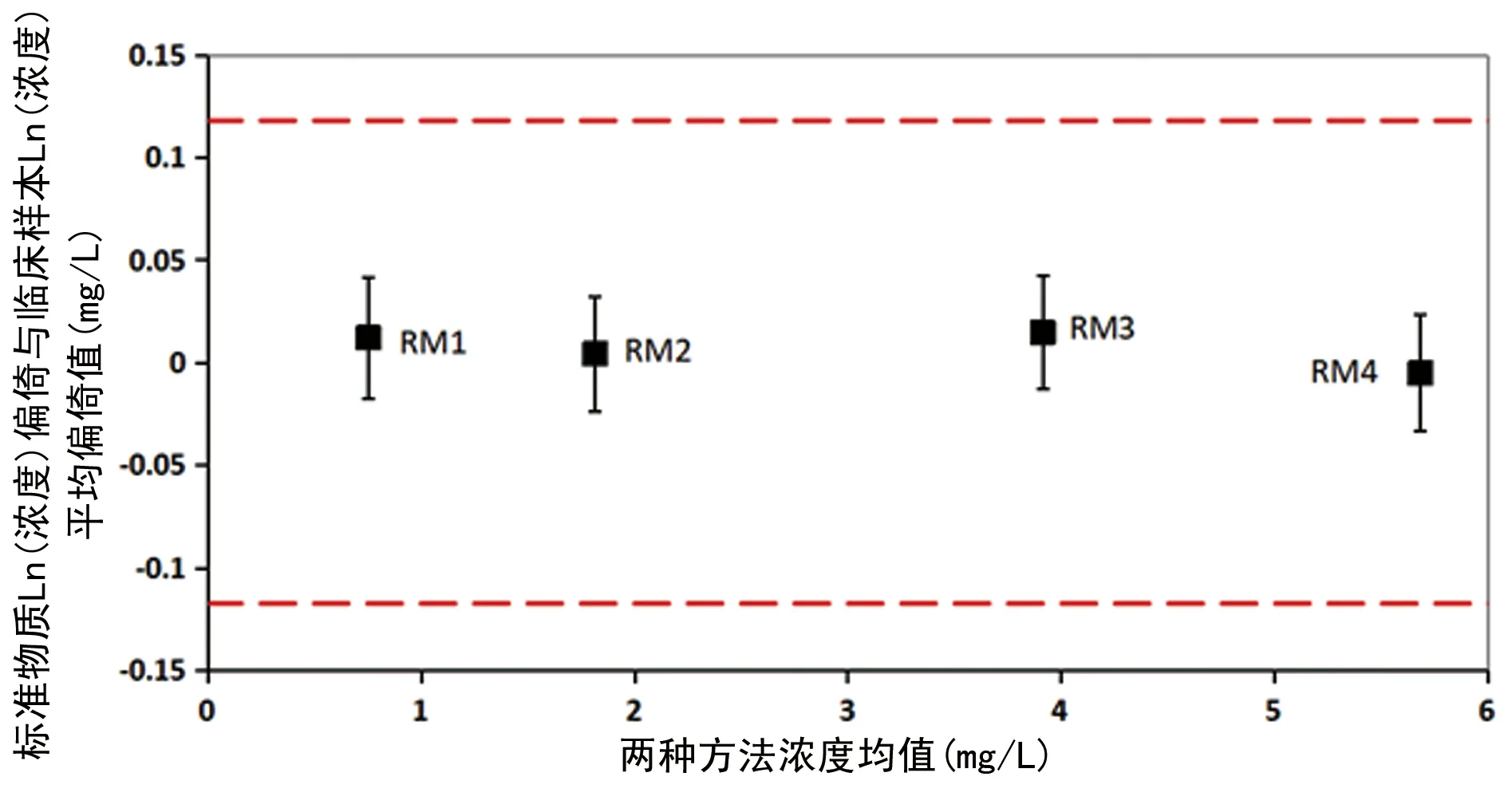
1.5.6标准物质的互通性评价 互通性评价标准设为C,可参考临床允许总误差制定。若dRM±U(dRM)在0±C范围内则表示有互通性,超出这个范围则没有互通性,若范围有重合则表示无法判断。为了更直观地观察互通性评价结果,以两种方法测量标准物质或临床样本的浓度均值为X轴,标准物质和临床样本在两种方法间偏倚差值dRM为Y轴做图,并在图中标出0±C范围及每种标准物质dRM±U(dRM)。
2 结 果
2.1临床样本的测量标准偏差图与两种方法之间的偏倚图 两种方法测量临床样本的浓度和Ln(浓度)的标准偏差图所示没有明显的离群值,见图1、2;两种方法测量临床样本的浓度偏倚和Ln(浓度)偏倚没有明显的离群值,分散宽度较大,肉眼观察均有趋势性,但Ln(浓度)偏倚相对浓度偏倚分散宽度小,所以初步判断采用Ln(浓度)用于后续数据处理,见图3。

图1 A方法临床样本结果标准偏差图
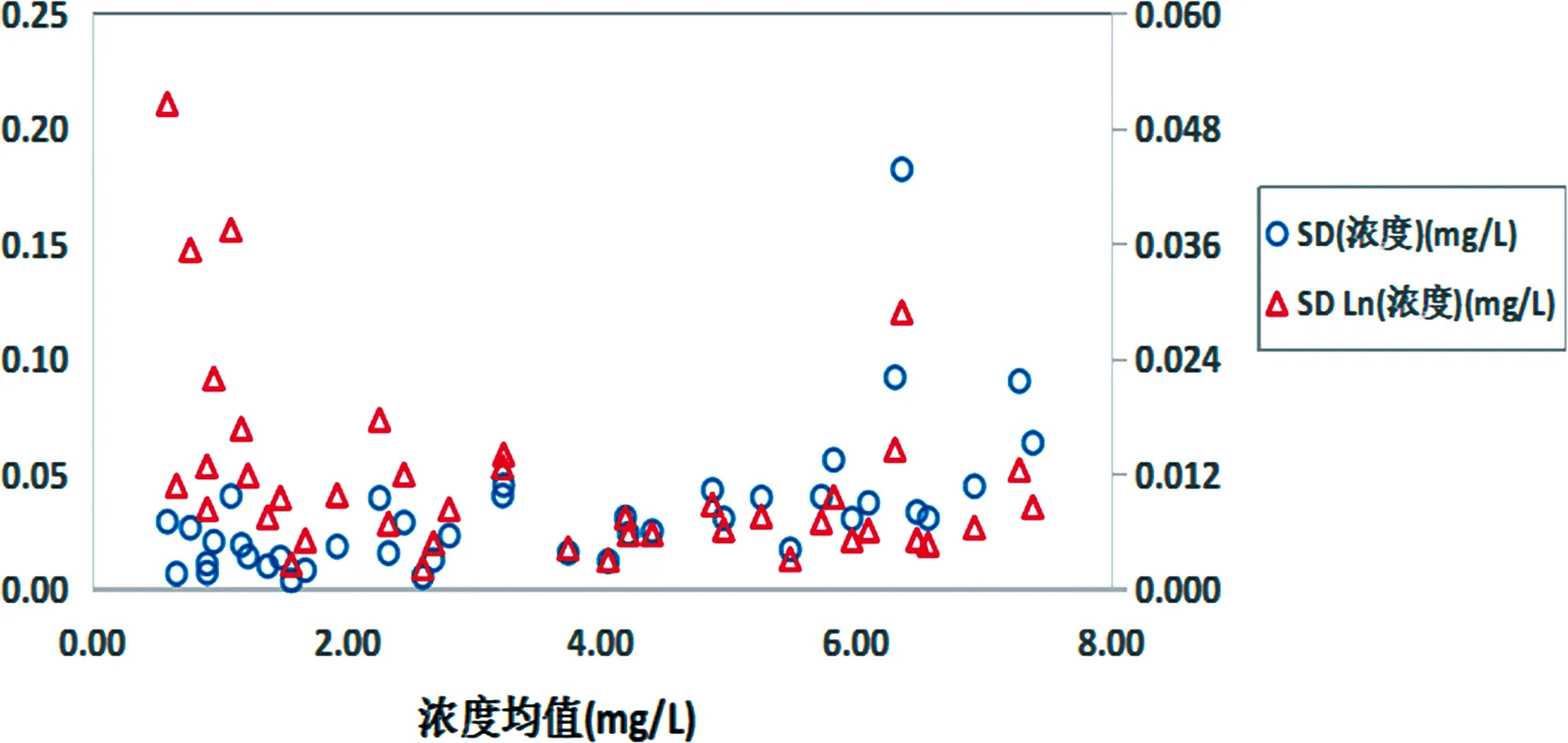
图2 B方法临床样本结果标准偏差图
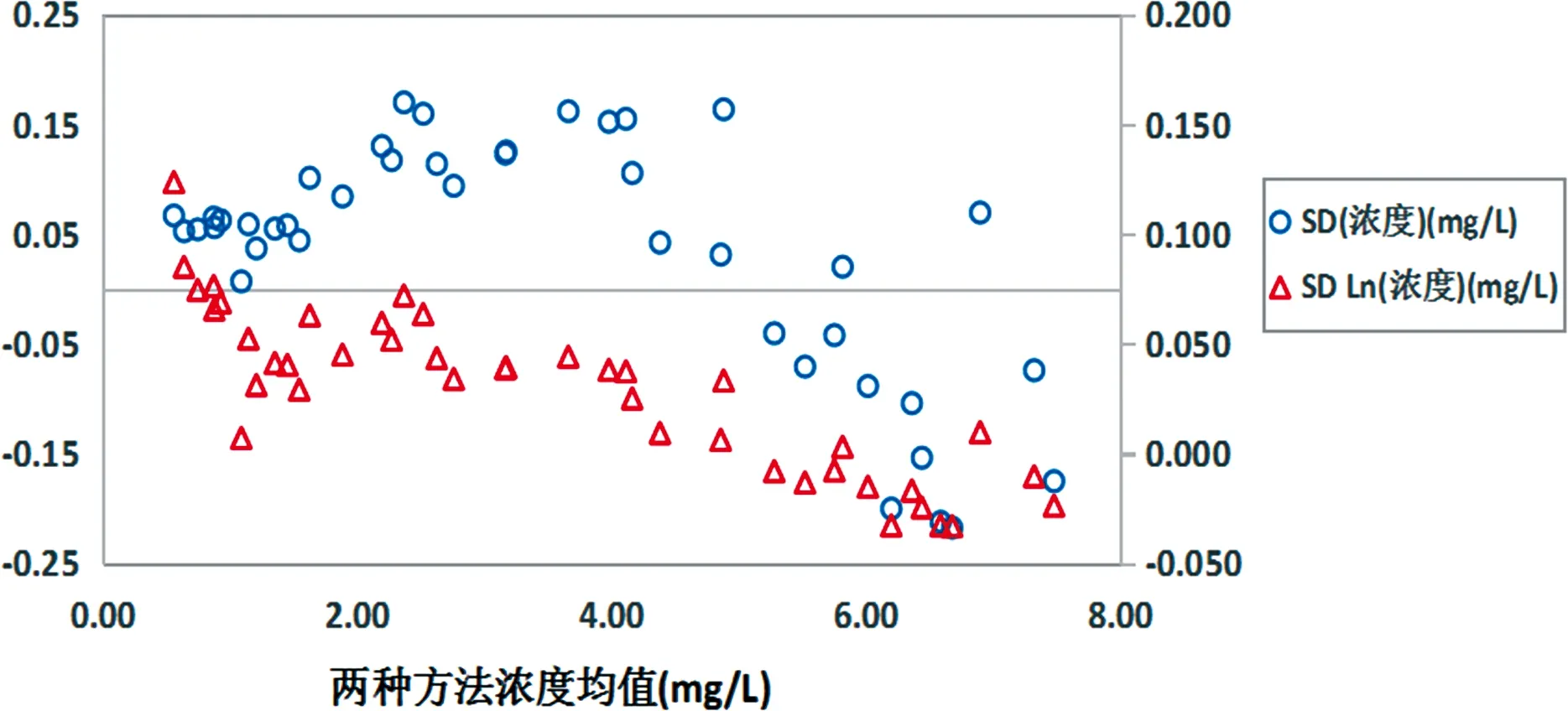
图3 两种方法临床样本测量结果偏倚图
2.2标准物质和临床样本在两种方法之间的偏倚差值(dRM) 根据42份临床样本在两种方法之间的Ln(浓度)偏倚Bi计算平均偏倚BCS为0.029 mg/L,Bi的标准偏差SB为0.037 mg/L,均方递差的标准差SMSSD为0.015 mg/L,Q为0.155。设定显著性水平α=0.05,查询Q分布表,Q0.05=0.75,Q 表2 标准物质和临床样本在两种方法之间的偏倚差值 2.3标准物质和临床样本在两种方法之间偏倚的不确定度U(dRM)评估结果 标准物质RM1~RM4和临床样本在两种方法之间偏倚的不确定度分别为0.029、0.028、0.028及0.028 mg/L,k=1.9,见表3。 表3 标准物质和临床样本在两种方法之间偏倚的不确定度结果(mg/L) 2.4标准物质互通性评价结果 4个浓度胱抑素C标准物质RM1~RM4的dRM±U(dRM)分别为(0.012±0.029)、(0.004±0.028)、(0.015±0.028)、(-0.005±0.028)mg/L,k=1.9,均在互通性评价标准(0.000±0.118)mg/L范围内。见图4。 图4 胱抑素C标准物质互通性评价图 互通性是标准物质、正确度验证品或校准品的重要属性,通过互通性评价不仅可以评价互通性,而且可以同时进行方法学比较、探究不同方法间的结果偏倚;测量项目有参考测量方法时可以同时进行常规测量结果的量值溯源,因此进行互通性评价是必要的。 根据既往研究报道,互通性评价方法大致分为两类[8-14]。一类是EP30-A和EP14-A3的方法,二者均是基于方法学比较的方法,常以Y预测值的±95%置信区间来判断互通性,评价过程方便快捷,但其受评价方法间一致性的影响较大,两种方法的一致性越好,标准物质越不可能具有互通性,因此导致标准物质的互通性评价结论不可靠;另一类是IFCC工作组2015年和2018年介绍的方法,均是基于被评价标准物质在两种方法之间的偏倚与临床样本平均偏倚的一致关系判断的。2018年的更新方案更细致、具体,利用标准物质在两种方法之间的偏倚与临床样本偏倚的差值是否符合医学预期需求判断互通性。 通过研究发现,IFCC更新方案评价过程较繁琐,但切实、可行,更符合医学预期用途。不同待评价物质对应的偏倚模型、数据转换及不确定度计算公式可能稍有不同,但评价过程和数据处理方法相似,可供读者参考。在使用标准物质作为校准品时,应使用不同的方法对标准物质的互通性进行评价,以保证互通性评价结果的可靠性。当不同方法的互通性评价结果有差异时,应分析差异原因,选择合适的互通性评价方案。
3 讨 论