无毒性产气荚膜梭菌α毒素重组蛋白的自诱导分泌表达及免疫原性分析
2022-07-29魏后军范志宇仇汝龙陈萌萌宋艳华徐为中
魏后军, 范志宇, 胡 波, 仇汝龙, 陈萌萌, 宋艳华, 徐为中, 王 芳
(江苏省农业科学院兽医研究所/农业农村部兽用生物制品工程重点实验室,江苏南京 210014)
产气荚膜梭菌()也称魏氏梭菌,是引起各种动物坏死性肠炎、肠毒血症、人畜创伤性气性坏疽的主要病原菌之一。该菌的致病因子是其分泌的外毒素,主要是、、和毒素,据此将该菌分为A、B、C、D、E等5个毒素型;各毒素型均产生毒素,毒素是产气荚膜梭菌主要的毒力因子,其中A型产气荚膜梭菌分泌毒素最多。毒素基因位于染色体上,大小为1 194 bp,编码的产物由398 个氨基酸残基组成,其中前28 个氨基酸为信号肽,成熟肽为 370 个氨基酸。毒素具有磷脂酶C和鞘磷脂酶2种酶活性,能同时水解细胞膜上的磷脂酰胆碱和鞘磷脂,导致细胞裂解,因而具有细胞毒性、溶血活性和血小板聚集等特性。因此,研究者利用基因工程技术将毒素去毒性,作为抗原研制疫苗。
Studier提出了外源基因表达自诱导(auto-induction)的方法。其原理是大肠杆菌首先以葡萄糖为碳源生长,葡萄糖消耗殆尽,达到一定活力后,开始消耗培养基中的乳糖,在乳糖渗透酶(lactose permease)和-半乳糖苷酶(-galactosidase)的作用下,乳糖穿过细胞膜并部分转化为异乳糖开启了T7表达系统,乳糖的代谢产物葡萄糖和半乳糖也可作为碳源。与IPTG(isopropyl--thiogalactoside)相比,乳糖无细胞毒性、价格较低,自诱导的培养基中含有诱导剂,无需在培养过程中检测重组菌的生长情况添加诱导剂。
本研究对含信号肽的毒素基因进行突变去毒及密码子优化,采用大肠杆菌表达系统自诱导分泌表达了无毒的产气荚膜梭菌α毒素重组蛋白,该方法具有安全、抗原免疫原性好、工艺简单、成本低等优点,研制的疫苗能有效避免现有疫苗生产工艺较复杂、成本较高等问题。本研究为研制产气荚膜梭菌毒素基因工程疫苗提供了技术保障。
1 材料与方法
1.1 主要试验材料
A型产气荚膜梭菌(苏84-A株)由笔者所在实验室鉴定、保存;兔产气荚膜梭菌病(A型)灭活疫苗购自山东华宏生物工程有限公司,主要成分为灭活的苏84-A株全菌液,用量为2 mL/只;细菌基因组DNA提取试剂盒购自TIANGEN公司;高保真酶购自 Invitrogen 公司;凝胶回收纯化试剂盒购自TaKaRa公司;大肠杆菌() BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;牛血清白蛋白(BSA)购自上海翊圣生物科技有限公司;A型产气荚膜梭菌毒素为A型产气荚膜梭菌(苏84-A株)在肉肝胃膜汤中培养的滤液(16~20 g小鼠的毒素含量为50 MLD/mL),由笔者所在实验室制备、保存;A型产气荚膜梭菌毒素的兔源多克隆抗体由笔者所在实验室制备、保存;HRP标记的羊抗兔IgG购自北京鼎国昌盛生物技术有限公司;自诱导培养基配方:10 g/L 胰蛋白胨、5 g/L酵母提取物、5 g/L 甘油、0.25 g/L 葡萄糖、25 mmol/L NaHPO、25 mmol/L KHPO、50 mmol/L NHCl、5 mmol/L NaSO、2 mmol/L MgSO、1 g/L乳糖。
1.2 α毒素基因序列的测定
根据GenBank上公布的α毒素基因序列(GenBank:AY823400.1)设计引物,上游引物:5′-G C G G A A T T C A T G A A A A G A A A G A T T T G T A A G-3′,下游引物:5′-G C G C T C G A G T T A T T T T A T A T T A T A A G T T G-3′,由南京擎科生物科技有限公司合成。以A型产气荚膜梭菌(苏84-A株)DNA为模板,PCR反应体系:模板1 μL,高保真酶0.2 μL,10×Buffer 5 μL,上、下游引物(20 μmol/L)各 0.5 μL,dNTPs(25 mmol/L)4 μL,MgSO(50 mmol/L)2 μL,ddHO 37 μL;反应程序:94 ℃ 2 min;94 ℃ 30 s,62.0 ℃ 1 min,68 ℃ 1.5 min,30个循环;68 ℃ 10 min。PCR扩增产物经琼脂糖凝胶电泳后,用胶回收试剂盒回收目的片段。回收的目的片段测序,获得毒素基因序列(苏84-A株)。
1.3 重组菌的构建
根据毒素测序结果,将毒素的第176位组氨酸(CAT)突变为天冬酰胺(AAT),同时对信号肽序列进行密码子优化;将化学合成的该序列插入到载体pET32a(RⅠ和Ⅰ酶切位点之间),获得重组质粒pET32a-αH176N。将重组质粒转化BL21(DE3)感受态细胞,涂布于含氨苄青霉素的抗性LB平板,37℃静置培养过夜。挑取单菌落接种于含氨苄青霉素的抗性LB液体培养基,37 ℃振摇过夜,菌液经PCR鉴定阳性,将该菌株命名为大肠杆菌BL21(DE3)/pET32a-αH176N株。
1.4 重组蛋白的表达、鉴定
将大肠杆菌BL21(DE3)/pET32a-αH176N株以1%接种于含氨苄青霉素的抗性自诱导培养基,28 ℃振摇培养24 h后,6 000 r/min 离心15 min,收集上清,经0.22 μm孔径滤膜过滤后,获得重组蛋白αH176N,在αH176N蛋白及100、50、25 μg/mL 的BSA中分别加入4×SDS上样缓冲液混匀,煮沸 5~8 min,进行SDS-PAGE分析;同时以A型产气荚膜梭菌毒素的兔源多克隆抗体为一抗,HRP标记的羊抗兔IgG为二抗,对αH176N蛋白进行Western blot鉴定。
1.5 自诱导条件的优化
将大肠杆菌BL21(DE3)/pET32a-αH176N株以1%接种于含1、2、4 g/L乳糖的自诱导培养基,每个乳糖浓度的培养基分别在16、28、37 ℃振摇培养24 h后,6 000 r/min 离心15 min,收集上清,经 0.22 μm 孔径滤膜过滤后,分别加入4×SDS上样缓冲液混匀,煮沸5~8 min,进行12% SDS-PAGE分析。
1.6 重组蛋白的毒性测定
1.6.1 卵磷脂酶活性试验毒素具有磷脂酶C活性,能将卵黄中的磷酸卵磷脂特异性的水解成磷酰胆碱和1,2-甘油二脂,产生白色混浊。将αH176N蛋白和野生型毒素,分别滴加2 μL到卵黄琼脂平板,37 ℃静置1 h后,观察滴加的位置是否出现白色混浊斑。
1.6.2 小鼠毒力试验 10只16~20 g小鼠,随机分成2组,每组5只。其中1组作为对照组,将空载体大肠杆菌BL21(DE3)/pET32a自诱导的全菌液,离心后取上清,经0.22 μm孔径滤膜的滤液,尾静脉注射小鼠0.3 mL/只;另1组小鼠,尾静脉注射αH176N蛋白液0.3 mL/只,连续观察7 d。
1.7 与灭活疫苗效力试验比较
将制备的αH176N蛋白(62.4 μg/mL),与氢氧化铝胶按9 ∶1的比例加入氢氧化铝胶佐剂,作为本次试验用基因工程疫苗;将A型产气荚膜梭菌(苏84-A株)在肉肝胃膜汤中培养的滤液(16~20 g小鼠的毒素含量为50 MLD/mL),用甲醛灭活后与氢氧化铝胶按9 ∶1的比例加入氢氧化铝胶佐剂,作为本次试验用自制类毒素疫苗。分别将基因工程疫苗(1、0.25、0.125 mL)、自制类毒素疫苗(2、1 mL)、商品化疫苗(2 mL)免疫1.5~2.0 kg健康易感家兔,每个剂量组各6只,21 d后,连同6只对照组,耳缘静脉注射1 MLD的 A型产气荚膜梭菌毒素,连续观察3~5 d。
2 结果与分析
2.1 α毒素基因序列的测定
以A型产气荚膜梭菌(苏84-A株)DNA为模板,进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳分析表明:扩增出约1 200 bp的片段,与预期结果相符(图1)。回收目的片段,测序获得α毒素基因序列。
2.2 重组αH176N蛋白的表达与鉴定
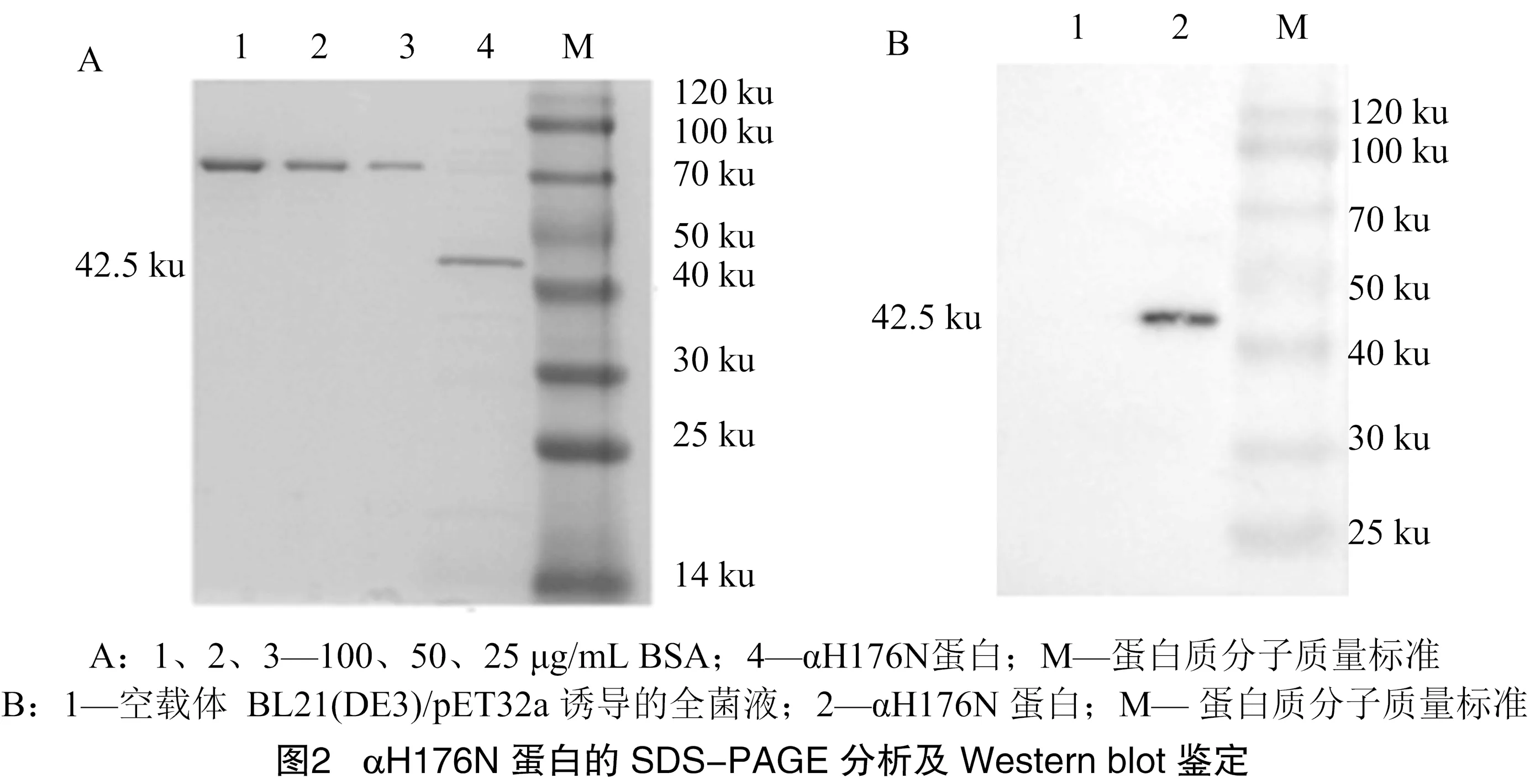
大肠杆菌BL21(DE3)/pET32a-αH176N株在自诱导培养基中发酵培养,SDS-PAGE电泳分析显示,蛋白分泌到培养基中 (图2-A),通过QuantiyOne软件,计算蛋白含量为50.1 μg/mL。Western blot结果显示,αH176N蛋白有约42.5 ku大小的目的条带,空载体大肠杆菌BL21(DE3)/pET32a经诱导的全菌液无条带,表明目的蛋白已得到分泌表达。

2.3 自诱导条件的优化结果
将大肠杆菌BL21(DE3)/pET32a-αH176N株以1%接种于含1、2、4 g/L乳糖的自诱导培养基,每个乳糖浓度的培养基分别在16、28、37 ℃振摇培养24 h后,收获蛋白,经SDS-PAGE分析,在含1~2 g/L 乳糖的自诱导培养基及28 ℃诱导条件下,可以获得较多分泌表达的目的蛋白(图3)。
2.4 重组αH176N蛋白的毒性
野生型α毒素在卵黄琼脂平板上出现白色混浊斑,而αH176N蛋白不出现白色混浊斑,说明αH176N蛋白已不具备毒素的磷脂酶C活性。将αH176N蛋白尾静脉注射小鼠,观察期内,连同对照组小鼠均健活且无不良反应,说明重组蛋白αH176N是无毒的。

2.5 免疫保护试验
分别将基因工程疫苗、自制类毒素疫苗、商品化疫苗免疫试验兔,21 d后攻毒,结果显示,基因工程疫苗0.25 mL/只免疫保护效果优于类毒素疫苗 2 mL/只 及商品化疫苗2 mL/只的免疫保护效果(表1)。

表1 免疫攻毒试验结果
3 讨论与结论
目前商品化的产气荚膜梭菌灭活疫苗是将厌氧培养的产气荚膜梭菌菌液或外毒素灭活制备而成,存在抗原成分复杂、稳定性差、副作用大以及灭活不彻底等安全隐患问题。而有关产气荚膜梭菌毒素基因工程疫苗的研究大多采用大肠杆菌表达系统、以截短表达或多点突变的方法使毒素去毒性。毒素蛋白通常在胞内以不可溶性的包涵体或胞内的可溶性蛋白表达。包涵体形式表达影响了毒素的天然结构,使其失去生物活性,需进行复性处理;胞内的可溶性蛋白具有生物活性,但含杂蛋白较多,需进行复杂的纯化过程;且重组大肠杆菌采用IPTG作为诱导剂,需要依据检测重组菌的生长情况添加诱导剂。
本研究通过基因工程技术突变毒素蛋白的1个氨基酸,使其失去毒性,同时保留其天然结构和分子特征。此外,本研究采用自诱导分泌表达技术,以培养基中天然成分乳糖作为诱导剂,并对信号肽序列进行优化,实现重组毒素“胞外分泌”,直接以可溶的形式分泌释放到培养基中,无需添加化学诱导剂。将制备的αH176N蛋白液与氢氧化铝胶配制成的疫苗,免疫0.25 mL/只就能达到100%(6/6)保护的效果,且具有抗原成分单一、安全性好、工艺简单和成本低等优点,可为多联苗、多价苗的研究奠定基础。
