蜱类先天免疫反应研究进展
2022-07-25范香媛张金成胡永红
范香媛,张金成,胡永红*
(1.河北师范大学 生命科学学院,河北 石家庄 050024;2.石家庄邮电职业技术学院,河北 石家庄 050021)
蜱是专性吸血体外寄生虫,是仅次于蚊子的世界第二大传播疾病媒介,可以将多种病原体(细菌、病毒、真菌、原生动物等)传播给宿主,但因其存在先天性免疫,在受到病原体感染后不影响自身的生存和发育[1-2]。蜱的先天免疫是受到病原体侵染后激活的,尽管蜱-病原体之间已共存进化了3亿多年,但很少有微生物能克服蜱的先天性免疫系统[3-4]。
与同时具备先天性免疫和获得性免疫的脊椎动物不同,由于缺乏淋巴细胞、胸腺和抗体,蜱只具备先天免疫[5]。蜱的先天免疫包括细胞免疫和体液免疫,两者协同作用。细胞免疫包括吞噬、结节化或包裹入侵微生物的作用,由含硫酯蛋白质(thioester-containing proteins,TEPs)、纤维蛋白原相关凝集素和转化酶因子组成的原始补体系统所调节[6];体液免疫主要包括抗菌肽(antimicrobial peptides,AMPs),例如防御素和溶菌酶,这些肽直接杀死、诱捕或抑制入侵者。此外,蜱还表达凝集素、蛋白酶抑制剂以及氧化应激蛋白,如谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)、超氧化物歧化酶(superoxide dismutase,SOD)来杀死或抑制微生物[7]。因此,了解蜱的先天免疫,掌握蜱-病原体之间的免疫学,以期为筛选新的抗蜱疫苗靶点提供理论依据。
1 蜱中肠免疫
中肠免疫对蜱作为传播媒介的能力有决定性影响,其肠道内容物会对入侵的微生物产生不利影响,主要原因为中肠内存在的宿主血红蛋白片段以及AMPs具有抗菌活性,能够防御革兰阳性菌、革兰阴性菌和一些真菌[8]。具有抗菌活性的血红蛋白片段最早从微小扇头蜱(Rhipicephalusmicroplus) 中肠分离,后在其他软蜱、硬蜱物种中肠内也鉴定到[9-10]。例如,墨巴钝缘蜱(Ornithodorosmoubata) 中肠腔内的兔血红蛋白片段,具有抗金黄色葡萄球菌(Staphylococcusaureus) 活性[11]。
产吲哚金黄杆菌(Chryseobacteriumindologenes) 侵染墨巴钝缘蜱时,蜱中肠至少分泌2种抗菌化合物来保护自身,包括防御素和溶菌酶[12]。塞氏钝缘蜱(Ornithodorossavignyi) 中肠内存在一种22个氨基酸组成的防御素,其能杀灭革兰阳性菌和革兰阴性菌[13]。据报道,一种名为longicin的防御素分子在长角血蜱(Haemaphysalislongicornis) 中肠表达,其对多种微生物具有抗菌活性,包括革兰阳性菌、革兰阴性菌、真菌和各种巴贝斯虫[14]。TGL (tick gut lysozyme)是从墨巴钝缘蜱中肠分离出的第一个溶菌酶,其可水解革兰阳性菌细胞壁肽聚糖中N-乙酰胞壁酸与N-乙酰氨基葡萄糖之间的1,4-β-糖苷键,具有杀菌作用[15]。
此外,当嗜吞噬细胞无形体(Anaplasmaphagocytophilum) 入侵微小扇头蜱时,蜱体内GST和SOD基因表达上调,沉默该基因有利于嗜吞噬细胞无形体的生存和繁殖,表明GST和SOD可影响嗜吞噬细胞无形体对蜱的侵染[16]。牛巴贝斯虫(Bovinebabesiosis) 体外培养试验证明,培养基中半胱氨酸蛋白酶抑制剂浓度越高,牛巴贝斯虫的生长越缓慢,表明微小扇头蜱半胱氨酸蛋白酶抑制剂能抑制牛巴贝斯虫的生长[17]。
2 蜱血淋巴免疫
2.1 细胞免疫
2.1.1蜱血细胞 病原体从蜱中肠到外周组织过程中,面临着细胞和体液免疫的双重防御屏障。蜱类血淋巴内的先天性免疫主要与细胞和体液免疫有关。根据不同蜱种血淋巴细胞的形态和生理研究,鉴定描述了4种基本类型的蜱血细胞,即原血细胞,浆细胞,粒细胞和小球细胞,其中粒细胞又分为粒细胞Ⅰ和粒细胞Ⅱ[18]。免疫组化电镜结果显示,浆细胞和粒细胞Ⅰ中有溶酶体,表现出较强的溶菌活性[19]。将伯氏疏螺旋体(Borreliaburgdorferi)注射进变异革蜱(Dermacentorvariabili) 雌蜱体腔,24 h后免疫荧光检测血淋巴、唾液腺和卵巢,均未发现伯氏疏螺旋体,推测其被血细胞吞噬清除[20]。将产吲哚金黄杆菌感染篦子硬蜱(Ixodesricinus) 和墨巴钝缘蜱,荧光显微镜检测发现,2种蜱的血细胞对产吲哚金黄杆菌均有明显吞噬作用[21]。相比之下,蜱血细胞对革兰阴性菌大肠杆菌(Escherichiacoli) 的抑制作用是通过一种非黑色素封装的形式,即血细胞在细菌周围聚集,从而将其隔离并最终消化,此过程称为结节化。而体积太大不能被吞噬或结节化破坏的病原体,如寄生虫和线虫,蜱血细胞可通过包裹来消除[22]。
2.1.2原始补体系统 蜱血细胞对微生物的吞噬作用与一个原始补体系统相关。蜱具有原始的补体系统,包括TEPs、纤维蛋白原相关凝集素和转化酶因子[23]。α2-巨球蛋白家族属于TEPs,是进化上最古老、最保守的天然免疫成分。墨巴钝缘蜱中分离的α2-巨球蛋是蜱类中描述的第1种TEPs,随后在蓖子硬蜱中也分离出α2-巨球蛋白。通过RNAi技术沉默蓖子硬蜱血淋巴中α2-巨球蛋白,可显著降低蜱血细胞对产吲哚金黄杆菌的吞噬作用,表明α2-巨球蛋白参与了蜱血细胞对产吲哚金黄杆菌的吞噬[24]。纤维蛋白原相关凝集素是一种模式识别受体,与入侵微生物表面存在的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)相互作用,被认为是蜱血淋巴内自我与非自我识别的关键。通过RNAi沉默蓖子硬蜱凝集素基因ixoderins,再将蜱血淋巴加到含大肠杆菌或白色念珠菌(Canidiaalbicans)培养基中,结果发现沉默ixoderins显著降低蜱血细胞对两种菌的吞噬作用,表明ixoderins介导了蜱血细胞对大肠杆菌和白色念珠菌的吞噬[25]。
2.2 体液免疫
2.2.1抗菌肽 蜱血淋巴中还存在多种类型的体液因子,它们是体液免疫反应的分子基础。蜱类可通过这些体液因子保护自己免受微生物感染,其包括防御素、溶菌酶、凝集素以及一些蛋白酶抑制剂等,而蜱类防御素的报道最常见。防御素主要通过与入侵微生物的细胞壁或细胞膜结合,破坏其结构或膜电位,最终杀死靶细胞。希伯来花蜱(Amblyommahebraeum)血淋巴中存在两种非阳离子防御素,体外抑菌试验表明,它们对大肠杆菌和金黄色葡萄球菌有抗菌活性[26]。此外,美洲花蜱(Amblyommaamericanum) 、蓖子硬蜱、微小扇头蜱、森林革蜱(Dermacentorsilvarum) 和墨巴钝缘蜱中都已鉴定出防御素的存在。变异革蜱侵染大肠杆菌试验结果显示,蜱血淋巴中c型溶菌酶表达水平升高,表明c型溶菌酶参与了蜱对大肠杆菌的先天免疫防御[27]。
2.2.2凝集素 凝集素是含有特异性单聚糖或低聚糖结合位点的蛋白质或糖蛋白,可特异性地识别并结合细菌、真菌细胞壁或细胞膜上的碳水化合物分子,特别是唾液酸和N-乙酰-D-葡萄糖胺[29]。这种特异性结合用于识别革兰阴性细菌。此外,凝集素可诱导细菌凝集;也可作为受体识别微生物,增强血细胞对微生物的吞噬作用[29]。Dorin M是从墨巴钝缘蜱血淋巴中纯化的第1个蜱凝集素,是一种糖蛋白,相对分子质量约640 kDa。其在血细胞中合成并分泌到血淋巴中,可作为模式识别分子发挥作用,参与蜱的先天免疫[30]。
2.2.3蛋白酶抑制剂 微小扇头蜱血细胞中的丝氨酸蛋白酶抑制剂也表现出较强的抗菌活性,推测是通过抑制病原体中丝氨酸蛋白酶活性引起的级联反应,但其抗菌活性的分子机制尚不清楚[31]。
3 蜱唾液腺免疫
蜱类唾液腺的主要功能是浓缩血液中营养物质并分泌具有药理活性的分子,同时将多余水分和离子返回宿主体内。蜱经唾液将病原体传播给宿主,这是蜱源性病原体传播的最常见途径[32]。因此,蜱类唾液腺和唾液在调节蜱-病原体-宿主界面的免疫反应中起着不可或缺的作用。
但已发现的唾液中对病原体有防御作用的因子尚少。随着硬蜱和软蜱唾液腺转录组测序数量的增加,有研究发现蜱唾液腺组织中有多种AMPs的表达,例如防御素和溶菌酶[33-35]。Ixosin-B是从中华硬蜱(Ixodessinensis) 唾液腺纯化出的防御素,其对细菌和真菌均具有抗菌活性[36]。长角血蜱唾液腺中一种名为longicornisin的防御素样肽,相对分子质量约为10 kDa,其对幽门螺旋杆菌(Helicobacterpylori)和真菌也具有较强的抑菌活性[37]。长角血蜱在被金黄色葡萄球菌或大肠杆菌侵染后,唾液腺中的溶菌酶基因转录水平升高,表明该溶菌酶参与了长角血蜱对金黄色葡萄球菌和大肠杆菌的先天免疫防御[38]。
凝集素OMFREP和Ixoderin B分别在墨巴钝缘蜱和蓖子硬蜱的唾液腺中被检测到,与鲎凝集素序列相似,推测其与先天免疫有关[39]。钝刺血蜱(Haemaphysalisdoenitzi)丝氨酸蛋白酶抑制剂(serine protease inhibitor,HDS)HDS1和HDS2的抗菌活性实验表明,其重组蛋白rHDS1和rHDS2对细菌和真菌都具有一定的抑制活性,且rHDS1对白色念珠菌的杀菌作用最强,rHDS2对新生隐球菌(Cryptococcusneoformans) 具有最强的杀菌作用[40]。然而,这些唾液腺AMPs是否分泌到蜱唾液或血淋巴中,以及是否与病原体直接相互作用,仍未得到证实。
4 蜱的免疫调控
蜱的免疫系统通过多种调控机制来抵御病原体入侵。昆虫体内调节先天性免疫的信号通路分别是Toll、IMD(immunodeficiency)、JAK-STAT(janus kinase/signal transducers and activators of transcription),这3条通路在信号传递过程中协同作用[41]。与昆虫相似,蜱类也存在调节先天免疫反应的信号通路[42]。硬蜱基因组分析表明,蜱体内含有Toll、IMD、JAK-STAT免疫通路的大多数成分,且经典免疫的相关基因和途径存在显著多样性[9]。模式识别受体(pattern recognition receptors,PRRs)对微生物表面PAMPs的识别能够触发特定免疫信号通路。
4.1 Toll信号通路在昆虫中,肽聚糖识别受体蛋白(peptidoglycan recognition receptor proteins,PGRPs)可识别革兰阳性菌细胞壁的赖氨酸型肽聚糖;革兰阴性结合蛋白(gram-negative binding proteins,GNBPs)可识别真菌的β-1,3-葡聚糖[43]。PGRPs或GNBPs可与PAMPs结合导致细胞外ModSP和Grass的激活。Spz被裂解并与Toll受体结合,接着Toll受体与Myd88二聚体结合并激活与蛋白激酶Pelle相互作用的适配分子Tube,使Cactus被磷酸化后降解,导致Diff和Dorsal基因上调,最终调控AMPs的表达[44]。蜱与昆虫比较,其Toll通路含有除GNBPs和Diff之外的所有关键基因,提示蜱中存在Toll信号通路,且在先天免疫反应中发挥重要作用。
4.2 IMD信号通路革兰阴性菌细胞壁成分二氨基庚二酸型肽聚糖可与果蝇细胞内或跨膜肽聚糖识别蛋白结合,激活IMD信号通路并触发特异性AMPs的合成[45]。在蜱中未发现IMD途径中的几个关键成分,如跨膜PGRPs、IMD、dFADD等,但XIAP (X-linked inhibitor of apoptosis)可直接与Bendless结合调控蜱体内IMD途径,激活蛋白TAB2、TAK1、IKKγ和IKKβ,并磷酸化Relish,诱导AMPs的转录生成[44]。研究表明,细菌感染微小扇头蜱时,IMD通路tak1、tab2、ikkγ、ikkβ等基因转录上调[46]。这些研究为深入研究蜱类IMD途径提供依据。
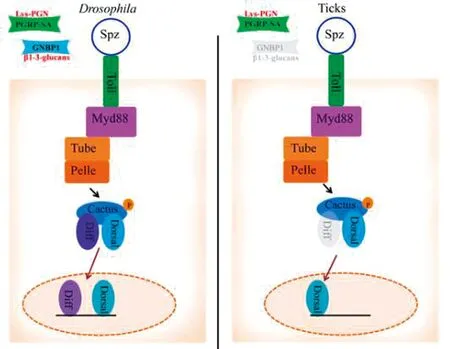
图1 果蝇与蜱中Toll通路比较[44]
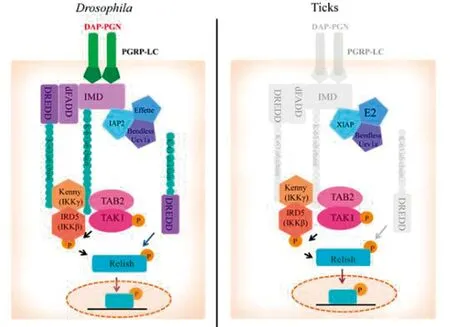
图2 果蝇与蜱中IMD通路比较[44]
4.3 JAK-STAT信号通路JAK-STAT信号通路可能参与昆虫的抗病毒免疫应答,该途径不是由病毒配体直接引起的,而是由细胞感染过程中释放的细胞因子所诱导[47]。JAK-STAT途径所有下游成分在微小扇头蜱和肩突硬蜱基因组中被检测出来,包括跨膜细胞因子受体Domeless、酪氨酸激酶JAK、转录因子STAT、信号转导适配分子STAM、抑制剂蛋白PIAS和细胞因子信号传导抑制剂SOCS[46]。研究发现,肩突硬蜱 (Ixodesscapularis)中一类编码5.3 kDa AMPs家族的基因表达直接受到STAT转录因子的调控,该基因在嗜吞噬细胞无形体感染蜱过程中显著上调。用RNAi干扰JAK-STAT信号通路后,嗜吞噬细胞无形体在蜱唾液腺和血淋巴中的感染水平显著升高。结果表明,蜱类通过JAK-STAT信号通路调控这一类AMPs基因的表达,以抑制嗜吞噬细胞无形体的感染[48]。
5 总结与展望
蜱的媒介能力与其免疫系统密切相关,但我们对蜱先天免疫的总体认知远远落后于昆虫。蜱与昆虫先天免疫反应机制具有一定的相似性,因而可通过分子生物学、免疫学、蛋白质组学等研究,促进蜱先天免疫的研究。随着多种蜱基因组的公布以及RNAi技术干扰蜱的可行性,有助于阐明蜱体内先天免疫反应的分子机制以及各分子在先天免疫中的调控作用[49]。此外,全面了解蜱类先天免疫,找到其免疫信号通路及免疫反应中关键基因,为筛选新的靶标位点,有效防控蜱及蜱媒疾病提供科学依据。
