mRNA疫苗研究进展及其在传染病防控中的应用
2022-07-25李月华刘拂晓
尼 博,李月华,刘拂晓,魏 荣*
(1.中国动物卫生与流行病学中心,山东 青岛 266032;2.青岛农业大学 动物医学院,山东 青岛 266109)
1796年,英国医生爱德华·詹纳将牛痘液接种男童并成功预防天花,第1支疫苗诞生[1]。19世纪中叶,巴斯德创造性地运用物理、化学、微生物手段灭活、致弱病原,创造出了真正意义上的疫苗[2]。
从此人类拥有了能主动防御传染病的武器,全世界30多种人、畜烈性传染病因疫苗的推广使用而被根除或控制。
目前,已开发出的疫苗包括灭活疫苗、弱毒疫苗、亚单位疫苗、病毒载体疫苗、核酸疫苗等,他们各有优缺点。灭活疫苗、亚单位疫苗的安全性高,但是免疫原性差,能诱导体液免疫和较弱的细胞免疫;弱毒疫苗、载体疫苗的免疫原性较强,能够诱导较强的体液免疫与细胞免疫,但是安全性较差,存在核酸整合进宿主基因组中的风险,同时弱毒疫苗还存在使用后散毒、毒力返强的风险;核酸疫苗中,DNA疫苗能够诱导体液免疫与细胞免疫,但是保护效率较低,且存在核酸整合进宿主基因中的风险[3-4]。
mRNA疫苗是近年兴起的一种新型的疫苗,其属于核酸疫苗[5]。1989年MALONE等[6]将mRNA用阳离子包裹后,转染进入多种细胞系并成功表达目的蛋白。1990年,WOLFF等[7]将包含目的基因的mRNA表达载体,注射进小鼠骨骼肌内,首次证明mRNA疫苗能够在体内长时间大量表达。以后的30年中,研究人员从递呈载体、核酸链稳定性、抗原表达效率、降低过敏反应等多个方面对mRNA疫苗进行改进,克服了大量使用瓶颈[8]。现在mRNA疫苗已经具有诸多优势,如:抗原表达效率高,因无需进入细胞核即可完成翻译,其翻译效率是DNA疫苗的数倍;安全性强,生产过程无病原及抗生素的使用,提高了生物安全性,同时mRNA疫苗不存在整合进入宿主基因组的风险;免疫原性强,能够同时激活体液免疫与细胞免疫,满足抵御各类病原体的需要;编译性强,可根据需要进行目的抗原编译,实现交叉保护与鉴别诊断等性能。本文对mRNA疫苗的研究进展及其在传染病防控中的应用实例进行总结,旨在为新型疫苗研发提供参考。
1 mRNA疫苗分类
mRNA疫苗可分为常规mRNA疫苗(conventional mRNA vaccine)与自扩增型mRNA疫苗(self-amplifying mRNA vaccine,SAM vaccine) (图1)[6]。两种mRNA疫苗都可以通过cDNA、线性化的质粒DNA体外转录而成,经递呈系统转导进入细胞,表达目的抗原[9]。
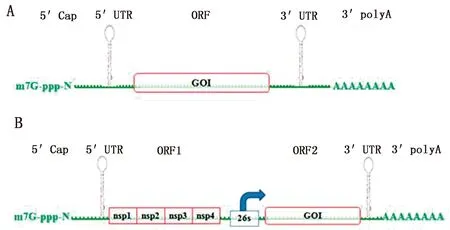
A..常规mRNA疫苗结构;B.自扩增型mRNA疫苗结构
1.1 常规mRNA疫苗其结构与真核细胞mRNA一致,从5′→3′末端依次为5′帽子结构(5′Cap m7Gp3N),5′非编码区(untranslated region,UTR),目的抗原基因(gene of interest,GOI),3′UTR,poly A 尾巴等元件。在GOI处插入目的抗原基因即可完成常规mRNA疫苗构建,这种疫苗相对分子质量较小(2~10 kb),易被RNA酶降解,需要较大的接种剂量才能达到保护效果。体内研究实验表明,BALB/c小鼠肌肉注射编码H1N1流感病毒血凝素蛋白(hemagglutinin,HA)的mRNA疫苗6 h后小鼠体内开始出现HA蛋白,24 h后达到表达峰值并持续6 d。当注射剂量为80 μg时能够诱导小鼠产生足量的中和抗体,保护小鼠免受病毒攻击[10]。使用递呈系统能够提升mRNA的递呈效率并防止疫苗核酸链被RNA酶降解,经递呈系统包裹的常规mRNA疫苗表达效率显著提升,使用5 μg mRNA剂量即可表达较高水平的抗原。采用皮下注射的方式接种,抗原表达可延长至10 d[11]。
1.2 自扩增型mRNA疫苗自扩增型mRNA疫苗即SAM或sa-RNA[12-13],是一种以甲病毒为基础,在细胞内能够自行复制表达的疫苗。除含有5′Cap、5′UTR、3′UTR、poly A 尾等基础元件外,还含有2个开放阅读框(open reading frame,ORF)、26S亚基因启动子原件。ORF1靠近5′UTR,编码甲病毒的4个非结构蛋白(non-structural protein,NSP1- NSP4),辅助mRNA疫苗分子自行复制扩增。NSP1具有鸟嘌呤-7-甲基转移酶(guanine-7-methyltransferase,MTAse)和鸟苷酰基转移酶(guanylyl transferase)活性,能为mRNA添加5′Cap[14],同时还能铆定在细胞膜上与NSP3一起辅助形成复制复合体(replication complex,RC)。NSP2能将ORF1编码的多肽切割成蛋白单体,同时具有5′→3′解螺旋酶活性,辅助RNA复制[15]。NSP4是一种RNA依赖的RNA聚合酶,负责RNA链复制[12]。ORF2中编码目的抗原基因(GOI)[16]。亚基因启动子26S位于ORF1、ORF2之间,其能够启动ORF2核酸链在亚基因水平扩增,扩增出的基因能够直接翻译成蛋白,显著提升抗原表达量[17]。
与常规mRNA疫苗相比,自扩增型mRNA疫苗诱导抗原产量显著提升,抗原持续时间、免疫应答时间大大延长。同样是编码H1N1 HA蛋白mRNA,1.25 μg SAM即可达到与80 μg常规mRNA疫苗相同的效果[10]。当递呈系统包裹SAM后,疫苗使用剂量可降低10倍,即0.1 μg剂量可诱导小鼠产生免疫保护[18]。
2 mRNA疫苗的免疫机理
经注射后,mRNA疫苗能被抗原递呈细胞(antigen presenting cell,APC)捕获,启动先天免疫应答与适应性免疫应答,全面激活体液免疫与细胞免疫(图2)。
2.1 mRNA疫苗诱导先天免疫应答mRNA疫苗核酸链能够被模式型识别受体(如Toll样受体、RIG-I样受体等)识别,启动先天免疫应答。据报道至少有3种Toll样受体(Toll-like receptor,TLR)参与识别外源mRNA分子,分别为TLR3、TLR7、TLR8[19-20]。刚被细胞吞入时,疫苗核酸链能够激活内体(endosome)膜表面的TLR7、TLR8,其中TLR8能够被单链mRNA分子激活,TLR7能够被单链、双链mRNA分子激活[21],在细胞质内TLR3能够识别mRNA疫苗分子。TLR被激活后,能够将信号通过接头蛋白传递给下游信号通路,激活先天免疫应答(图2)。除TLR外,模式型识别受体RIG-I、MD5、PKR、OAS也能够在细胞质内识别mRNA疫苗分子,激活先天免疫应答。
2.2 mRNA疫苗诱导适应性免疫应答mRNA疫苗在APC中表达的抗原蛋白,经溶酶体处理后成为抗原肽,这些肽段被主要组织相容复合体(major histocompatibility complex,MHC)递呈给CD4+、CD8+T细胞或者通过释放被B细胞识别,激活细胞免疫与体液免疫(图2)。先天免疫应答对于激活适应性免疫应答,特别是细胞免疫应答十分关键。亚单位疫苗与灭活疫苗激活细胞免疫能力很弱,主要是因为它们无法被模式型识别受体识别而激活宿主的先天免疫应答[8]。先天免疫应答能够从几个方面促进细胞免疫反应:首先,先天免疫应答诱导促炎性因子产生,能够招募更多的APC、杀伤性细胞招到疫苗注射位点附近,确保mRNA疫苗的递呈效率与覆盖范围;其次促炎性因子的释放也能够诱导APC活化,而活化的APC是确保正确诱导适应性免疫应答的核心环节;最后先天免疫通路激活能够诱导Ⅰ型干扰素(IFN-Ⅰ)产生,IFN-I能够促进APC激活、促进CD8+T细胞群扩增、促进CD8+T细胞毒性,但当IFN-Ⅰ过多产生时,能够抑制抗原蛋白质表达造成CD8+T细胞耗竭[22]。

图2 mRNA疫苗的免疫机理
3 mRNA疫苗的改进措施
在工业生产中,要围绕提高mRNA核酸链稳定性、提高抗原蛋白翻译量、降低副作用3个关键点,以mRNA疫苗免疫机理为理论基础,定向改进mRNA疫苗,提高其经济适用性。
3.1 对mRNA疫苗5′端进行加帽修饰5′Cap是真核细胞mRNA 5′端的修饰,对提高mRNA疫苗翻译效率,增强mRNA疫苗核酸链稳定性有着至关重要的作用。首先5′Cap是真核细胞翻译起始因子4A(eukaryotic translation initiation factor 4A,eIF4A)与mRNA结合位点,当5′Cap与eIF4A结合后能够起始mRNA翻译,因此5′Cap结构对于真核细胞mRNA的翻译效率至关重要[23]。其次,5′Cap还可以防止5′→3′RNA限制性内切酶对mRNA的酶切作用,防止mRNA疫苗降解,提升抗原表达量。因此需要对mRNA疫苗进行5′Cap修饰。
3.2 非编码区改造在真核生物mRNA中,非编码区位于编码区的上游与下游,可以调控mRNA的半衰期与翻译效率[24],所以需要对mRNA疫苗的非编码区进行优化。
3.2.15′UTR的优化 在5′UTR中需要添加一些序列,来提升序列翻译效率。如Kozak序列能够通过与eIF结合启动mRNA翻译,在mRNA疫苗的5′UTR中增加Kozak序列(GCCACCAUGG),能够增强核糖体对翻译起始位点识别的准确性,增强mRNA疫苗翻译效率,提高抗原蛋白的翻译量[25]。除此之外,5′UTR中的二级结构会阻碍核糖体翻译效率,将5′UTR设计成为短、松的结构有利于翻译效率提升[26]。
3.2.23′UTR的优化 3′UTR是microRNA和RNA结合蛋白(RNA-binding proteins, RBP)调控的重点区域,其序列能够影响mRNA的稳定性、定位和翻译效率[27],如:将非编码区替换成人β-球蛋白的5′、3′UTR就显著提高了mRNA稳定性和翻译效率[28-29];3′UTR中的富含AU碱基能够介导mRNA降解[29-30],而将3′UTR中AU碱基改造能够提高mRNA的稳定性。因此对3′UTR进行改造也具有十分重要的意义。
3.3 假尿嘧啶修饰与mRNA疫苗纯化核酸链中的尿嘧啶在激活TLR过程中起着十分重要的作用,而TLR过度激活会诱导IFN-Ⅰ过量产生,抑制抗原蛋白表达并且引起过敏反应。将mRNA疫苗上的尿嘧啶替换为假尿嘧啶能够减少这种过量刺激,使抗原蛋白表达量提高10倍以上,同时减少副作用,提高疫苗免疫活性[31-32]。除此之外,mRNA疫苗转录过程会产生副产物双链mRNA,双链mRNA能够刺激IFN-Ⅰ过量产生,利用液相色谱将其清除后,抗原蛋白表达量显著提升[33]。
3.4 polyA尾巴添加多聚腺苷酸尾(即polyA尾巴)位于真核生物mRNA的3′端,长度为20~300 bp,其长短与mRNA的半衰期、翻译效率有关。首先polyA能够降低RNA核酸外切酶的切割速度,提高mRNA在体内的半衰期,提升抗原表达效率[8]。其次polyA结合蛋白能够与5′Cap通过eIF相连,与5′Cap一起调控mRNA的稳定性与翻译效率。因此需要在mRNA疫苗尾部添加polyA尾巴,提升mRNA稳定性与翻译效率。除此之外添加polyA尾巴的长度也需要十分考究,LINARES-FERNANDEZ等[34]研究表明,120 bp的polyA尾巴能够提高mRNA的稳定性和翻译效率,而在人T细胞中大于300 bp的polyA尾巴能够提高mRNA的翻译效率,因此添加polyA尾巴的具体长度需要视具体情况而定。
3.5 密码子改造各类生物在编码氨基酸方面都有不同的密码子编码偏好性,而mRNA疫苗编码抗原的密码子可能在宿主内很少使用,当将密码子改造成为宿主偏好的密码子后,抗原蛋白产量能够提升[35]。除此之外,mRNA编码区中如果富含GC碱基,容易产生二级结构阻碍抗原翻译,因此减少GC含量及二级结构后能够提升抗原产量[34]。
4 mRNA疫苗应用示例
4.1 新型冠状病毒(SARS-CoV-2)2020年初,SARS-CoV-2开始在世界范围内流行。2020年1月11日我国向全世界分享了SARS-CoV-2全基因组序列,就在这一刻疫苗研发竞赛正式开始。仅2 d后mRNA疫苗巨头Moderna 公司宣布与美国国立卫生研究院开始合作创制SARS-CoV-2 mRNA疫苗。2020年3月11日Moderna 公司mRNA-1273获批临床试验,成为全球首个获批临床试验的SARS-CoV-2疫苗。2020年12月2日英国紧急批准使用辉瑞和BioNTech公司联合研发的mRNA疫苗(BNT162b2),成为首个批准紧急使用mRNA疫苗的国家[36]。随后mRNA-1273也开始被各国授权使用,BNT162b2、mRNA-1273的有效率分别为95.0%和94.1%,效果相当。这是疫苗史中的里程碑的事件,标志着mRNA疫苗正式登上了历史舞台,在抗击疫病过程中发挥作用。值得一提的是,我国军事医学研究院也完成了mRNA疫苗的创制,该疫苗免疫保护性、稳定性均良好,现已进入临床试验阶段[37]。
4.2 流感病毒流感病毒具有持续变异、进化的特性,难以被防控。mRNA疫苗具有的可编译性强、无毒株分离依赖性、免疫活性强等优势,非常适用于应对流感病毒。对甲型流感病毒HA蛋白进行编码,mRNA疫苗注射小鼠后能够充分诱导体液与细胞免疫,为小鼠提供持久有力的保护。而当mRNA疫苗编码较为保守的核衣壳蛋白时,可以对不同的毒株提供交叉保护[38]。据报道,2种分别编码H10N8、H7N9型禽流感病毒HA蛋白的mRNA疫苗,已经完成I期临床试验。结果表明,这2种疫苗的安全性良好,副作用较小。并且2种疫苗在没有使用佐剂的情况下,都能够诱导人体产生强烈的免疫反应,显示出了很高的应用价值[39]。
4.3 人类免疫缺陷病毒(HIV)HIV又称艾滋病病毒,艾滋病是一种严重威胁人类健康的传染病,自1981年首次被发现以来,一直没有有效的治疗手段。现在有几项研究,正将mRNA疫苗应用于艾滋病的预防与治疗之中。2016年,GANDHI等[40]领衔的一项研究是在体外纯化志愿者的树突状细胞,并将编码HIV特异性抗原mRNA疫苗转染、激活树突状细胞,将激活后的树突状细胞输回志愿者体内,观察免疫应答情况。遗憾的是这项研究并没有获得成功,试验组与对照组之间的细胞免疫激活程度没有显著性差异。另外一项研究中,基于mRNA编码一种针对HIV的广谱高效中和抗体的重链,mRNA经LNP递呈系统转导进入小鼠体内后能够翻译产生大量中和抗体,阻断HIV感染[41]。而通过LNP递呈系统,递呈编码HIV表面抗原蛋白ENV、GP120的mRNA疫苗,能够诱导CD4+、CD8+T细胞细胞免疫应答,并产生高效中和抗体[42]。另外,在一项研究中通过阳离子纳米乳剂系统,递呈编码CLADE C 囊膜糖蛋白的自复制型HIV mRNA 疫苗,能够诱导产生较强的细胞免疫并产生较高滴度的中和抗体[43]。
4.4 狂犬病病毒(rabies virus,RV)SCHNEE等[44]将编码RV蛋白的mRNA疫苗免疫小鼠与家猪。结果表明,所有疫苗剂量组均能够诱导小鼠与家猪产生中和抗体,中和抗体在小鼠持续存在长达1年以上并且抗体滴度在观察期内保持稳定。接种疫苗动物体内CD4+、CD8+T细胞均被激活,mRNA疫苗能够诱导小鼠产生比对照商品化疫苗株更高的CD4+T细胞活性。攻毒保护试验表明,mRNA疫苗能够保护实验动物免受强毒株攻击。这种mRNA疫苗能在-80℃至70℃环境下保存数月,不影响疫苗的免疫活性。同时利用4~56℃ 温度不断变换20个循环,来模拟运输途中冷链中断等极端情形,结果为储存条件改变对疫苗的免疫活原性并没有影响[45]。一项狂犬病mRNA疫苗(CV7202)多中心临床I期试验结果表明,接种1,2 μg 2种剂量(各接种2针),都能够诱导受试人员体内产生中和抗体,且安全性合格,诱导的中和抗体水平能够符合WHO标准。5 μg剂量组,因副反应过强而不被采纳[46]。
5 讨论
mRNA疫苗作为一种新型疫苗形式,具有安全性好、免疫原性强、可编译性强、设计速度快、产量大、成本低、易于储存等优点,在新冠疫情防控过程中首次登台便一战成名,被视作一种革命性的疫苗技术。除疫病防控外,mRNA疫苗正在被用于越来越多的医疗领域,如肿瘤的防治、罕见疾病的治疗等。现在,mRNA疫苗技术仍需在特异高效递呈、减少副反应、降低成本、提高疫苗稳定性等方面进行改进。相信不远的将来,mRNA疫苗技术终将会具有更广泛的适用空间,成为人类对抗众多疾病的有力武器,保障人类及动物健康,促进社会和谐健康发展。
