腹腔注射GnIH 对雄性小鼠采食、体重和血糖稳态的影响
2022-07-23罗荣荣徐文镐宋星星左剑雨韩冬洋曹雅洁
罗荣荣,陈 磊,徐文镐,宋星星,张 鑫,左剑雨,2,胡 文,石 艳,韩冬洋,曹雅洁,李 珣
(1. 广西大学动物科学技术学院, 广西 南宁 530004;2. 广西东盟经济技术开发区动物卫生监督所, 广西 南宁530105)
促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)是Tsutsui 等[1]于2000 年首次在鹌鹑下丘脑内分离鉴定到的一种由12 个氨基酸构成的神经肽, 该神经肽能够抑制促性腺激素释放激素的分泌。后续研究表明,在哺乳动物中也存在与GnIH 结构相似的神经肽, 其中,RF 酰胺相关肽-3 (RF amide-related peptide 3,RFRP-3)与GnIH 的生理功能一致,二者均通过G 蛋白耦联受体147(G-protein coupled receptor 147,GPR147)参与动物生殖以及内分泌、 免疫和摄食等生理过程的调控[2-4]。随着对GnIH 研究的不断深入,其在能量代谢方面的调控作用逐渐展现。有研究表明,下丘脑作为神经中枢关键脑区也参与了动物的采食行为和糖代谢调控[5]。 哺乳动物的GnIH 神经元主要分布于下丘脑、室旁核、弓状核和腹内侧核等能量调控区域[6]。 同时,Johnson 等[7]研究发现,对大鼠侧脑室注射GnIH 可导致注射后2 h 内食物的摄取量显著增加。 上述试验结果有力地证明了GnIH 有可能直接作用于中枢神经系统食欲和能量代谢调控区域, 从而参与动物的采食行为和代谢的调控。绵羊和猕猴脑室注射GnIH 增加了食物摄入量,但不影响能量消耗以及动物性行为[8-9]。Clarke 等[10]发现GnIH 会在限饲条件下被激活,此时动物食欲增加,繁殖行为减少,体内GnIH 免疫反应细胞数量也减少。 Huo 等[11]进一步研究发现,大鼠腹腔注射GnIH, 激光共聚焦结果显示:GnIH及其受体GPR147 在胰岛均有分布,GnIH 在胰岛α 细胞和β 细胞上均有表达, 且与胰高血糖素存在共定位。 葡萄糖耐量试验是评估血糖调节能力的重要试验, 胰岛素耐量试验是评价动物胰岛素敏感性的重要试验。 该试验对雄性昆明小鼠腹腔注射GnIH,考查其葡萄糖耐量、胰岛素分泌功能和胰岛素敏感性是否受到影响, 并探究该神经肽对小鼠生长性能及胰岛素转录因子基因(NeuroD1)、胰岛素基因(Ins)、胰高血糖素基因(Gcg)、胰岛素转录调控因子基因 (Pdx1) 表达水平的影响,为丰富动物能量代谢理论提供基础研究数据。
1材料与方法
1.1 试验材料
1.1.1 实验动物
昆明系小白鼠20 只, 雄性,6 周龄, 体重(26.1±0.3)g,购自广西中医药大学动物实验中心。对饲养环境的温度(25±2)℃、湿度(55±5)%和光照(12 L∶12 D,每天7:00 开灯)进行严格控制。
1.1.2 试剂与仪器
Trizol、 反转录酶、DNAMarker、 核苷酸(Oligo dT18)、dNTPs、rTaq DNA 聚 合 酶、Golden View 核酸染料,购自南京诺唯赞生物科技有限公司;1 mL注射器和葡萄糖购自南宁吉运生物科技有限公司;舒泰(Zoletil 50)购自法国维克公司;胰岛素购自诺和诺德公司;血糖试纸、辅理善越佳型至新血糖仪, 购自英国雅培糖尿病护理公司; 罗氏LightCycler96 实时荧光定量PCR 仪为Roche 公司产品。
胰岛素转录因子基因(NeuroD1)、胰岛素基因(Ins)、胰高血糖素基因(Gcg)、胰岛素转录调控因子基因(Pdx1)及β-actin 基因实时荧光定量PCR(qPCR) 分析引物均由深圳华大基因科技有限公司设计及合成。 引物信息见表1。

表1 qPCR 引物信息
1.2 试验方法
1.2.1 试验设计
20 只小鼠适应性饲养1 周后, 随机分为2组,每组10 只,分别为对照组[腹腔注射生理盐水100 μL/(次·只)]和试验组[腹腔注射20 μg/100 μL GnIH,100 μL/(次·只)], 每组10 只, 每天注射2次(8:00 和20:00 各1 次),连续注射21 d。
1.2.2 生长性能指标测定
从试验开始的第1 天对鼠粮及体重进行称量、记录。 每天分别于8:00 和20:00 准时对小鼠的体重及剩余鼠粮进行称重并记录,在此期间小鼠可自由采食及饮水。计算平均日增重和平均日采食量。平均日增重=(试验结束时体重-试验开始时体重)/试验天数,平均日采食量=总采食量/天数[12]。
1.2.3 空腹血糖、葡萄糖耐量及胰岛素耐量的检测
1.2.3.1 空腹血糖检测
空腹血糖检测方法参考已有文献报道[13],试验第8 天22:00 对所有小鼠禁食10 h 处理,试验第9 天8:00 对所有实验小鼠进行麻醉,当其处于稳定状态时, 使用快速血糖仪检测尾静脉血糖浓度,之后立即进行1 次腹腔注射,即对照组注射生理盐水100 μL/只, 试验组注射20 μg/100 μL 的GnIH 100 μL/只,此时记为T=0 min,在T=15、30、45、75、135 min 对血糖进行测定。
1.2.3.2 葡萄糖耐量检测
葡萄糖耐量检测方法参考已有文献报道[13],试验第12 天22:00 对所有小鼠禁食10 h 处理,试验第13 天8:00 对所有实验小鼠进行麻醉,当其处于稳定状态时, 使用快速血糖仪检测尾静脉血糖浓度,接着每只小鼠按照2 g/(kg·BW)的剂量腹腔注射0.5 g/mL 的葡萄糖溶液1 次, 此时记为T=0 min。 在T=15 min 血糖测定结束后,进行1 次腹腔注射, 即对照组注射生理盐水100 μL/只、试验组注射20 μg/100 μL 的GnIH 100 μL/只, 并在T=30、45、75、135 min 时对小鼠的血糖进行测定。
1.2.3.3 胰岛素耐量检测
胰岛素耐量检测方法参考已有文献报道[13],试验第16 天22:00 对所有小鼠禁食10 h 处理,试验第17 天8:00 对所有实验小鼠进行麻醉,当其处于稳定状态时, 使用快速血糖仪检测尾静脉血糖浓度,此时记为T=0 min;接着每只小鼠按照2.7 U/(kg·BW) 的剂量腹腔注射0.5 U/mL 的胰岛素1 次。 在T=15 min 血糖测定结束后,进行1 次腹腔注射, 即对照组注射生理盐水100 μL/只、试验组注射20 μg/100 μL 的GnIH 100 μL/只, 并在T=30、45、75、135 min 时对小鼠的血糖进行测定。
血糖曲线下面积计算方法参考已有文献报道[14]:血糖曲线下面积(min·mg/dL)=15 min×[1/2×(BG0+BG135)+1×(BG15+BG30+BG45+BG75+BG135)],使用梯形规则法。
1.2.4 实时荧光定量PCR 检测胰腺中Gcg、Ins、Pdx1、NeuroD1 基因mRNA 表达水平
试验结束后解剖小鼠,分离胰腺,经液氮速冻处理后转至-80 ℃冰箱保存,按照Trizol 试剂的说明书在无RNA 酶的环境下提取总RNA, 按照试剂盒说明书进行反转录并获得cDNA。实时荧光定量PCR 反应体系20 μL:rTaq DNA 聚合酶10 μL,上、下游引物各0.4 μL,模板1 μL,ddH2O 8.2 μL;反应程序:95 ℃酶激活2 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40 个循环。
1.2.5 数据分析
使用Graphad prism 6.0 和Adobe illustrator 2019 软件作图。对数据进行正态性检验后符合正态分布, 使用SPSS 23.0 统计学软件进行独立样本t 检验。 数据表示形式为 “平均值±标准误(Mean±SEM)”。
2 结果与分析
2.1 腹腔注射GnIH 对小鼠平均日增重、平均日采食量的影响
由表2 可知,与对照组相比,腹腔注射GnIH可使小鼠平均日增重极显著(P<0.01)升高;腹腔注射GnIH 可使小鼠平均日采食量极显著 (P<0.01)升高。

表2 腹腔注射GnIH 对小鼠生长性能的影响 单位:g
2.2 腹腔注射GnIH 对小鼠空腹血糖的影响
空腹血糖测定结果如图1 所示, 小鼠禁食10 h 腹腔注射GnIH 能够促进小鼠血糖的升高,与对照组相比,腹腔注射GnIH 在T=15 min 时血糖升高并达到最高值(P<0.001);随后在T=30~135 min时段血糖逐渐下降, 但试验组的血糖仍然显著高于对照组。 此外,如图2 所示,在禁食10 h 后腹腔注射GnIH 能够极显著(P<0.01)增加小鼠空腹血糖曲线下面积。
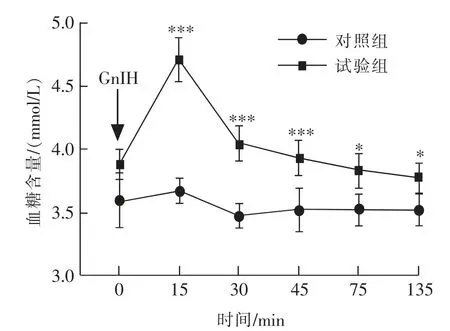
图1 慢性腹腔注射GnIH 对雄性小鼠空腹血糖的影响
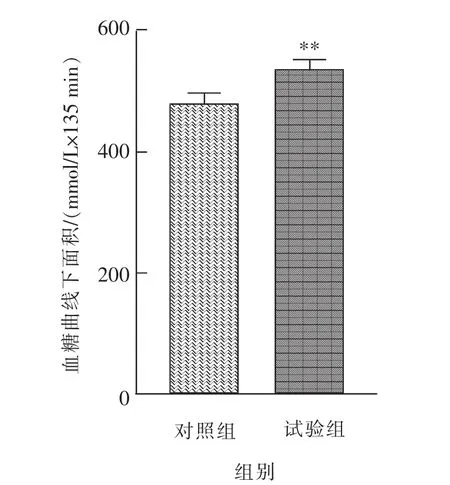
图2 慢性腹腔注射GnIH 后雄性小鼠空腹血糖曲线下面积
2.3 腹腔注射GnIH 对小鼠葡萄糖耐量的影响
葡萄糖耐量试验是评价动物血糖代谢功能的重要试验,结果如图3 所示。 与对照组相比,腹腔注射GnIH 后的第15 分钟时(T=30 min)血糖显著(P<0.05)升高;此外,如图4 所示雄性小鼠葡萄糖耐量的血糖曲线下面积极显著(P<0.01)增加。
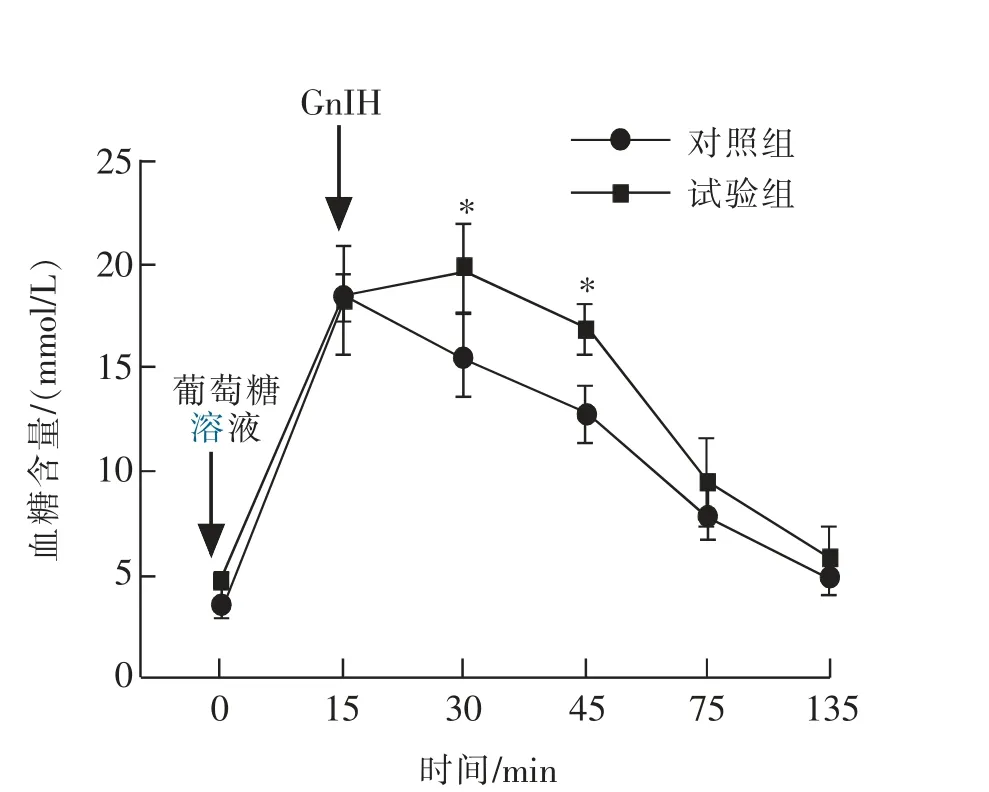
图3 慢性腹腔注射GnIH 对雄性小鼠葡萄糖耐量的影响
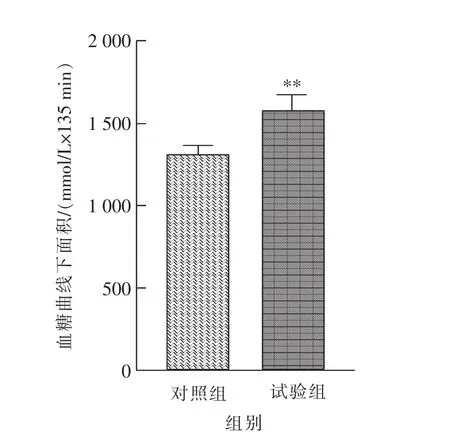
图4 慢性腹腔注射GnIH 后雄性小鼠葡萄糖耐量的血糖曲线下面积
2.4 腹腔注射GnIH 对小鼠胰岛素耐量的影响
胰岛素耐量试验是评价动物胰岛素敏感性的重要试验,结果如图5 所示。 与对照组血糖相比,腹腔注射GnIH 能够减缓小鼠血糖的降低, 并在T=30 min 时有显著差异(P<0.05);此外,如图6 所示雄性小鼠胰岛素耐量的血糖曲线下面积极显著(P<0.01)增加。
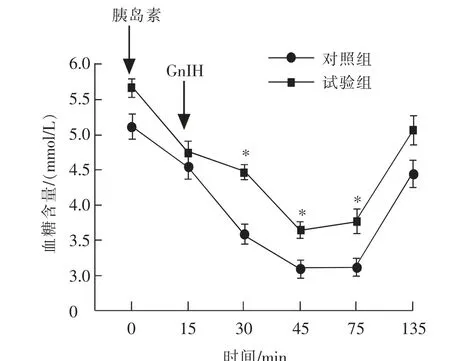
图5 慢性腹腔注射GnIH 对小鼠胰岛素耐量的影响

图6 慢性腹腔注射GnIH 后雄性小鼠胰岛素耐量的血糖曲线下面积
2.5 腹腔注射GnIH 对小鼠胰腺Gcg 基因mRNA 相对表达量的影响
结果如图7 所示,慢性腹腔注射GnIH 后雄性小鼠胰腺Gcg 基因mRNA 的相对表达量显著(P<0.05)高于对照组。

图7 慢性腹腔注射GnIH 对雄性小鼠胰腺Gcg 基因mRNA 相对表达量的影响
2.6 腹腔注射GnIH 对小鼠胰腺Ins 基因mR-NA 相对表达量的影响
结果如图8 所示,慢性腹腔注射GnIH 后雄性小鼠胰腺Ins 基因mRNA 的相对表达量显著 (P<0.05)低于对照组。

图8 慢性腹腔注射GnIH 对雄性小鼠胰腺Ins 基因mRNA 相对表达量的影响
2.7 腹腔注射GnIH 对小鼠胰腺pdx1 基因mRNA 相对表达量的影响
结果如图9 所示,慢性腹腔注射GnIH 后雄性小鼠胰腺Pdx1 基因mRNA 的相对表达量显著(P<0.05)低于对照组。
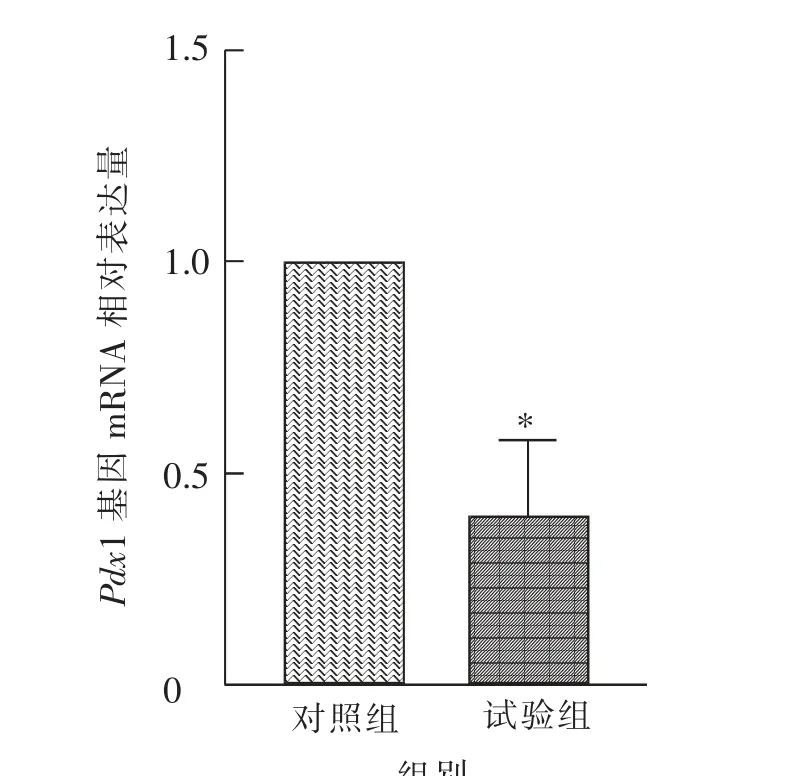
图9 慢性腹腔注射GnIH 对雄性小鼠胰腺Pdx1 基因mRNA 相对表达量的影响
2.8 腹腔注射GnIH 对小鼠胰腺NeurD1 基因mRNA 相对表达量的影响
由图10 可知, 慢性腹腔注射GnIH 后雄性小鼠胰腺NeuroD1 基因mRNA 的相对表达量显著(P<0.05)低于对照组。
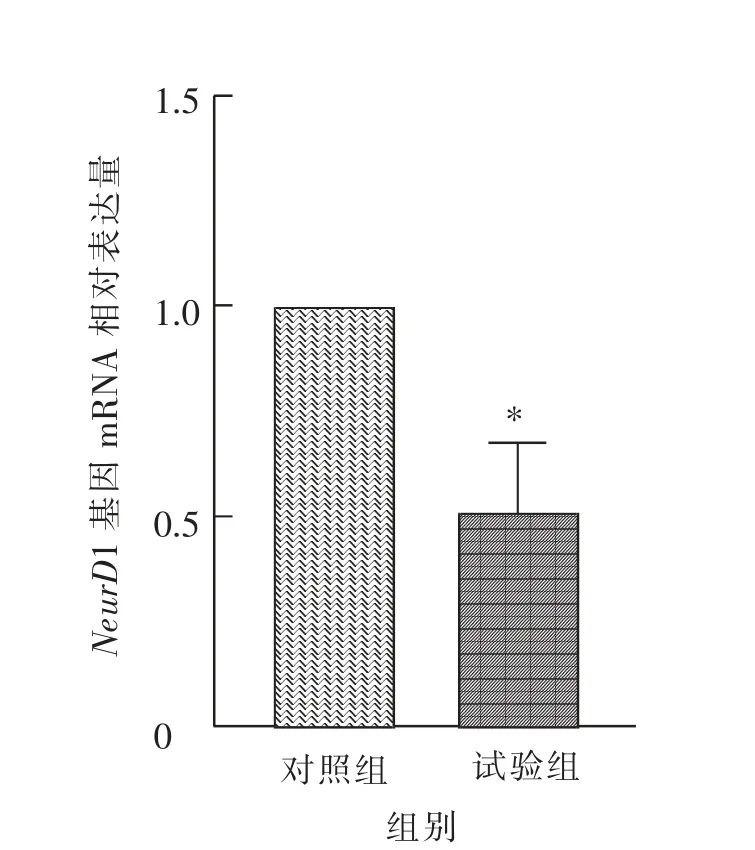
图10 慢性腹腔注射GnIH 对雄性小鼠胰腺NeurD1 基因mRNA 相对表达量的影响
3 讨论
自发现GnIH 以来,关于GnIH 的研究主要集中在生殖调控方面。 随着研究的不断深入,GnIH已经被证明是能够影响采食并可能参与能量代谢的神经内分泌因子[15]。 该试验通过对昆明小鼠进行慢性腹腔注射GnIH,探究该神经肽对动物生长性能及能量代谢的影响, 以期为在畜禽养殖业中提高生产性能提供新思路和基础理论依据。
Tsutsui 及其同事研究了GnIH 是否将代谢信息传递到HPG 轴并调节神经馈送回路[4]。 在鸟类中,侧脑室注射抗GnIH 抗血清可抑制禁食诱导的食欲,支持GnIH 在进食中的刺激作用。Fraley 等[16]还报道了GnIH 的侧脑室注射降低了成年北京鸭的血浆LH 黄体生成素(luteinizing hormone,LH)浓度并增加了摄食量。 此外,Tachibana 等[17]研究了向雏鸡侧脑室内注射GnIH 会刺激食物摄入,揭示了GnIH 在雏鸡中诱导的中枢促食欲机制。在哺乳动物中,GnIH 的侧脑室给药也增加了大鼠[7]和绵羊[10]的食物摄入量。以上研究与该试验结果一致。
该研究结果表明小鼠腹腔注射GnIH 具有快速升血糖的作用。 当机体血糖升高时会刺激胰岛β 细胞中胰岛素分泌增加, 而胰岛素可促进体细胞对血糖的吸收和利用, 并促进糖原合成和抑制糖异生,进而发挥其维持血糖平衡的生理功能[18]。此外, 慢性腹腔注射GnIH 小鼠在注射葡萄糖后,其血糖与对照组相比显著升高,GnIH 可能降低了机体对胰岛素的敏感性,导致葡萄糖清除率显著下降。 胰岛素抵抗的特征是机体对胰岛素的不敏感以及对血液中葡萄糖的摄取能力下降, 当机体处于胰岛素抵抗状态时会引起血糖浓度的升高。 该研究表明慢性腹腔注射GnIH 会引起小鼠血糖代谢的紊乱。 胰岛素是目前发现的唯一能够直接降低机体血糖的激素,在靶器官的代谢影响了整个机体的血糖平衡, 而胰岛素抵抗(insulin resistance,IR)即机体细胞对胰岛素的反应表现为不敏感,这将直接影响体内血糖的吸收和糖原的分解[19]。 因此, 胰岛素抵抗被认为是引起能量代谢紊乱发展过程中的一个重要因素。
研究表明,GnIH 在动物的中枢及外周组织器官均有不同程度的表达和分布[20-21]。 而在该研究中,对慢性腹腔注射GnIH 小鼠胰腺中的Gcg、Ins、Pdx1、NeuroD1 基因mRNA 相对表达量进行了检测,结果表明,与对照组相比慢性腹腔注射GnIH小鼠胰腺Gcg 基因mRNA 的相对表达量显著(P<0.05)升高,Ins、Pdx1、NeuroD1 基因mRNA 的相对表达量显著(P<0.05)降低。2 种β 细胞特异性转录调节因子Pdx1 和NeuroD1 已被证明在葡萄糖诱导的胰岛素基因转录和胰腺β 细胞功能中起关键作用[22-23]。 在2 型糖尿病中,由于不能再分泌足够的胰岛素维持正常的血糖水平, 胰岛素分泌率总体上有所下降[24]。 这与该试验结果一致。
综上所述,猜测腹腔注射GnIH 可能降低了机体对胰岛素的敏感性, 导致葡萄糖清除率显著下降。这一生理功能的改变推测是由于GnIH 在引起胰岛素分泌下降的同时诱导了胰岛素抵抗的发生所致。
4 结论
该研究探讨了腹腔注射GnIH 对小鼠采食、体重和血糖稳态的影响,结果显示腹腔注射GnIH 具有促进雄性小鼠采食量和体重增加进而提高其生长性能的作用。腹腔注射GnIH 具有快速升血糖的作用,促进胰高血糖素的分泌和合成,抑制胰岛素转录调控因子、 胰岛素转录因子和胰岛素的分泌和合成,进而引起机体血糖紊乱。
