耐盐碱溶磷菌的筛选鉴定及其在大豆生长中的功能验证
2022-07-23张美珍王丽娜黄玉兰张玉先殷奎德
张美珍,王丽娜,刘 权,黄玉兰,张玉先,殷奎德
(1. 黑龙江八一农垦大学 农学院,黑龙江 大庆 163319;2. 黑龙江省农业科学院 大庆分院,黑龙江 大庆 163316;3. 黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319)
土壤盐碱化是一个威胁生态环境的世界性难题,据调查统计,全球近3%的土壤资源受到了盐分的影响[1]。我国盐渍土面积约3 460 万hm2,盐碱化耕地面积为760万hm2,占耕地总面积的1/5[2]。有效开发利用盐碱土壤可以增加耕地面积,维持农业可持续发展。盐碱土壤往往表现磷素缺乏,磷元素是仅次于氮的第二大限制作物生长的元素,其在作物生长发育过程中以及提高作物抗性方面发挥着重要作用[3-6]。磷元素缺乏会抑制作物细胞的形成,导致植株矮小、根系不发达、生长迟缓,最终影响作物产量。盐碱土中以Na+、Cl-为主,土壤孔隙度减小,更容易板结,磷循环也受到了限制,导致土壤养分利用率降低,从而抑制作物的正常生长发育。此外,土壤的高pH 值和高盐度会影响土壤微生物群落结构和功能,降低土壤微生物碱性磷酸酶等多种酶活性,严重抑制土壤中磷的有效性[7]。土壤中的磷元素分为有机磷和无机磷,其中有机磷含量占全磷的29%~90%[8],但由于土壤的固定作用,有效磷含量很低,仅占全磷的0.1%[9],使作物的生长发育受到了限制。农业上常采用施用磷肥的方式解决缺磷问题,但是施入的磷肥大部分会形成难溶性的磷酸盐积累在土壤中,从而降低磷肥的利用率[10],因此,提高磷素利用率可以降低化肥的施用量。
溶磷菌可以将难溶性磷转化为可溶性磷供作物生长利用,在磷循环中起着重要作用。土壤中磷素的移动大部分呈有机磷形态,进入植物根际的有机磷仅有一小部分可以被植物直接吸收,其余的都要经过矿化变成无机磷才可以被吸收[11]。土壤中的有机磷需要溶磷菌分泌磷酸酶、植酸酶等进行分解,phoD基因是细菌编码碱性磷酸酶的3 个同源基因(phoA、phoD、phoX)之一[12],并且最为关键。栗丽等[13]在土壤中加入溶磷菌,其可以分泌磷酸酶,使土壤磷酸酶活性显著增加,进而促进植物对磷素的吸收。植酸(即肌醇六磷酸)是植物的磷酸储存库,植酸酶可以降解土壤中的植酸盐释放出磷素,其是由appA或phyA基因编码的一种重要的有机磷矿化酶,负责土壤中有机磷的释放[14]。有研究表明,植酸酶可以促进植酸的水解释放磷素,进而促进植物生长[15]。分离得到高效、耐盐碱的溶磷促生菌对于盐碱土壤的开发利用意义重大,以往研究得到的耐盐碱溶磷菌多为溶解无机磷菌株。如刘萍等[16]筛选出的耐盐碱高效溶磷菌属于泛菌属,其溶无机磷量为300 mg/L;杨海霞等[17]筛选出的耐盐碱溶磷菌为盐单胞菌属,其溶无机磷量为247.6 mg/L;ZHU 等[18]分离到1 株中度嗜盐细菌,该菌溶无机磷量为283.16 μg/mL,溶有机磷量仅为45.52 μg/mL。
目前关于耐盐碱溶磷菌的报道大多是溶解无机磷能力强的菌株,而耐盐碱溶解有机磷量高的菌株较少。鉴于此,从生长于盐碱土的苜蓿根际土中分离、筛选具有溶磷功能的耐盐碱菌株,选择溶有机磷量较高的菌株,在缺磷条件下通过盆栽试验验证所选菌株的溶磷效应及对大豆的促生效果,为在轻度盐碱土壤上种植大豆、降低化肥使用量提供依据。
1 材料和方法
1.1 供试材料
1.1.1 土壤样品采集
1.1.1.1 分离耐盐碱溶磷菌的土壤采集 苜蓿根际、非根际盐碱土样品采集于黑龙江省大庆市高新区的盐碱地(46°36′23″N,125°10′44″E)。选取长势旺盛的苜蓿,将距其根系5~10 cm 的土壤作为非根际土;非根际土壤收集好后,挖取苜蓿,采用抖落法采集根际土壤。将根际土壤与非根际土壤样品分别混合均匀,装入无菌袋中冷藏带回实验室,取部分根际、非根际土样用于Biolog-Eco板分析,另取部分根际土用于耐盐碱溶磷菌的分离,剩余土壤风干后用于土壤理化性质分析。根际和非根际土壤理化性质如表1所示。
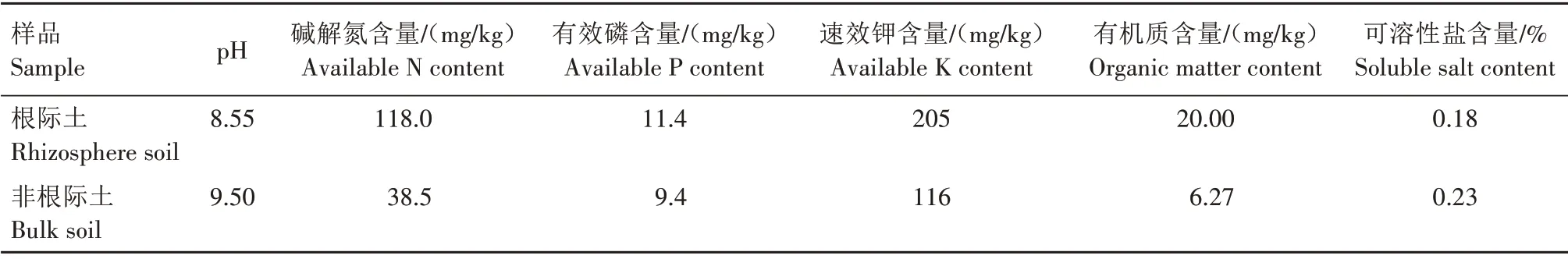
表1 苜蓿根际和非根际土壤理化性质Tab.1 Physical and chemical properties of rhizosphere and bulk soil of alfalfa
1.1.1.2 盆栽试验的土壤采集 种植土壤采集于黑龙江省大庆市龙凤区植被生长较好的盐碱地草原,选择碱草生长较好的草地,采用五点取样法挖取植被下20 cm 土壤,去除根系,混匀,带回实验室,土壤过筛备用,其理化性质如表2 所示。将土壤与沙子等体积混合后有效磷含量为6.6 mg/kg,制成缺磷土壤用于大豆盆栽试验。

表2 盆栽试验土壤理化性质Tab.2 Physical and chemical properties of soil in pot experiment
1.1.2 培养基 菌株筛选采用蒙金娜有机磷培养基[19]和PKO 无机磷培养基[20];菌种保存采用LB 培养基[21];其他促生功能的鉴定采用阿须贝无氮培养基[22]、解钾培养基[23]、DF 培养基、ADF 培养基[24]、CAS铁载体检测培养基[25]、金氏培养基[26]。
1.1.3 供试大豆品种 供试大豆品种为绥农28。
1.2 方法
1.2.1 根际与非根际土壤微生物对碳源的利用测定 分别称取苜蓿根际、非根际土样5 g 置于无菌三角瓶中,加入50 mL 无菌水,175 r/min 振荡摇匀10 min。将装有土壤稀释液的三角瓶平缓地放进超净工作台中,稀释103倍后,按每个孔115 μL 加入Biolog-Eco 板中,30 ℃培养,每隔12 h 测定一次590 nm 和750 nm 处的吸光值,连续测定10 d(共计240 h)。
1.2.2 菌株的分离纯化及其溶磷能力测定 称取苜蓿根际土10 g 置于装有50 mL 无菌水的三角瓶中,170 r/min 振荡10 min,以此为原液,吸取上清液稀释到10-3、10-4、10-5后分别涂布于蒙金娜有机磷培养基和PKO无机磷培养基上,于28 ℃倒置培养7 d,3 次重复。挑取带有溶磷圈的单菌落划线培养,传代至少3次,直至获得纯菌种,用30%的甘油保存菌种,于-80 ℃冰柜中备用。
在有机磷培养基和无机磷培养基上接种20 μL菌悬液,28 ℃条件下培养7 d,观察菌株有无透明圈出现,并对菌落直径(d)和溶磷圈直径(D)进行测量,根据比值(D/d)对菌株溶磷能力大小进行初步判断[27]。将菌悬液浓度调节到107cfu/mL,按1%接种量接种到有机磷液体培养基和无机磷液体培养基中,于28 ℃、170 r/min 条件下振荡培养7 d,分别采用钼蓝比色法[28]和钼锑抗比色法[29]测定上清液中的有机磷含量和无机磷含量。
1.2.3 菌株其他促生功能鉴定 将分离得到的菌株制成菌悬液后,取20 μL 菌悬液分别接种于阿须贝固体培养基、解钾固体培养基、ADF 固体培养基、CAS 铁载体检测固体培养基上,28 ℃条件下培养7 d,观察菌株的生长情况,能够在阿须贝固体培养基、ADF 固体培养基上生长即视为具有固氮功能、产ACC 脱氨酶的功能,根据菌落生长直径的大小判断其固氮、产ACC 脱氨酶功能的大小,并将具有产ACC脱氨酶功能的菌株按照赵龙飞等[30]的方法进行定量测定;能在解钾培养基上产生透明圈的菌株即视为具有解钾功能;能够在菌落周围产生橘黄色晕圈即视为具有产铁载体的功能。
将分离得到的菌株制成菌悬液后,分别取50 μL 接种于5 mL 金氏培养基中,28 ℃避光培养3 d 后,取发酵液于1 000 r/min 离心5 min,吸取上清与PC 比色液(IAA 显色液)各100 μL 滴在白瓷板上混匀,对照采用10 μg/mL IAA 溶液与PC 比色液混匀,避光反应15 min 观察颜色变化,颜色变成粉红色表明菌株具有分泌IAA 的能力,溶液颜色深浅与IAA 分泌能力呈正比;不变色说明菌株不具有分泌IAA的能力。
1.2.4 菌株形态学、生理生化鉴定和16S rRNA基因序列分析 将筛选得到的溶磷菌接种到蒙金娜有机磷固体培养基上,37 ℃培养24 h 后,参照GEORGE 等[31]的方法对菌株进行形态学鉴定;菌株的生理生化试验参照《伯杰细菌鉴定手册》[32]和《常见细菌系统鉴定手册》[33]进行,主要包括接触酶试验、唯一碳源试验、唯一氮源试验、甲基红试验、V-P试验、产氨试验、淀粉水解试验、硝酸盐还原试验、吲哚试验、石蕊牛奶试验、脓青素试验。
用细菌基因组DNA 提取试剂盒对菌株总DNA进行提取,随后使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′ )和 1492R(5′-GGTTACCTTGTTACGACTT-3′)对其16S rRNA 基因进行扩增。PCR 反应体系:DNA 2 μL,2×EsTaq Master Mix 25 μL,上、下 游 引 物(10 μmol/L)各1 μL,用ddH2O 补至50 μL。PCR 反应条件:95 ℃5 min;94 ℃1 min,55 ℃30 s,72 ℃2 min,35 个循环;72 ℃10 min。PCR 产物用1%琼脂糖凝胶电泳检测后,利用PCR 产物纯化试剂盒进行纯化,将纯化后PCR 产物送至吉林省库美生物科技有限公司进行测序。将测序结果在NCBI 上进行BLAST 分析后,利用MEGA-X 对序列进行Clustal W 比对,采用邻接法构建系统发育进化树,Test of Pylogery 设置为Bootstrap method 检验倍数1 000,模型设置为Maximum Composite Likelihood,Gap/Missing Data Treatments设置为Pairwise deletion。
1.2.5 菌株溶磷基因鉴定 分别以各个菌株的基因组为模板,进行PCR 扩增。PCR 反应体系:2×EsTaq Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA 1 μL,ddH2O 9.5 μL。反应条件:95 ℃5 min;94 ℃30 s,58 ℃30 s,72 ℃2 min,35 个循环;72 ℃10 min。PCR 扩增后,进行1%琼脂糖凝胶电泳。引物来自文献[34-35],如表3所示。
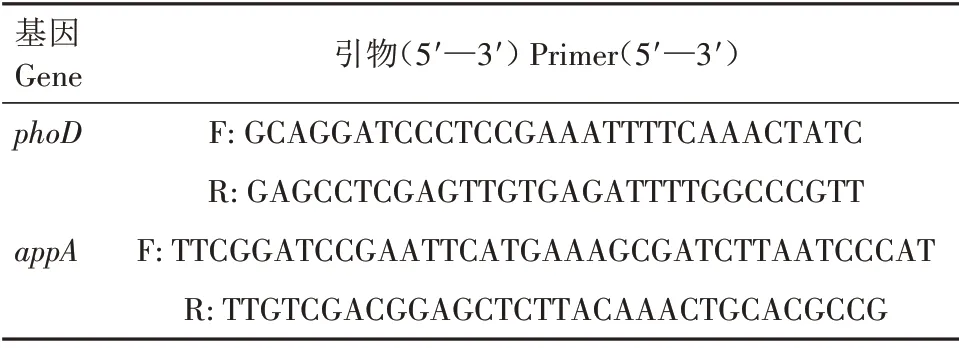
表3 基因引物序列Tab.3 Gene primer sequences
1.2.6 菌株耐盐碱试验 耐碱试验:首先将菌悬液接种在LB 液体培养基中摇种子液,使菌液的OD600达到0.65 后,按1%的接种量接种到不同pH 值(8、9、10、11)的LB 液体培养基中,于28 ℃、170 r/min 振荡培养,每隔24 h测定1次OD600值,测7 d。
耐盐碱试验:将菌悬液接种在LB 液体培养基中摇种子液,使菌液OD600达到0.65 后,根据耐碱试验中OD600选定菌株生长较好的最高pH 值,按1%的接种量接种到不同NaCl 含量(1%、3%、5%、7%、9%、11%、13%)的LB 液体培养基中,于28 ℃、170 r/min 振荡培养,每隔24 h 测定1 次OD600值,测7 d。
1.2.7 溶磷菌溶磷功能验证 大豆盆栽试验所用轻度盐碱土壤采集于大庆市龙凤区植被生长较好的盐碱地草原。将取回的盐碱土过筛,沙子用水清洗3 遍后烘干,将盐碱土与沙子等体积混匀后装入盆中,每盆沙土的质量为7.2 kg。盆栽试验于2021年8月在黑龙江八一农垦大学盆栽场进行。
盆栽试验共设置5个处理,包括2个对照和3个溶磷菌处理,3 次重复。对照1(CK1)浇灌缺磷营养液、对照2(CK2)浇灌全磷营养液、处理Z1为浇灌缺磷营养液并施入菌株Y7(缺磷营养液+Y7)、处理Z2为浇灌缺磷营养液并施入菌株Y31(缺磷营养液+Y31)、处理Z3 为浇灌缺磷营养液并施入菌株W5(缺磷营养液+W5)。每盆播种30 株大豆,出苗后,先施入1/4 霍格兰营养液250 mL(缺磷营养液中用氯化钾替代磷酸二氢钾)和107cfu/mL 的菌液500 mL(菌株用LB 培养基培养48 h 后收集菌体,用无菌水调节浓度),置于室外培养;出苗10 d 后再补浇1 次250 mL 营养液和500 mL 菌液。日常管理中处理与对照浇灌相同的水量,大豆生长40 d 后测定大豆生长指标和叶片SPAD值。
1.3 数据分析
使用Microsoft Excel 2019 和SPSS 21.0 软件进行数据分析。
2 结果与分析
2.1 根际与非根际土壤微生物对碳源的利用情况
选择在盐碱土壤中生长较好的苜蓿,取其根际土和非根际土作为试验材料,采用Biolog-Eco 板分析根际与非根际土壤微生物群落对不同碳源底物的利用情况。Biolog-Eco 板中有31 种不同的碳源底物,光值平均变化率(AWCD)代表土壤细菌的代谢强度,通过酶标仪对0~240 h AWCD 值进行测定。结果(图1)表明,根际土与非根际土的微生物群落对底物的利用率存在明显差异。2 种土在0~24 h

图1 土壤细菌平均吸光值变化曲线Fig.1 Variation curve of average absorbance value of soil bacteria
AWCD 值增加均较为缓慢,24~96 h 迅速增加,之后呈现缓慢增加。这表明微生物适应环境后对不同碳源底物的利用能力越来越强,最后趋于稳定状态。从代谢整体趋势看,根际土的AWCD 值明显高于非根际土,说明根际土的微生物群落比非根际土更加丰富且两者之间的代谢功能也存在明显差异。由于根际土微生物群落丰富,代谢功能强,更容易筛选出耐盐碱溶磷菌,因此选用根际土来分离溶磷菌株。
2.2 耐盐碱溶磷菌的筛选及其溶磷量
以在盐碱土上生长良好的苜蓿的根际土为材料,在蒙金娜有机磷培养基和PKO 无机磷培养基上筛选溶磷菌株,通过平板筛选,挑取有溶磷圈的菌株,最终获得98个不同形态且具有溶磷功能的细菌菌株,其中溶有机磷菌株54 个,编号为Y01—Y54;溶无机磷菌株44个,编号为W01—W44。
通过平板反复筛选,确定菌株具有溶磷功能后,对菌株进行溶磷能力的定量测定,挑选出3个溶磷能力较高的菌株(Y7、Y31、W5)作为后续试验用菌株,3个菌株的溶磷量见表4。

表4 筛选菌株的溶磷量Tab.4 The capacity of phosphorus solubilized by the screened strains mg/L
2.3 耐盐碱溶磷菌的促生功能
对筛选得到的3个溶磷菌株进行固氮、解钾、铁载体功能定性检测和产IAA、产ACC 脱氨酶的定量检测,结果如表5 所示。Y7 菌株具有固氮和产ACC脱氨酶的功能,Y31 菌株具有固氮、解钾、产IAA 的功能,W5菌株具有固氮、产IAA和铁载体的功能。

表5 3个溶磷菌株的促生功能Tab.5 Growth-promoting functions of the three phosphorus-soluble strains
2.4 耐盐碱溶磷菌的鉴定
2.4.1 形态学鉴定 将这3个溶磷菌株接种到蒙金娜有机磷固体培养基上进行形态学观察,如表6 所示,Y7、Y31 菌落均为乳白色,W5 菌落为淡黄色,3个菌株的菌落均为圆形,边缘光滑,表面湿润,有凸起,生长速度较快。

表6 3个溶磷菌株菌落的表型特征Tab.6 Colony morphologies of the three phosphorus-soluble strains
2.4.2 生理生化鉴定 对这3个溶磷菌株进行生理生化鉴定,结果见表7。3 个溶磷菌株在唯一碳源(葡萄糖、蔗糖)、唯一氮源(硝酸钾、硫酸铵)条件下均能生长;产氨试验均为阳性;除W5 外,Y7、Y31 接触酶试验、吲哚试验均为阳性,V-P 试验均为阴性;3 个溶磷菌株脓青素试验均为阴性;除Y31 外,W5、Y7 淀粉水解试验、硝酸盐还原试验均呈阳性,甲基红试验均为阴性;石蕊牛奶试验显示Y7 产碱,W5、Y31均产酸。

表7 3个溶磷菌株的生理生化特性Tab.7 Physiological and biochemical characteristics of the three phosphorus-soluble strains
2.4.3 分子生物学鉴定 将这3个溶磷菌株测序得到的16S rRNA 基因序列在NCBI 上进行BLAST 分析,利用邻接法通过MEGA-X 构建系统发育树,结果如图2。综合菌株的形态学鉴定、生理生化鉴定和菌株与模式菌株的相似性(表8)判断菌株最终的种属分类情况,Y7 为假单胞菌(Pseudomonassp.),同源性为99.79%;Y31 为不动杆菌(Acinetobacter soli),同源性为100%;W5 为暹罗芽孢杆菌(Bacillus siamensis),同源性为100%。

表8 3个溶磷菌株16S rRNA 基因相似性比对结果Tab.8 Results of 16S rRNA gene similarity comparison of the three phosphorus-soluble strains

图2 3个溶磷菌株基于16S rRNA基因序列的系统发育树Fig.2 Phylogenetic tree of the three strains based on 16S rRNA gene sequences
2.5 耐盐碱溶磷菌的溶磷基因
根据文献[34-35]设计了碱性磷酸酶和植酸酶基因的PCR 引物,提取Y7、W5、Y31 三个菌株的DNA 进行PCR 扩增,PCR 产物进行1%琼脂糖凝胶电 泳,结果如图3 所示。Y7 和W5 在约1 500 bp 处有条带,证明有phoD基因;而Y31 在约1 300 bp 处有条带,证明Y31有appA基因。

图3 3个溶磷菌株phoD基因与appA基因PCR扩增结果Fig.3 Results of PCR amplification of phoD gene and appA gene of the three phosphorus-soluble strains
2.6 耐盐碱溶磷菌的耐盐碱能力
将3 个溶磷菌株分别接种到不同pH 值的LB 培养基中进行振荡培养,每隔24 h 进行1 次OD600值的测定,测定7 d;选择菌株最适pH值(pH值=9),将菌株接种到不同含盐量的LB 培养基中,同样每24 h测定1次OD600值,测定7 d。试验过程中发现,前3 d菌株的吸光值均呈现上升趋势,第4 天或第5 天后,吸光值趋于稳定,选取最高OD600值作为菌株耐盐碱性指标,结果如表9 所示。3 个菌株均能在pH 值为8、9、10 的LB 培养基中生长,pH 值为11 时不能生长;Y7、Y31 在pH 值为8 和9 时生长旺盛而W5 在pH 值为9 时生长最旺盛。3 个菌株均能在1%、3%、5%、7%、9% NaCl 中生长,W5 在NaCl 含量为11%、13%时均能够生长,而另外2个菌株不能生长。
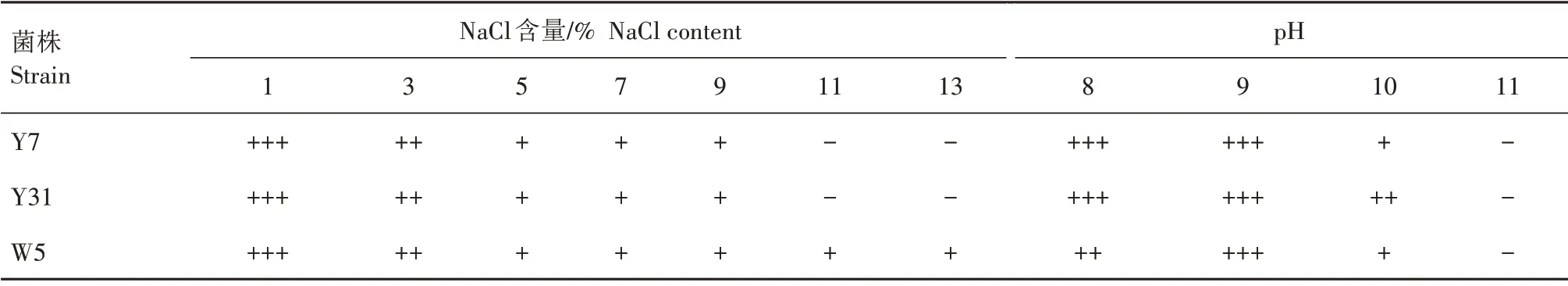
表9 3个溶磷菌株的耐盐碱测定结果Tab.9 Results of saline-alkali tolerance of the three phosphorus-soluble strains
2.7 耐盐碱溶磷菌在大豆生长中的溶磷功能验证
将轻度盐碱土与沙子等体积混合后,制成缺磷土壤(有效磷含量6.6 mg/kg)用于大豆盆栽试验。通过接种不同菌株和浇灌缺磷营养液对盆栽土进行处理,40 d 后测定大豆植株的生长指标,结果如表10 所示。盆栽试验结果显示,与2 个对照相比,浇灌Y7、Y31、W5 菌液的大豆幼苗叶绿素含量、株高、根长、叶鲜质量、叶干质量、根鲜质量、根干质量均呈现不同程度的增加。与CK1相比,Z1、Z2、Z3处理叶绿素含量分别增加了23.03%、25.85%、24.24%,株高分别增加了48.64%、53.60%、42.01%,根长分别增加了83.93%、68.51%、46.92%,叶鲜质量分别增加了73.42%、72.15%、74.68%,叶干质量均增加了62.50%,根鲜质量增加最为明显,分别增加了233.33%、209.52%、147.62%,根干质量分别增加了250.00%、250.00%、200.00%;与CK2 相比,Z1、Z2、Z3 处理叶绿素含量分别增加了6.39%、8.83%、7.44%,株高分别增加了32.46%、36.88%、26.56%,根长分别增加了27.02%、16.37%、1.46%,叶鲜质量分别增加了30.48%、29.52%、31.43%,叶干质量均增加了18.18%,根鲜质量分别增加了125.81%、109.68%、67.74%,根干质量分别增加了250.00%、250.00%、200.00%。根据差异显著性分析,Z1 处理对大豆根部的促生效果最为明显,大豆根系更为发达;Z2 处理对大豆地上部分的促生效果较为明显。3个溶磷菌株对缺磷介质培养的大豆均表现出促生作用,说明3个菌株均有很好的溶磷作用。
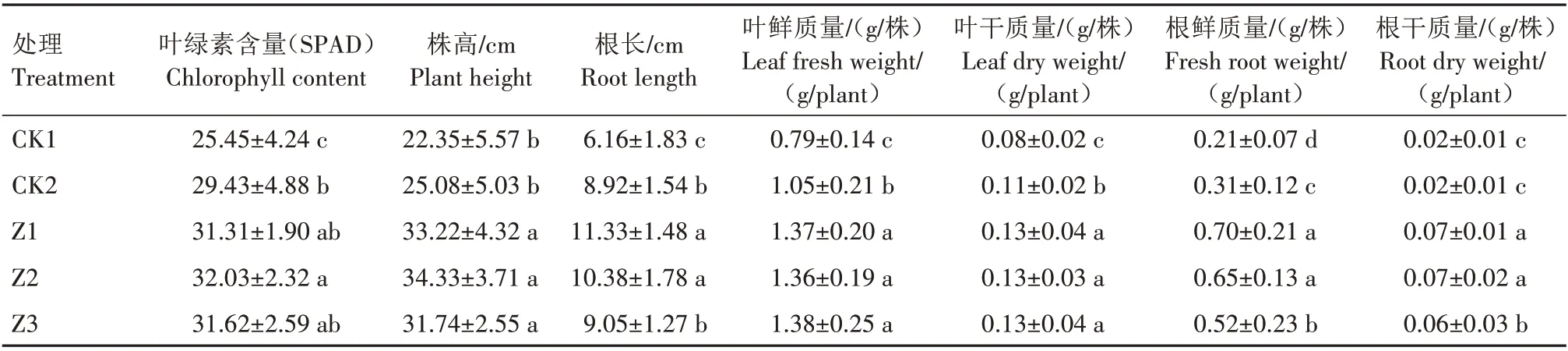
表10 耐盐碱溶磷菌对大豆生长的影响Tab.10 Effect of salt-alkali-tolerant phosphorus-solubilizing bacteria on the growth of soybean
3 结论与讨论
磷是植物生长发育过程中必需的矿质元素之一,缺磷作物将不能正常生长。盐碱土中有效磷含量比较低,作物生长受到限制。溶磷菌是一种有益的植物促生菌,它可以通过酶解、酸化、螯合和离子交换反应等溶解土壤中的不溶性磷酸盐[36-37],供植物生长。通过人工接种溶磷菌可以提高土壤中有效磷含量,促进植物生长。耐盐碱植物根部往往存在着耐盐碱促生菌,研究表明,与非根际土相比,根际土壤微生物多样性存在较大差异[38],本研究利用Biolog-Eco 板分析盐碱土中生长良好的苜蓿根际与非根际土壤微生物对碳源的利用情况,发现根际土壤微生物对不同碳源的利用率更高,说明根际土壤微生物种类更丰富,代谢能力更强,分离出溶磷效果好的菌株的可能性更大。本研究从生长于盐碱土壤的苜蓿根际土中分离得到98个溶磷菌株,通过对菌株的溶磷能力测定,最终筛选出Y7、W5 和Y31 3个高效耐盐碱溶磷菌株,3个溶磷菌株均能溶有机磷和无机磷,其溶有机磷能力更强,通过鉴定,这3个菌株分别为假单胞菌(Pseudomonassp.)、不动杆菌(Acinetobacter soli)、暹 罗 芽 孢 杆 菌(Bacillus siamensis)。
目前,关于溶磷菌的报道多是芽孢杆菌属和假单胞菌属[39-40],且大多数研究筛选的溶磷菌是溶无机磷量高的菌株,关于溶有机磷量高并具有耐盐碱能力的菌株报道较少。如SULEMAN 等[41]从小麦根际土中分离出2 个溶无机磷高的菌株,其中假单胞菌属菌株的溶磷量为280 μg/mL,肠杆菌属菌株的溶磷量为136 μg/mL。本研究分离得到的3 个菌株溶有机磷能力强,其中假单胞菌(Pseudomonassp.)溶磷量为456.35 mg/L;不动杆菌(Acinetobacter soli)溶磷量为400.44 mg/L;暹罗芽孢杆菌(Bacillus siamensis)溶磷量为128.63 mg/L。多数植物和微生物在高盐强碱且养分含量低的盐碱土壤中生存困难,这3 个菌株均可以在pH 值为9、NaCl 含量9%时生长,说明所分离得到的菌株溶有机磷能力强且具有耐盐碱性。
WU 等[42]从油茶根际土中分离得到芽孢杆菌属和假单胞菌属菌株,将其回接至油茶中,发现土壤营养元素含量均有提高,植物的光合能力、生物量也有提升,促进了植物生长。本研究盆栽结果显示,浇灌耐盐碱溶磷菌菌悬液的大豆可以在盐碱胁迫和缺磷环境下正常生长,说明在大豆生长过程中,溶磷菌具有很好的溶磷效果,可以保证大豆正常生长发育所需的磷素并且能够缓解盐碱胁迫对大豆生长的抑制作用;同时,与未接菌浇灌全磷营养液相比,其叶绿素含量和生物量均显著增加,说明耐盐碱溶磷菌还具有较好的促生作用。磷酸酶和植酸酶是微生物溶磷酶解机制的主要合成酶[43],本研究对菌株是否具有碱性磷酸酶基因(phoD)和植酸酶基因(appA)进行鉴定,结果发现,Y7 和W5具有碱性磷酸酶phoD基因,Y31具有植酸酶appA基因,说明Y7 和W5 菌株通过碱性磷酸酶溶解有机磷,Y31通过植酸酶溶解有机磷。
本研究从生长于盐碱土的苜蓿根际土中筛选得到3 个耐盐碱高效溶磷菌株,其溶解有机磷量较高,在盐碱土与沙子混合的缺磷土壤中对大豆表现出很好的溶磷促生效果,证明这3 个菌株能够适应盐碱环境,在盐碱条件下能发挥溶磷作用,缓解盐碱胁迫和缺磷对大豆生长的危害。
