鱼类肠道屏障损伤与肠道炎症发生发展关系的研究进展
2022-07-23陈秀梅王桂芹单晓枫钱爱东
陈秀梅,王桂芹,单晓枫,钱爱东
(吉林农业大学 动物科学技术学院/吉林省动物营养与饲料科学重点实验室/动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
水产养殖是食品生产行业增速最快的产业之一,为人类提供了大量的动物性食品。但是在快速发展的过程中,各类养殖病害不断暴发。鱼类机体的感染多数发生于黏膜或通过黏膜发生,尤其是肠黏膜。这是因为肠道作为一种重要的功能性器官,不仅具有消化食物、吸收营养的功能,其表面稳定而具有功能性的黏膜屏障还能阻止肠腔内细菌、毒素等有害物质侵入体内[1]。因与腔内大量的细菌、病毒、生物毒素及化学毒素广泛接触,肠黏膜组织成为机体遭受威胁最大的部位,损伤后极易引起肠道炎症,同时并发各种肠道疾病[2]。鉴于肠道炎症发生带来的严重危害,鱼类肠道炎症的发病机制已成为近年来养殖鱼类疾病防控等相关研究的热点。肠道炎症作为一种慢性非特异性肠道炎症性疾病,其发病原因复杂。研究表明,各种因素引起的肠道屏障功能受损在肠道炎症发生与发展中起重要作用[3]。鱼类肠道屏障分为生物屏障、化学屏障、机械屏障和免疫屏障这4 种。研究鱼类肠道屏障,对探索鱼类的肠道功能、调控肠道炎症非常重要。为此,对国内外鱼类肠道屏障损伤与肠道炎症发生发展关系的研究成果进行梳理,在了解鱼类肠道屏障结构与功能的基础上,分析肠道屏障损伤与肠道炎症发生发展关系,并基于稳定肠道屏障途径探索调控鱼类肠道炎症的策略,旨在解析鱼类肠道炎症发生机制,为鱼类等水产动物肠道炎症防控提供理论参考。
1 鱼类肠道屏障结构与功能
动物肠道屏障一般分为生物屏障、化学屏障、机械屏障和免疫屏障这4种,鱼类也不例外(图1)[4]。4种屏障之间的动态平衡是维持肠道内环境稳态的关键,一旦这个屏障的完整性被破坏,外源性有害物质就可入侵,进而危害肠道健康。
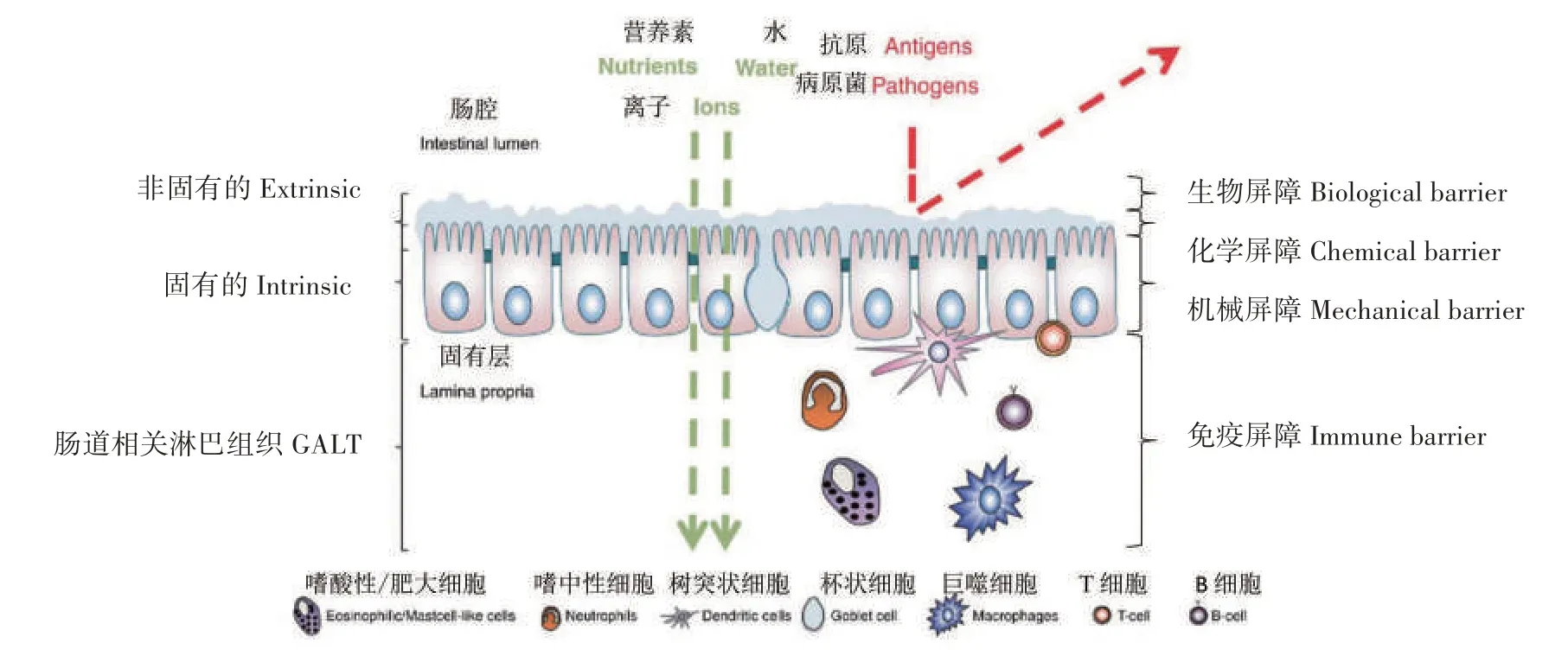
图1 鱼类的肠道屏障Fig.1 The fish intestinal barrier
1.1 生物屏障
动物肠道内存在着数量庞大、结构复杂的微生物,在漫长的进化过程中,这些菌群通过与肠黏膜黏附或者结合形成复杂的共生关系,构成生物屏障,在宿主生长发育过程中发挥着重要作用。与陆生哺乳动物相比,鱼类肠道微生态系统是一个由专性厌氧菌、兼性厌氧菌和好氧菌共同组成的动态菌群,其主要微生物组成[5]见表1。研究表明,在鱼卵进入水体并且孵化前,其表面就覆盖了大量的微生物[6]。在鱼类生长发育初始阶段,水体微生物是肠道优势菌的重要来源,多种细菌开始在肠道上皮定殖。随着鱼类开口摄食,饵料中携带的不同种类和数量的细菌也逐渐进驻肠道。最终,在遗传背景、外部环境(主要是水环境和饵料)及其他微生物等多方因素影响下,形成稳定的动态菌群[7-9]。

表1 鱼类肠道主要微生物组成Tab.1 Main microbial composition in fish intestine
1.2 化学屏障
化学屏障是指肠道上皮细胞外层黏液层中的黏蛋白、糖蛋白、黏多糖、各种消化酶、溶菌酶及肠腔内正常寄生菌产生的抑菌物质等化学物质。肠道化学屏障在有效吸收水、电解质、营养物质的同时,阻止肠腔内毒素、抗原、细菌等穿透上皮层进入血液和淋巴循环或神经系统,破坏宿主的动态平衡。它不仅保护肠黏膜免受酶、酸、碱侵蚀,还能够通过各种途径防御微生物对肠道的入侵[10]:肠道分泌的消化液可以稀释毒素,清洁肠腔,使潜在的致病菌难以黏附到肠上皮[11];肠道分泌液可以黏附抗原物质,使其更易被各种蛋白酶降解[12];溶菌酶能破坏细菌的细胞壁,从而使细菌裂解;另外,分泌物中还含有一些补体成分,可以协助肠道免疫细胞清除致病菌[13]。
1.3 机械屏障
机械屏障也叫物理屏障,由黏液层、肠上皮细胞、侧面的细胞连接和上皮下固有膜等组成,能够抵御外环境中病原体和有害物质入侵肠黏膜,还能阻止细胞间隙中物质渗出,选择性允许水、离子和溶质流通,是维持肠上皮的选择通透性及屏障功能的结构基础。肠上皮细胞连接从顶端到基膜依次为紧密连接(Tight junctions,TJ)、黏附连接、缝隙连接等,其中紧密连接对于维持肠上皮屏障功能有重要作用。前人研究发现,通过调节紧密连接蛋白能够加强机械屏障,环绕上皮细胞顶侧的紧密连接是决定细胞间通透性大小的主要因素[14]。紧密连接主要是由闭锁蛋白(Occludin)、闭合蛋白(Claudins)和连接黏附因子这几种膜蛋白和闭合小环蛋白(Zonula occludens,ZO)组成。在透射电镜下观察,紧密连接处细胞膜内的膜蛋白颗粒紧密相贴,交错形成紧密相连的网络结构封闭了细胞间隙,使之形成了完整的机械屏障(图2)[15-16]。

图2 肠上皮细胞紧密连接结构Fig.2 Structure of epithelial tight junctions
1.4 免疫屏障
肠道免疫屏障主要由肠道固有层和上皮中相关淋巴组织及其分泌的细胞因子、免疫球蛋白(鱼类主要有IgM、IgD、IgT/Z)构成[17-19]。此外,还有很多特殊的细胞参与肠道免疫活动,如肠黏膜固有层中弥散分布的巨噬细胞、自然杀伤细胞和上皮内淋巴细胞等。正常情况下,免疫屏障对无害信号刺激保持一种低反应性的免疫监视状态,通过清除危险信号维持肠道内环境的稳定;或是调动免疫耐受机制[20],如允许少部分完整的抗原穿过黏膜。一旦屏障受到损伤,会导致过多的有害物质进入,进而引起病理性免疫激活[21]。
2 肠道屏障损伤与肠道炎症发生发展关系
肠道屏障功能完整性是动物发挥最佳肠道功能的一种重要因素。肠道炎症作为一种慢性非特异性肠道炎症性疾病,其发病原因复杂。其中,肠道屏障因作为第一道防线,其损伤在肠道炎症发生、发展中发挥重要作用。
2.1 生物屏障损伤与肠道炎症发生发展关系
肠道生物屏障的主体是肠道菌群,当肠道菌群急剧变化,菌群平衡紊乱,导致致病菌和条件致病菌入侵和生长,即形成生物屏障损伤,极易诱发肠道炎症。张正等[22]对半滑舌鳎(Cynoglossus semilaevis)的研究结果表明,同一养殖系统中,腹水病和皮肤溃疡病患病鱼肠道菌群中细菌种类数仅是健康鱼的45.8%和64.5%,病鱼肠道细菌多样性明显下降。又有研究报道,患细菌性出血病的黄颡鱼(Pelteobagrus fulvidraco)肠道细菌数量显著增加,与健康黄颡鱼相比,气单胞菌增加18.3%~33.6%,细菌种类明显减少[23]。说明肠道菌群的多样性与疾病发生存在某种关联。这可能是肠道内的正常共生菌群可以分泌一些具有抑菌活性的物质,抑制病原微生物在肠道黏膜内生长、定殖[24]。且当肠道正常菌群因宿主受到各种因素刺激失调时,病原菌的异常繁殖会导致宿主免疫能力降低而发病[25]。在对草鱼(Ctenopharyngodon idellus)的研究中发现,随着肠道中气单胞菌属细菌含量下降、肠杆菌科细菌含量上升,其白细胞的吞噬百分比和吞噬指数明显上升[26]。据此推测,当鱼类生物屏障损伤时,肠道菌群多样性下降,致病菌数量大大增加,且一些抑菌活性物质也相应减少,致使机体免疫机能下降,最终让致病菌定殖,从而诱发各种炎症。
2.2 化学屏障损伤与肠道炎症发生发展关系
肠道化学屏障是指肠道中一系列防范外来菌侵袭的化学物质。其中,由杯状细胞产生和分泌的糖基化黏蛋白在阻止外来污染物进入深层组织发挥了重要作用[27]。赵杰等[28]利用2,4,6-三硝基苯磺酸(TNBS)诱导草鱼肠炎后,在后期恢复过程中发现,草鱼肠道炎性细胞逐渐减少,同时伴随着杯状细胞的丰富。β-伴大豆球蛋白作为大豆中主要的抗原蛋白,一直被用来评价大豆诱导的鱼类肠道损伤机制。邢秀苹等[29]的研究结果表明,饲料中添加一定量的β-伴大豆球蛋白后,鲤(Cyprinus carpio)稚鱼和幼鱼的肠道蛋白酶活力显著下降,尤其是后肠。 翠 鳢(Channa punctatusBloch)暴 露 在 汞(0.3 mg/L)7 d 后,肠道出现严重炎症,同时伴随细胞吞噬、细胞黏附和细胞内杀伤活性显著降低以及一氧化氮和髓过氧化物酶显著降低[30]。黏液是以黏蛋白为基础骨架成分的高水分黏性液体,在鱼类肠道尤其是后肠大量分泌,成分非常复杂,除黏蛋白外还有免疫球蛋白、补体、凝集素、溶菌酶等。在斑点叉尾鮰(Ictalurus punctatus)上的研究表明,感染鮰爱德华氏菌(Edwardsiella ictaluri)后,肠道黏蛋白2(Muc2)基因的表达水平显著上升[31]。以上研究结果均表明,化学屏障在肠道炎症发生及修复过程中扮演着重要角色。
2.3 机械屏障损伤与肠道炎症发生发展关系
肠道机械屏障一直深受研究者关注,尤其在探究肠道健康方面是首要的关注点。其中,关于紧密连接方面的研究较多。在草鱼上的研究发现,饲喂丙 二 醛(MDA)72 d 后,闭 锁 蛋 白、闭 合 蛋 白(Claudin-3、Claudin-15a)以及闭合小环蛋白表达量显著下调,表明紧密连接“锁扣”结构被打开,肠道屏障功能的完整性被破坏[32]。黄雨薇等[33]研究发现,草鱼肠道损伤后,其肠道黏膜细胞间紧密连接结构也发生损伤,肠道屏障通透性显著增加。在嗜水气单胞菌(Aeromonas hydrophiia)诱导的鲫鱼(Carassius auratus)肠 道 炎 症 发 现 中,ZO-1 和Occludin 的转录水平显著下降[34]。在利用敌百虫诱导鲤鱼肠道损伤的研究中发现,敌百虫暴露显著降低了鲤鱼紧密连接基因Claudin-2、Occludin和ZO-1的表达水平[35]。SONG 等[36]研究发现,氧化鱼油(6%)饲喂团头鲂(Megalobrama amblycephala)12 周后,肠中皮细胞的完整性及绒毛结构被破坏。以上研究结果均表明,现有肠道损伤均伴随着肠道结构完整性的破坏,鱼类机械屏障在阻碍外来致炎因子进入机体方面发挥重要作用。但炎症发生在肠道机械屏障破坏之前或之后或同时,还需要深入探究,这是因为目前的研究极少聚焦两者的前后发展变化方面。
2.4 免疫屏障损伤与肠道炎症发生发展关系
作为抵抗感染的第一道防线,先天免疫系统负责快速响应并识别和消除入侵病原体[37]。侯月娥等[38]的研究结果表明,鲨鱼弧菌(Vibrio carchariae)入侵军曹鱼(Rachcentron canadium)后,Igμ 链基因表达变化明显,黏膜免疫屏障(鳃、胃、肠)最先抵御外来抗原。免疫能力下降与肠道炎症发生有直接关联。WANG 等[39]研究发现,膳食棉酚降低生长中草鱼的肠道免疫力,加重肠道炎症反应。尽管鱼类肠道相关的淋巴组织水平远低于哺乳动物,但其具有更分散的免疫系统,包括许多淋巴细胞、巨噬细胞、嗜酸性粒细胞和嗜中性粒细胞等等。在豆粕(替代饲料20%蛋白质)诱导的鲤鱼后肠肠炎的研究中,饲喂1 周后即出现炎症,3 周后嗜碱性粒细胞数量增加,但在第4 周和第5 周出现相反的趋势(开始恢复)[40]。在鲤科鱼类的研究中发现,它们肠道上皮组织有许多类似巨噬细胞的细胞,当接触抗原后(肛门灌入),其数量成倍增加[41]。这表明肠道免疫机能开始发挥作用,并能改善肠道炎症状况。而且,在一些鱼类如鲤鱼和大西洋鲑(Salmo salarL.)肠的上皮组织和固有层中存在丰富的T 细胞[42]。MARJARA 等[43]在大西洋鲑上的研究结果证明,T 细胞参与到肠道炎症的产生,即TH17 细胞的激活可能引发炎症。由此可见,肠道免疫屏障在炎症的发生及修复过程中起到关键的作用。
3 鱼类肠道炎症的防控策略
鱼类肠道炎症的发生发展以及修复与肠道屏障功能变化密不可分,鱼类4 种肠道屏障功能损伤均在鱼类肠道炎症的发展过程中扮演重要角色,这也为防控鱼类肠道炎症提供了一定的思路和靶标。近年来,基于肠道4 种屏障特点,外源添加益生菌、功能性物质及复方中草药制剂在维持肠道屏障功能及防控鱼类肠道炎症等发面表现出极大的潜力。
3.1 外源添加益生菌
大量研究已经证实,来源于环境和宿主肠道中的益生菌如放线菌、细菌、纤维菌、变形杆菌和酵母等在维持水产动物尤其是鱼类肠道健康方面发挥重要作用。 把分离自南美白对虾(Penaeus vannamei)肠道的节杆菌(Arthrobactersp.)CW9 添加到其养殖水环境中,发现益生菌组的虾存活率、平均体质量以及虾体内酚氧化酶活性、吞噬细胞吞噬活性和清除效率均明显高于对照组[44]。对从牙鲆(Paraiichthys oiivaceus)上分离出来的肠黄枝菌(Fiaviramulus ichthyoenteri)Th78T菌株进行全基因组测序和生物信息学分析,表明其具有产生群体猝灭酶、利用肠道中各种营养物质以及产生消化酶和维生素的能力,显示出其作为益生菌的前景[45]。WANG 等[46]研究结果表明,热灭活克劳氏芽孢杆菌(Bacillus clausii)DE5 提高了石斑鱼(Epinephelus coioides)肠道Toll 样受体-5、促炎细胞因子(白细胞介素-8 和白细胞介素-1)和转化生长因子-1 的表达水平。 HAO 等[47]研究发现,口服益生菌(Shewanella xiamenensisA-1 和Shewanella xiamenensisA-2)可以积极改善草鱼肠道微生物群落组成,这与调节草鱼免疫有关,提示益生菌引起的微生物区系改变可能会降低草鱼培育阶段疾病暴发的风险。RAN 等[48]证明,酿酒酵母(Saccharomyces cerevisiae)显著增加罗非鱼(Oreochromis mossambicus)肠道微绒毛长度和提高胰蛋白酶活性,降低肠道HSP70 的表达,增强其对嗜水气单胞菌感染的抗性。由此可见,益生菌作用多元化,其调节宿主免疫力的功能不仅集中在肠道,全身免疫的效果也不容忽视。因此,在探究益生菌调控肠道炎症的作用机制方面不要局限于肠道组织。
3.2 外源添加功能性物质
近年来,一些直接从动植物中提取,也可利用化学方法进行合成,或利用基因手段、微生物发酵和酶解作用制备的功能性物质在改善鱼类肠道健康如调节肠道菌群、提高免疫力和抗应激能力、降低肠道疾病发生等方面功效明显,如低聚糖类、有机酸、黄酮类、抗菌肽及酶制剂等。对于鱼类来说,低聚糖类中的壳聚糖由于其副作用小,具有增强机体生长性能、提高免疫功能、抑制肠道病原微生物和降低胆固醇等功能,被广泛用作饲料添加剂,尤其在刺激鱼类肠道有益微生物生长、防止病原菌增殖、提高机体免疫力等方面效果突出[49]。据报道,有机酸添加剂可通过适当降低动物消化道pH 值来促进有益菌种的生长,进而达到抑制有害菌群繁殖的目的[50]。已有研究证实,黄酮类天然产物通过抑制细菌生物膜的形成等机制调节肠道菌群失衡,进而改善炎症性肠病[51]。作为先天性防御系统的重要组成部分,具有广谱抗菌性的抗菌肽是生物体抵抗外界病原体侵袭而产生的一类小分子活性多肽,其中由肠上皮细胞产生并分泌的抗菌肽-α防御素,可通过去除病原体并与有益微生物共生,保持肠道稳态平衡[52]。酶制剂可通过破坏不易消化吸收的大分子物质中特殊的化学键,降低抗营养因子的含量,刺激内源性酶的活性及补充幼鱼内源性酶的不足等方式提高鱼类肠道对饲料原料中营养物质的利用率,进而减少肠道炎症的发生[53]。
3.3 外源添加复方中草药制剂
随着饲料“禁抗”风潮的来临,中草药因其天然、无害、易于准备、价格低廉及对养殖动物和环境几乎没有副作用的优点引起了广大研究者的关注。但中草药添加量大,如果粉碎后直接搅拌添加到饲料中,饲料适口性受到影响。因此,通过自然炮制和科学配伍获得的复方中草药制剂成为新的聚焦点。目前,常用的中草药有大黄、黄芪、黄芩、黄连、黄柏、大蒜、陈皮、党参、当归、杜仲、山楂、枸杞、金银花、肉桂、白术等,动物性中药大多选用蚯蚓粉、乌贼粉、河蚌等。徐安乐等[54]研究发现,添加剂量为1.2%的复方中草药(由黄芪、党参、大黄等12 种中草药组合而成)对珍珠龙胆石斑鱼(Pear gentian grouper)肠道消化酶活性的影响尤为明显。刘红柏等[55]研究发现,添加中草药可明显改变鲤鱼肠道细菌组成及数量,使有益菌类增加,并抑制大部分条件致病菌的生长。在黄鳝(Monopterus albus)上的研究结果也表明,茯苓、黄芪及五加皮可显著提高其血液白细胞的吞噬活性、溶菌酶和超氧化物歧化酶活性[56]。同样,将牛膝种子提取物饲喂罗非鱼2 周后,可显著提高血清溶菌酶、补体交替活性和促进细胞活性氧、反应性氮中间体和髓过氧物酶的生成[57]。有学者发现,将中草药进行发酵效果更为显著,在鲤鱼饲料中添加枯草芽孢杆菌发酵中药,能显著提高鲤鱼生长性能、肝脏抗氧化能力及抗嗜水气单胞菌感染能力[58]。
4 小结与展望
综上,鱼类肠道各屏障均具有不同的结构、功能及分子调控机制,同时又可通过各自的信号通路有机地整合在一起,共同抵御外来物质对机体的侵袭。鱼类肠道炎症的发生发展与这4种屏障功能损伤有密切关系,但现有研究均只是聚焦肠道健康的相关指标,且大多是最终结果,忽视了发展过程中彼此的关系。益生菌、功能性物质添加剂及复方中草药制剂在治疗鱼类肠道炎症方面极具潜力,但相关研究均比较浅显。因此,今后的研究应聚焦以下几点:一、4 种肠道屏障功能密不可分,不可单一研究,要整体探讨;二、不同肠道屏障损伤对肠道炎症的发生发展有不同的作用机制,要一一探索;三、理论结合实践,肠道炎症的诱导因子要结合实践生产来确定;四、基于肠道炎症发生机制,寻求治疗肠道炎症的新靶点迫在眉睫。总之,随着时代的发展,越来越多、新的生物科学技术手段和试验方法会应用于鱼类肠道屏障的相关研究,最终将获得更有实践价值的研究结果服务于水产养殖业。
