右美托咪定预处理对气腹所致大鼠肾脏损伤的保护作用
2022-07-23艾丽平张士霞张暖暖张玮琪河北农业大学动物医学学院河北保定071000
艾丽平,张士霞,李 航,张暖暖,张玮琪 (河北农业大学 动物医学学院,河北 保定 071000)
腹腔镜外科发展已有120多年的历史,我国腹腔镜技术起步虽晚,但发展迅速,目前在动物医学领域应用越来越广泛。腹腔镜手术过程中需要建立CO2气腹,但随着人们对腹腔镜手术越来越深入的了解,发现CO2气腹充气再放气的过程会对组织造成缺血再灌注损伤(ischemia /reperfusion injury,I/RI),影响生理功能。肾脏是机体供血量最丰富的器官,CO2气腹对肾脏生理功能影响尤甚。CO2气腹对大鼠肾脏的损伤机制复杂,尚未完全阐明。研究表明,CO2气腹致肾脏损伤的发生可能与氧化应激和炎症反应密切相关[1-3]。氧化应激会进一步诱发内质网应激反应,持续、强烈的内质网应激还可以引起肾小管上皮细胞细胞凋亡[4-5]。右美托咪定(dexmedetomidine,Dex)是一种新型高选择性α2受体激动剂,具有镇静、抗焦虑等作用,临床上常被应用于麻醉的辅助用药[6]。大量动物试验表明Dex有抗氧化应激、抗炎和抗凋亡作用,可以从多方面起到保护肾脏的功能[7]。但其对腹腔镜气腹所致肾脏损伤的预防保护机制还不是很清楚。为找到减轻气腹所致的肾缺血再灌注损伤的药物或治疗方法来尽量避免腹腔镜技术的缺点,拓展其发展,使其更好的应用于兽医临床。本试验探究了Dex对CO2气腹引起的肾脏损伤的保护作用,并初步阐明其机制,为临床上减轻CO2气腹所致肾脏损伤提供一种可选择的保护方法,促进腹腔镜外科的发展。
1 材料与方法
1.1 材料盐酸右美托咪定购于上海源叶生物科技有限公司;肌酐(Cr)、尿素氮(BUN)、超氧化物歧化酶(SOD)、丙二醇(MDA)检测试剂盒购于南京建成生物工程研究所;大鼠白细胞介素1β(IL-1β)、大鼠肿瘤坏死因子α(TNF-α)、大鼠白细胞介素6(IL-6)酶联免疫分析试剂盒购于北京冬歌博业生物科技有限公司;PrieScriptTM RT Master Mix试剂盒和TB Green®Premix Ex TaqTMⅡ试剂盒购自大连TaKaRa公司;TransZol Up Plus RNA Kit试剂盒购自北京全式金生物公司。
1.2 模型制备8周龄健康雄性Sprang-Dawley (SD)大鼠18只(由北京斯贝福生物技术有限公司提供),体质量250~300 g,饲喂标准化鼠粮,不限饮水,保证饲养环境稳定。实验动物随机分为3组,分别为对照(Sham)组,气腹(Pp)组,右美托咪定预处理(Dex)组,每组各6只。Sham组进行呼吸麻醉,麻醉后将气腹针扎入腹中但不充气;Pp组和Dex组分别腹腔注射生理盐水(1 mL/kg)和Dex(50 μg/kg),30 min后进行呼吸麻醉,进入麻醉状态后,将气腹针插入腹中,给予15 mmHg压力建立CO2气腹,气腹持续90 min。气腹解除后6 h采集血液和组织,采用大鼠麻醉箱进行麻醉,进入全麻状态后从心脏采血,分离血清保存于-80℃,用于检测肾功和炎症指标。大鼠处死后,一部分肾组织放于福尔马林固定液中,用于病理切片制作;另一部分肾组织放于-80℃ 保存,用于组织氧化应激、内质网应激和内质网凋亡相关基因的检测。
1.3 肾功能检测根据试剂盒说明书检测血清中Cr和BUN含量的变化。
1.4 肾脏氧化应激指标检测取-80℃冻存的肾组织100 g,加入900 μL生理盐水制备10%肾组织匀浆。剪碎组织,冰水浴中制备匀浆,4℃,2 500 r/min,离心10 min,取上清后采用BCA法进行蛋白定量,根据检测试剂盒说明书检测肾脏组织匀浆中氧化应激指标 MDA、SOD含量的变化。
1.5 炎症细胞因子检测根据酶联免疫分析(ELISA)试剂盒说明书,采用双抗夹心法检测大鼠血清中的白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和白细胞介素 6(IL-6)的水平。
1.6 组织病理学形态检查将新鲜肾组织固定在10%中性福尔马林中,48 h后取出,修剪为合适尺寸,用流水冲洗过夜,分别依次放入70%,80%,90%,95%和100%酒精中进行脱水,经二甲苯透明、浸蜡、包埋处理后进行切片,HE染色,镜下观察肾脏组织病理学变化并拍照记录。
1.7 内质网应激和相关凋亡基因的mRNA检测采用实时荧光定量方法进行基因水平的检测。用TransZol Up Plus RNA Kit试剂盒提取肾组织匀浆总RNA,使用PrieScriptTMRT Master Mix试剂盒将RNA反转录为cDNA,使用TB Green®Premix Ex TaqTMⅡ试剂盒,在LightCycler®96中进行实时定量PCR。扩增条件:95℃ 30 s预变性;95℃ 5 s变性,60℃ 30 s退火延伸,40个循环。所用引物(表1)由生工生物工程(上海)股份有限公司合成。使用2-△△Ct方法分析相对mRNA的表达。
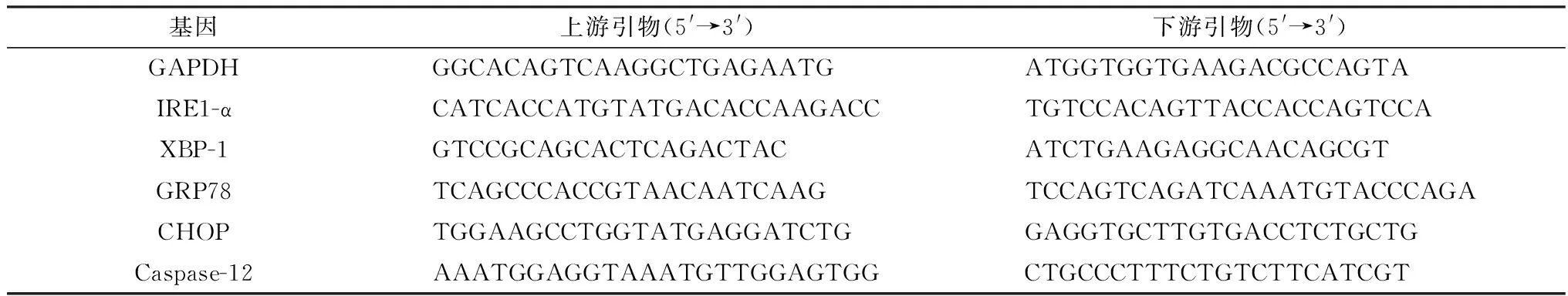
表1 引物名称及序列

2 结果
2.1 血清Cr和BUN水平的测定结果大鼠肾功能检测结果显示(图1),与Sham组相比,Pp组和Dex组气腹后6 h血清中BUN和Cr水平均极显著升高(P<0.01)。与Pp组相比,Dex组Cr水平显著降低(P<0.05),BUN极显著降低(P<0.01)。

A.大鼠血清中Cr的含量(n=6);B.大鼠血清中BUN的含量(n=6)图1 血清中BUN及Cr含量
2.2 肾脏MDA和SOD的测定结果大鼠肾组织匀浆中氧化应激因子含量检测结果如图2显示,与Sham 组相比,Pp组和Dex组肾脏中SOD活力极显著降低(P<0.01),MDA含量极显著升高(P<0.01);与Pp组相比,Dex组肾脏中SOD极显著升高(P<0.01),MDA极显著降低(P<0.01)。

A.大鼠肾组织匀浆中SOD含量(n=6);B.大鼠肾组织匀浆中MDA的含量(n=6)图2 肾脏组织中MDA和SOD含量
2.3 血清 IL-1β、IL-6、TNF-α的测定结果大鼠血清中炎症因子结果(图3)显示,与Sham 组相比,Pp组和Dex组血清中 IL-1β、IL-6、TNF-α炎症因子含量均极显著升高(P<0.01);与Pp组相比,Dex组血清中IL-1β、IL-6、TNF-α炎症因子含量均极显著降低(P<0.01)。

图3 血清中IL-1β、IL-6、TNF-α的含量变化(n=6)
2.4 肾脏病理学显微镜观察结果大鼠肾组织光镜下病理切片显示,Sham组肾小管上皮细胞形态规则,刷状缘完整,肾组织未显示任何明显病理变化(图4A);Pp组可见大量肾小管上皮细胞肿胀,部分肾小管上皮细胞刷状缘脱落,细胞膜破裂,核裸露、淡染,肾小管间隙有出血,部分肾间质有炎症细胞浸润,肾小球内皮细胞和系膜细胞有炎性细胞浸润,部分还可见肾小球系膜细胞增生(图4B);Dex组与Pp组相比明显减轻,肾间质出血减少,上皮细胞刷状缘脱落明显改善(图4C)。

A.Sham组;B.Pp组;C.Dex组图4 肾脏组织病理学变化(400×)
2.5 肾脏内质网应激相关基因mRNA水平检测大鼠内质网应激IRE1-α通路相关基因mRNA检测结果显示,与Sham 组相比,Pp组和Dex组GRP78、IRE1-α、XBP-1 mRNA水平均极显著升高(P<0.01);与Pp组相比,Dex组GRP78、IRE1-α、XBP-1 mRNA水平均极显著降低(P<0.01)(图5)。

图5 肾脏中GRP78、IRE1-α、XBP-1基因的表达
2.6 大鼠内质网应激凋亡通路相关基因mRNA水平RT-qPCR结果显示,与Sham 组相比,Pp组和Dex组CHOP、Caspase-12 mRNA的表达均极显著升高(P<0.01);与Pp组相比,Dex组CHOP极显著降低(P<0.01),Caspase-12 mRNA显著降低(P<0.05)(图6)。

图6 肾脏中CHOP、Casp-12基因表达
3 讨论
腹腔镜手术期间为了提供清晰的视野条件,需要向体内不断的注入CO2,将气腹维持在一定压力,建立操作空间。CO2气腹产生的压力会压迫血管和器官,导致组织缺血,供氧量减少,使细胞发生水肿、钙超载等损伤[8]。当CO2气腹消除时,血液和氧气重新灌注,又会使肾组织发生再灌注损伤[9]。肾功能指标Cr、BUN的水平变化,是评价肾功能损伤的标准之一[10]。试验结果显示,气腹压升高到15 mmHg,肾脏BUN和Cr均显著升高;在肾脏病理组织切片中也看到肾小管上皮细胞肿胀、刷状缘丢失;肾小管间隙出血、有炎症因子浸润等病理变化,表明CO2气腹对肾脏造成了损伤,造模成功。但通过腹腔注射Dex干预气腹过程后,BUN和Cr水平均显著下降;肾小管上皮细胞肿胀有所缓解,刷状缘完整,肾小管间隙出血减少,说明通过腹腔注射Dex进行预处理可以减轻CO2气腹后肾脏损伤程度。
大量临床研究表明,CO2气腹可诱导机体产生氧化应激反应[11]。MDA是常用的脂质过氧化指标,可通过MDA含量的高低变化评估氧化损伤的程度,含量越高说明氧化损伤越严重。而SOD是机体重要的自由基清除剂,能减少脂质过氧化,维持氧化及抗氧化平衡[12]。试验结果显示CO2气腹后,MDA显著升高,SOD含量下降显著,表明CO2气腹可能引起了肾脏的氧化应激损伤。但用Dex进行干预后,与气腹组相比,MDA下降显著,SOD含量升高显著,证明Dex可以通过调节MDA和SOD水平减轻机体肾脏组织的氧化损伤。
CO2气腹过程中肾脏组织出现缺血、缺氧状态,恢复再灌注时会产生大量的炎性介质,促进炎症细胞因子IL-6、IL-1、TNF-α等的释放,参与炎症反应[13-14]。本试验中病理切片和炎症因子的检测均显示,CO2气腹过程有炎症反应的参与,应用Dex干预气腹过程后,抑制了IL-1、IL-6、TNF-α等炎性因子的分泌,预示着Dex能从抗炎方面保护肾功能。
机体的氧化应激和炎症反应均可以导致内质网功能紊乱,诱发内质网应激反应(endoplasmic reticulum stress,ERS),从而激活未折叠蛋白反应(unfolded protein response,UPR)。UPR过程中,肌醇需求酶 (inositol-requiring enzyme 1,IRE1)从葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)上解离下来,一方面通过 GRP78与未折叠蛋白结合,另一方面,游离下来的IRE1通过激活IRE1/XBP-1(X-box binding protein 1,X盒结合蛋白1)通路调控下游基因表达等方式缓解内质网应激[15-16]。但如果内质网应激程度过强或者时间过长,可激活与内质网未折叠蛋白反应关联的凋亡信号C/EBP同源蛋白(CHOP)的表达和Caspase-12活化,引起细胞凋亡[17-19]。试验中GRP78、IRE1、XBP-1 mRNA的表达均升高,说明肾脏细胞可能发生了内质网应激反应,CHOP、Caspase-12等的mRNA表达升高,由此推断内质网应激反应可能进一步引起了细胞凋亡。Dex预处理组中GRP78、IRE1-α、XBP-1和CHOP、Caspase-12的表达水平均有所下降,表明Dex可能通过减轻内质网应激反应减少凋亡的发生。
CO2气腹可以导致肾脏发生炎症损伤、氧化应激损伤、内质网应激反应和细胞凋亡,而Dex可以从降低肾脏氧化应激反应、减少炎症因子的释放等方面减弱CO2气腹引起的肾脏缺血再灌注损伤。其保护机制还可能包括通过抑制IRE1的表达,下调XBP-1、CHOP、Caspase-12的表达,减少肾脏内质网应激反应和降低细胞凋亡。
