小球藻对凡纳滨对虾池塘微藻群落的影响及与环境因子的关系
2022-07-20姚冬梅张达娟张树林
姚冬梅,张达娟,张树林,张 迎
(天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384)
凡纳滨对虾(Litopenaeusvannamei)又名南美白对虾,为我国对虾养殖的主要品种之一[1]。随着水产养殖的规模化发展,养殖密度不断提高,水中的氮、磷和有机物含量也不断增高[2-3],导致水质不断恶化,造成病害频发,引起巨大经济损失。水产微生物制剂常用于调水、肥水、改底等,但微生物制剂中的游离菌体极易失活[4],受养殖背景环境(生物因子:物种组成和生物量;非生物因子:水温、光照、pH、溶解氧、营养盐和有机质含量)影响大,且有研究表明,在对虾养殖池塘中,微生物制剂对细菌群落优势种的重塑能力有限,不能定殖在养殖水体成为优势种[5]。而微藻因其活性强、受环境影响弱、易占主导等特点成为近年来研究的热点[6-7]。通过接种微藻来有效调控水质、降低病害发生频率是目前有效确保水产养殖健康发展的重要调控手段[8],普通小球藻(Chlorellavulgaris)因其营养丰富,对环境的适应能力强,生长、繁殖迅速,易于培养等特点被广泛应用于水质调控中[9]。
对虾养殖周期适逢夏季高温,微囊藻(Microcystis)大量增殖而引起的水华频发,其释放的蓝藻毒素显著抑制对虾的生长和繁殖,严重时甚至导致对虾大规模死亡[10]。而接种小球藻会与微囊藻产生竞争抑制效应,使微囊藻的生长受到抑制。朱为菊[11]研究表明,4.5×108个/L初始密度的微囊藻与小球藻混养时,随着小球藻接种密度的提高,对微囊藻生长的抑制效果愈加明显。张坤等[12]在此研究的基础上,进一步提高了微囊藻的初始密度,当微囊藻初始密度为1.8×109个/L时,小球藻接种密度的提高对微囊藻生长抑制效果不明显。上述研究大多在条件可控、相对稳定的条件下进行,且藻类种类存在局限性,忽视了微藻群落结构变化与对虾健康养殖的密切关系。而对虾养殖在不同季节和不同阶段水体中藻相会发生动态变化,如张振华等[13]研究发现,脊尾白虾(Exopalaemoncarinicauda)养殖池接种小球藻后,水体中的藻类组成发生了改变。因此关于在凡纳滨对虾自然养殖水体中接种小球藻对微藻群落结构的影响仍需进一步研究。
水体中氨氮和亚硝态氮含量是制约凡纳滨对虾健康的主要水质因子。Hargeraves等[14]研究发现,氨氮和亚硝态氮含量过高会直接造成凡纳滨对虾的死亡。蔡志辉[15]指出,氨氮质量浓度<0.6 mg/L、亚硝态氮质量浓度<0.1 mg/L的水体才能保证凡纳滨对虾生长及成活。而微藻群落结构的变化对凡纳滨对虾养殖水体中氨氮和亚硝态氮的去除鲜有报道。因此笔者在凡纳滨对虾养殖池塘定向接种普通小球藻,分析微藻群落结构的变化特征,查明接种普通小球藻与环境因子互作关系以及对氨氮和亚硝态氮的影响,以期为合理接种普通小球藻以及接种后日间合理控制环境因子调控凡纳滨对虾养殖池塘提供参考。
1 材料与方法
1.1 藻种来源
接种用的普通小球藻FACHB-8购自中国科学院水生生物研究所淡水藻种库,经培养后含藻细胞密度为1.0×1010个/L。
1.2 试验设计
试验池塘位于天津市宝坻区富淼水产养殖合作社的两口凡纳滨对虾养殖池塘,池塘占地面积均为100 m2,平均水深1.5 m。
试验于2018年5—8月进行,每10 d于12:00采集1次样本,共进行9次,设不接种小球藻(对照组)和接种小球藻(试验组)2个处理组,试验组每10 d投放25 L密度为1.0×1010个/L的小球藻,试验组接种终密度为1.5×107个/L。为确保2个处理组对虾养殖池塘的条件相同,将对照组养殖用水转移至试验组,添加养殖用水至两池水位相同,试验前测量两池浮游植物种类,使其种类相差不超过5%、密度相差不超过5%。
1.3 样品采集及处理
1.3.1 微藻
为避免微藻昼夜垂直运动在水体不同水层分布不同的影响,使用1 L的有机玻璃采水器,在池塘中心的水体表层、中层、底层各取样1 L,将各层水体处取得样品混合均匀后再从混合样中取1 L,每升加入15 mL鲁哥试剂固定并贴好标签。带回实验室将水样静置沉淀48 h后,虹吸至30 mL待检。微藻种类鉴定参考《中国淡水藻类》[16]。
1.3.2 理化因子
使用1 L的有机玻璃采水器在水体表层、中层、底层各取样1 L,将各层水体处取得样品混合均匀后再从混合样中取1 L,带回实验室用于氨氮、亚硝态氮的测定。氨氮、亚硝态氮含量的测定方法参考《水与废水监测分析方法》[17]。
现场采用pH meter、ORP instrument、flexi溶解氧测定仪、Portable REFRACTOMETER和透明度盘测定pH、氧化还原电位、水温、溶解氧浓度、透明度等物理环境因子。
1.4 数据处理
1.4.1 浮游植物优势度
优势度(Y)的计算公式为:
Y=(ni/n)×fi
(1)
式中,ni为样品中某藻数量,n为采集样品中浮游植物总数量,fi为样品中某浮游植物出现的频率。当物种优势度>0.02时,该种即为优势种群[18]。
1.4.2 浮游植物群落结构分析
采用 PRIMER 6.0 进行多元统计分析:首先对物种的丰度数据进行平方根转换以平衡优势种和稀有种在群落中的影响,并计算不同采样时间内的Bray-Curtis相似性系数,构建相似性矩阵,然后采用等级聚类方法和非度量多维标度排序方法分析浮游植物的群落分布格局。通过单因子相似性分析检验不同聚类组间的差异性[19],并通过相似性百分比分析不同物种对各群落组内相似性和组间差异性的平均贡献率。
Bray-Curtis相似性系数(B)计算公式如下:
(2)
式中,S为微藻种类数,Xij和Xim分别表示第i个种类在第j个采样日期和第m个采样日期之间的平均微藻密度。
1.4.3 浮游植物群落与环境因子的分析
利用CANOCO 4.5软件分析物理环境因子与浮游植物优势属种间的关系。先对凡纳滨对虾养殖池塘内浮游植物优势属密度作去趋势对应分析(DCA),判断单峰响应梯度SD值的大小,若4个轴中梯度最大值大于4则选择单峰模型,进行典范对应分析(CCA),若4个轴中梯度最大值小于4则选择线性模型,进行冗余分析(RDA)。物种密度和物理环境因子的数值进行量纲的统一,并经过lg(x+1)进行标准化[20]。
2 结果与分析
2.1 试验对养殖池塘微藻群落结构的影响
2.1.1 微藻种类组成及优势种
试验前,对照组鉴定出微藻共5门36属(种):蓝藻门6种,占全部种类的16.7%;绿藻门22种,占总种类的61.1%;硅藻门5种,占总种类的13.9%;裸藻门2种,占总种类的5.5%;隐藻门1种,占总种类的2.8%。接种普通小球藻的试验组鉴定出微藻5门38属(种):蓝藻门6种,占总种类的15.8%;绿藻门24种,占总种类的63.2%;硅藻门5种,占总种类的13.1%;裸藻门2种,占总种类的5.3%;隐藻门1种,占总种类的2.6%。
对照组微藻总密度呈先升后降的趋势,最大密度达到1.3174×108个/L,蓝藻门微藻密度呈先升后降的趋势,最大密度达到1.1862×108个/L,绿藻门微藻密度呈下降趋势,其余微藻密度变化稳定。试验组微藻总密度整体呈先升后降的趋势,试验后期起伏明显,最大密度达到1.2148×108个/L,蓝藻门微藻密度呈先升后降的趋势,最大密度达到 2.552×107个/L,较对照组平均密度比例下降了76.32%,绿藻门微藻密度整体呈先升后降的趋势,波动明显,较对照组平均密度比例上升了70.32%,其余微藻密度变化稳定(图1)。
两池微藻群落的共有优势种为铜绿微囊藻(M.aeruginosa)、四尾栅藻(Scenedesmusquadricauda)、尖细栅藻(S.acuminatus)、二形栅藻(S.dimorphus)、斜生栅藻(S.obliquus)、双列栅藻(S.bijugatus)、规则四角藻(Tetraedronregulare),对照组以蓝藻门的铜绿微囊藻占绝对优势,试验组以绿藻门的普通小球藻占绝对优势,经小球藻长期接种后,铜绿微囊藻已不占明显优势,但微藻群落优势种比例减少50%(表1)。
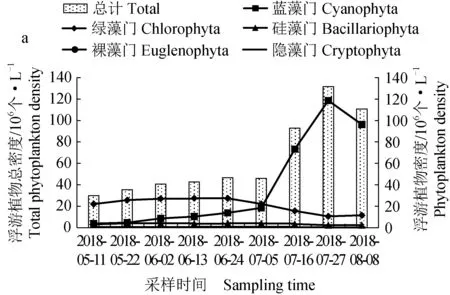
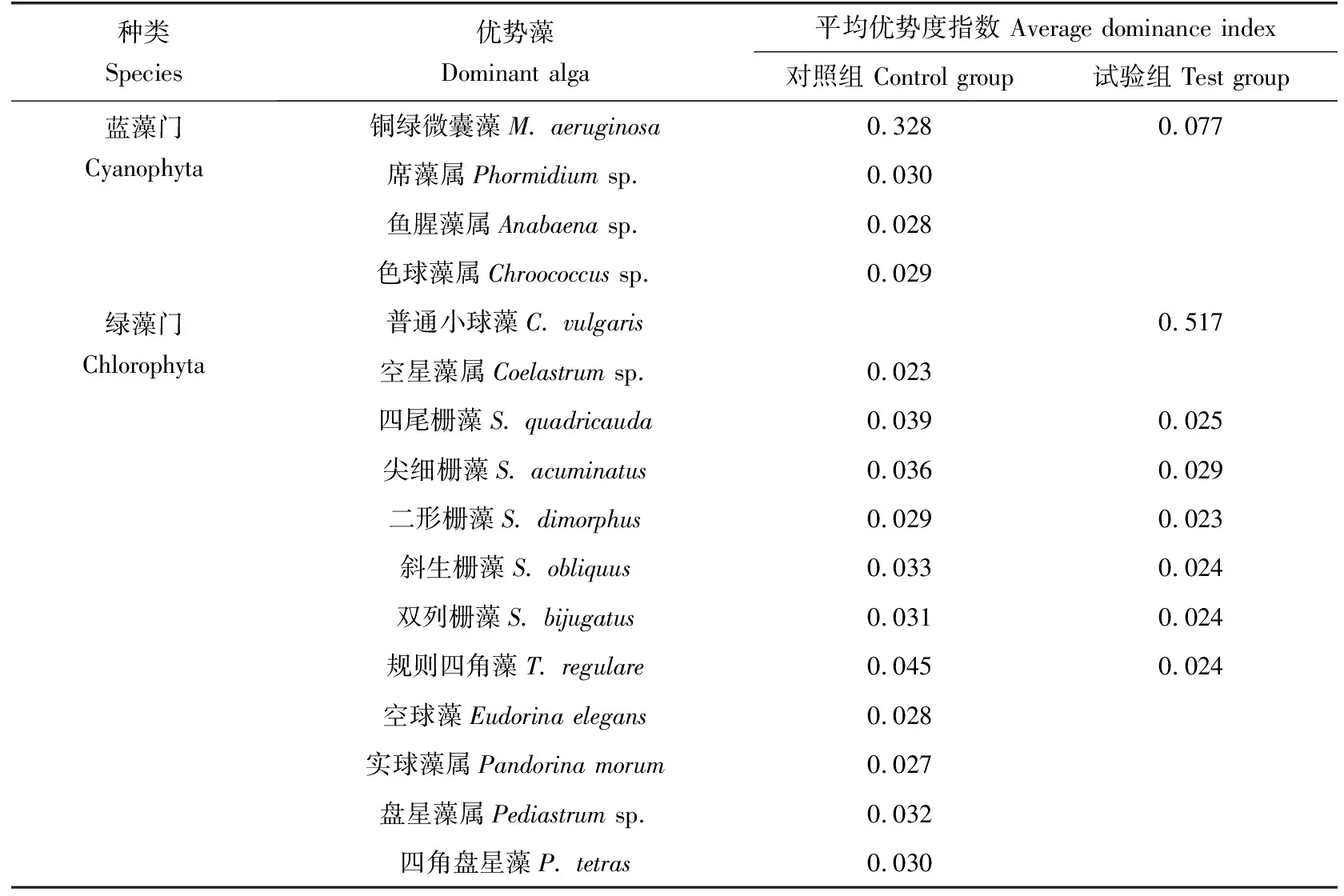
表1 两口池塘不同采样时间微藻优势度变化
2.1.2 微藻群落结构变化
两口池塘微藻群落聚类分析图和相应的非度量多维标度排序图一致(图2),且胁强系数均小于0.1,聚类排序可靠。对照组、试验组微藻群落在试验期间依据密度变化均分成3个集群,其中试验组与对照组相比,绿藻门微藻群落结构变化较大,分组有明显差异,且试验组Bray-Curtis相似性(70%)高于对照组(60%),说明接种小球藻后微藻群落结构变化稳定、连续性更好。
对两口池塘全部微藻种类在时间梯度上进行单因素方差分析,结果表明,两次调查的不同聚类组间均存在显著性差异(对照组:R=0.988,P<0.05;试验组:R=0.66,P<0.05)。相似性百分比分析表明,以85%的相似性将对照组微藻群落分为2组,A组为试验后3次采样,B组为试验前6次采样。以85%的相似性将试验组微藻群落分为2组,C组为试验后3次采样,D组为试验前6次采样。
A组平均相似性为90.63%,主要贡献物种为铜绿微囊藻(26.63%)、其余各物种贡献率均低于5%。B组平均相似性为90.15%,无主要贡献物种,各物种贡献率均低于5%。C组平均相似性为91.90%,主要贡献物种为普通小球藻(19.10%)、铜绿微囊藻(9.64%),其余各物种贡献率均低于5%。D组平均相似性为89.36%,主要贡献物种为普通小球藻(13.36%),各物种贡献率均低于5%。试验结果表明,池塘接种普通小球藻后,对微藻群落结构变化有显著影响,表现为铜绿微囊藻的贡献率显著下降,普通小球藻贡献率显著上升。
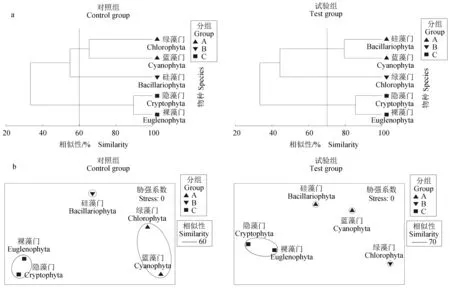
图2 两口池塘微藻群落聚类分析(a)和多维尺度排序分析(b)Fig.2 Cluster (a) and multi-dimensional scale sequencing (b) of microalga communities in two kinds of ponds
2.2 试验组微藻优势种群与环境因子关系
利用CANOCO 4.5对接种普通小球藻的试验组微藻优势类群密度先进行去趋势对应分析,以检验其第1轴的梯度长,其结果为0.757,因此选择冗余分析进行约束性排序。环境因子对试验组微藻优势类群1、2轴共解释量分别为98.8%、94.5%(表2),这表明微藻优势类群密度与环境因子之间的关系基本得到全面解释。
由表2、图3可见,经蒙特卡罗检验后,试验组微藻优势类群密度与水温、pH、溶解氧质量浓度密切相关,与氧化还原电位、透明度相关程度弱,其中水温、pH、溶解氧对试验组密度变化均有显著影响(P<0.01),其余两种环境因子对密度变化影响较差。
2.3 试验对亚硝态氮、氨氮的影响
对照组亚硝态氮质量浓度在试验期间整体呈上升趋势,其平均值为0.055 mg/L,试验组亚硝态氮质量浓度在试验期间整体呈先降后升的趋势,其平均值为0.029 mg/L(表3、图4)。对照组氨氮质量浓度在试验期间整体呈上升趋势,其平均值为0.531 mg/L,试验组氨氮质量浓度在试验期间整体呈先降后升的趋势,其平均值为0.296 mg/L。试验组较对照组亚硝态氮、氨氮质量浓度均表现出显著下降的趋势(表3、图4)。
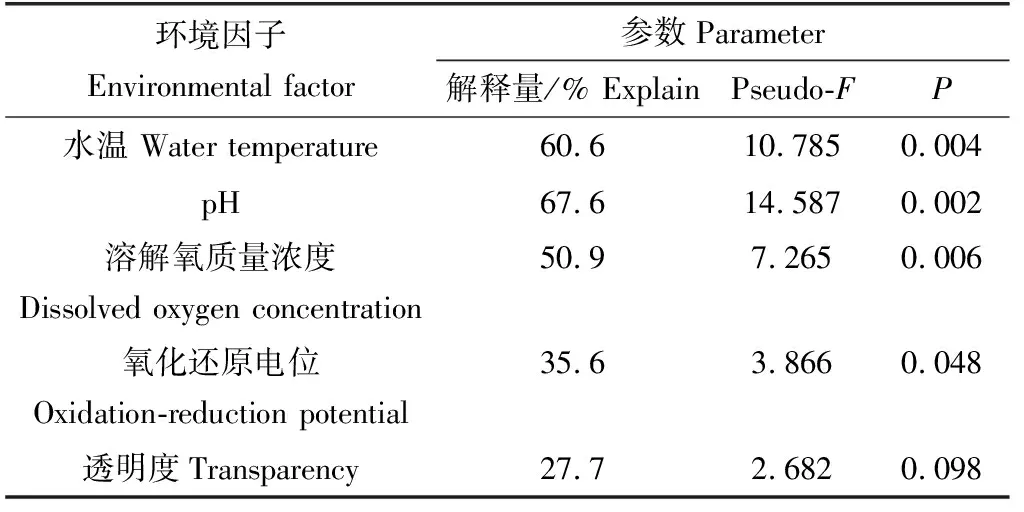
表2 蒙特卡罗检验环境因子相关系数
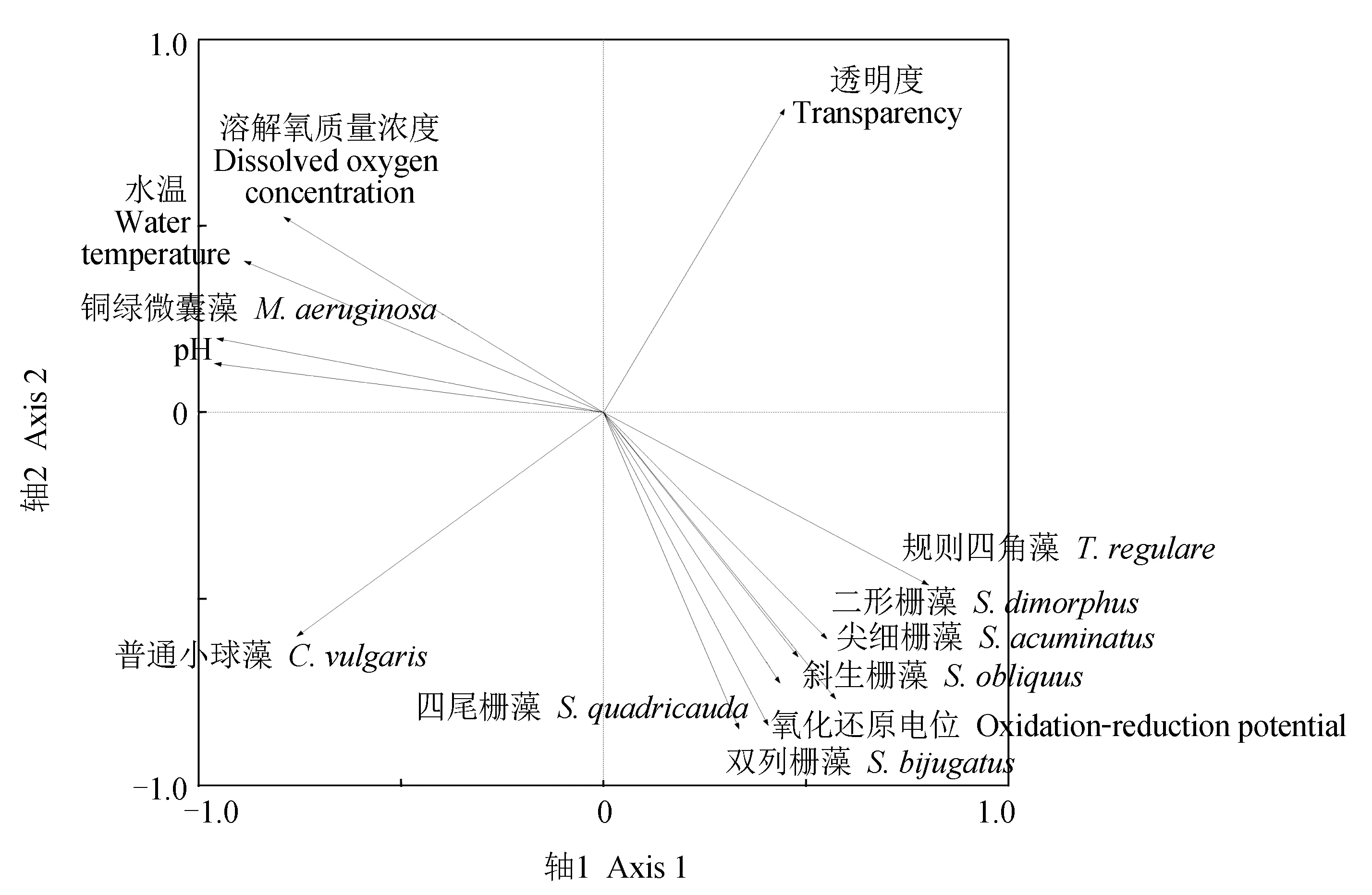
图3 微藻优势类群密度与环境因子冗余分析排序Fig.3 Redundancy analysis of ranking of dominant microalgae group density and environmental factor
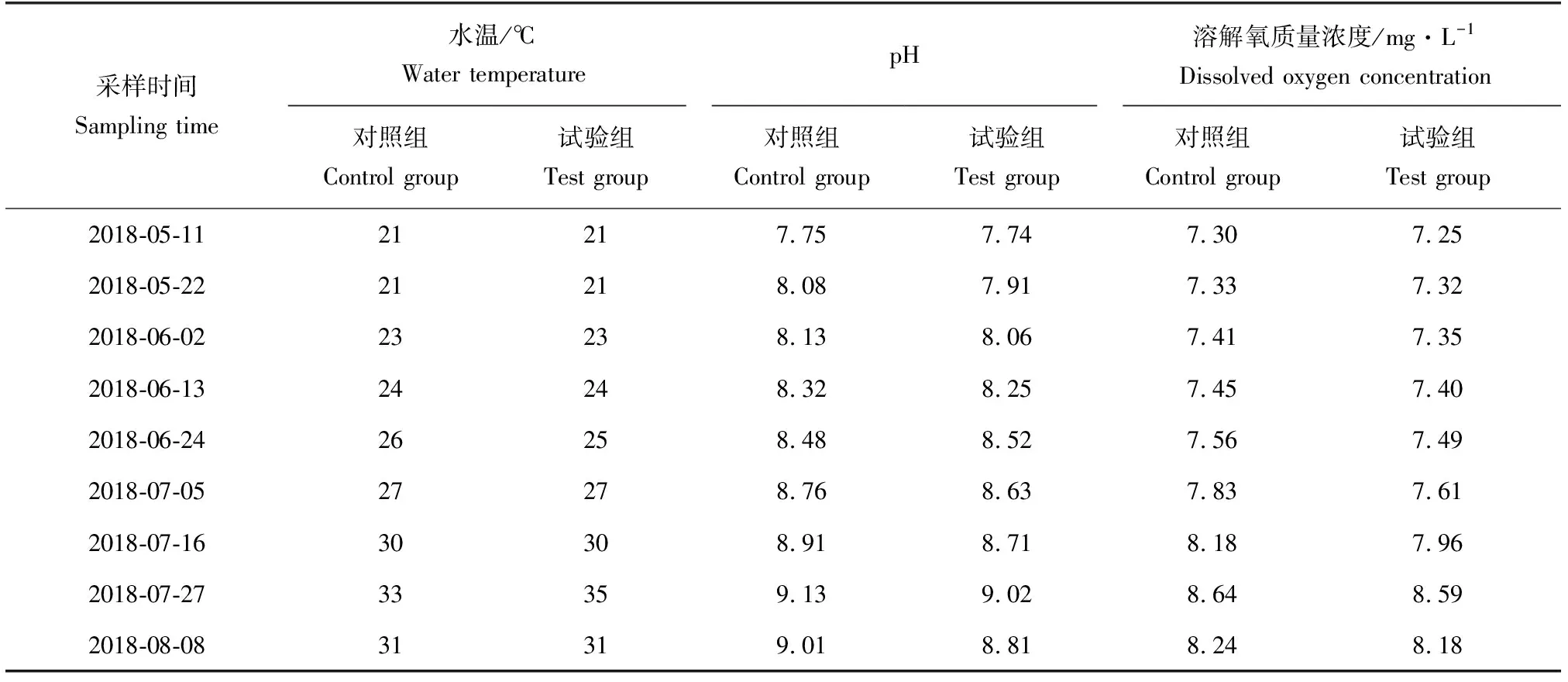
表3 试验期间环境因子的变化
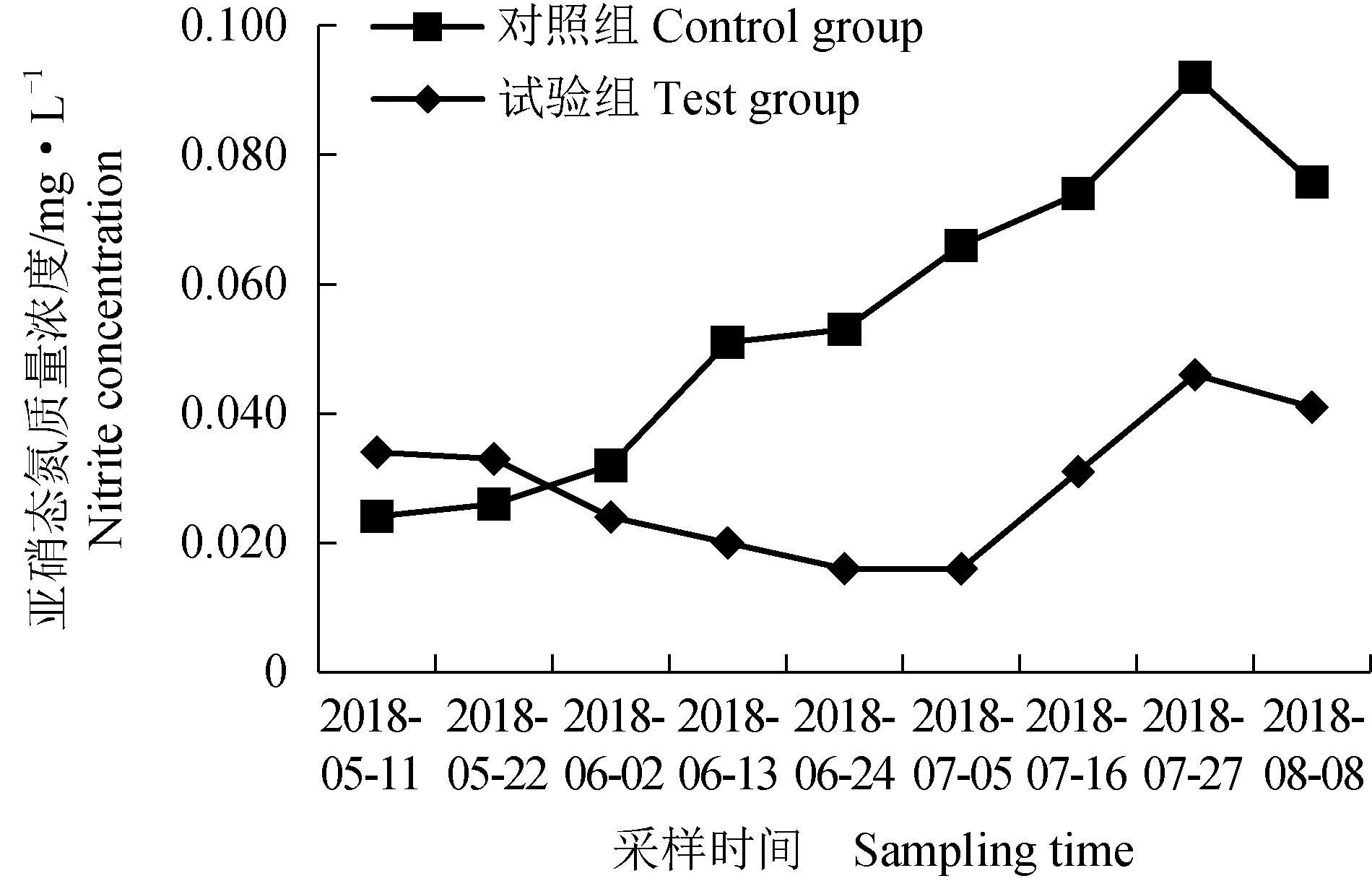
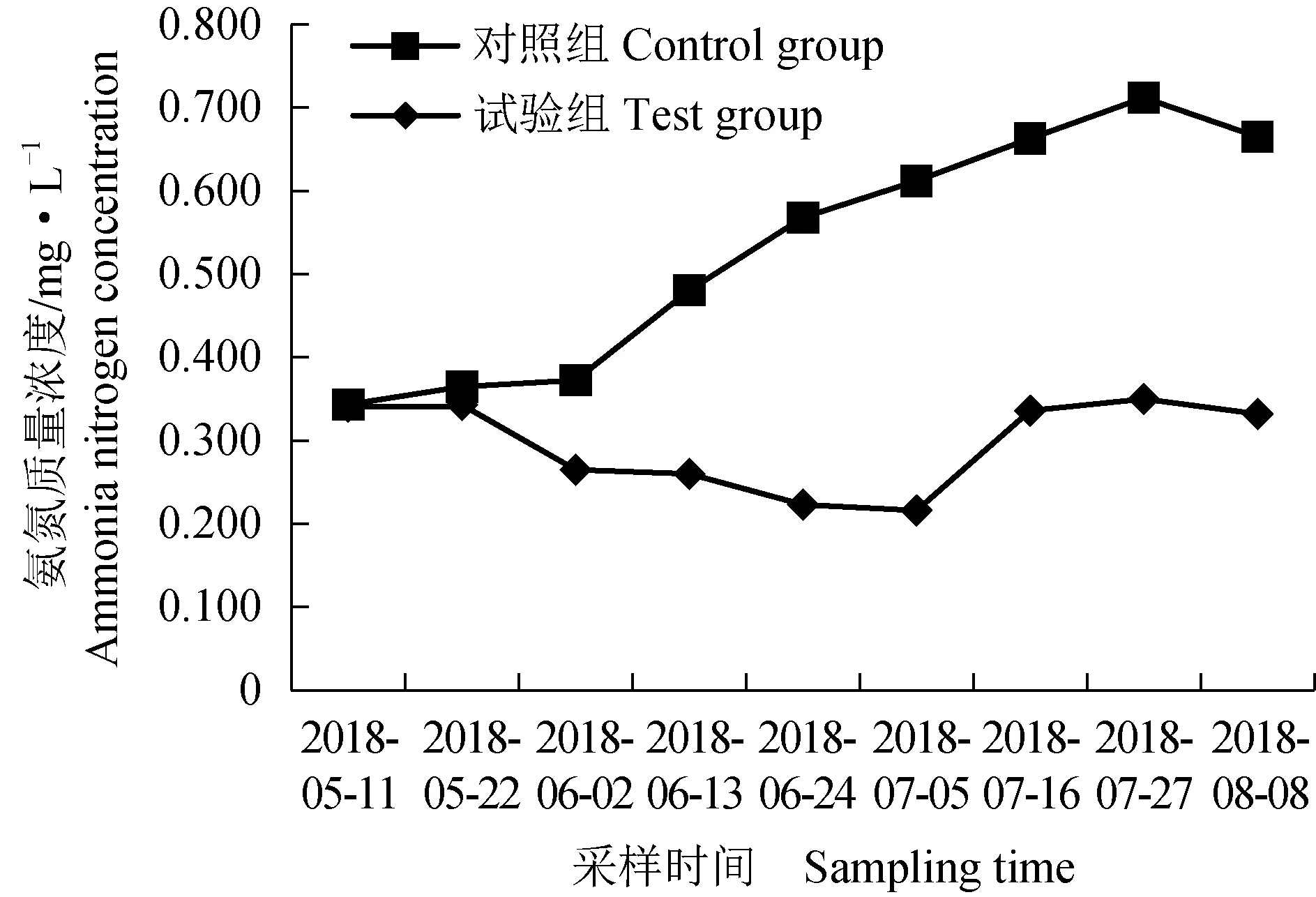
图4 2种池塘亚硝态氮、氨氮质量浓度变化Fig.4 Changes in nitrite and ammonia nitrogen levels in two kinds of ponds
3 讨 论
3.1 接种普通小球藻对微藻群落结构的影响
微藻作为水生态系统中重要的初级生产者,是生态系统稳定的基础[21]。本试验建立在封闭水体的基础上,一定程度上减少了水动力学特征、水文动态、透明度等对微藻群落结构的影响,为探究接种普通小球藻后池塘微藻群落结构的变化建立了优势。从物种数量来看,试验组较对照组种类数多5%,两池绿藻门生物均占总种类60%以上,这与张瑜斌等[22]的研究结果——对虾池塘中微藻群落以绿藻门的种类最多一致。从密度变化来看,试验组较对照组蓝藻门生物平均密度比例下降了76.32%、绿藻门生物平均密度比例上升了70.32%,再结合群落结构分析发现,接种普通小球藻后微藻群落结构变化稳定、连续性更好,且铜绿微囊藻的贡献率显著下降,普通小球藻贡献率显著上升。表明接种普通小球藻后显著抑制了铜绿微囊藻的生长,这与朱为菊[11]的研究结果——普通小球藻对微囊藻生长具有显著抑制作用一致。有研究表明,虾池接种普通小球藻后,改变了水体藻类的组成、数量和比例[13],是接种普通小球藻对微藻群落组成和数量有积极影响的表现。
3.2 接种普通小球藻与环境因子互作关系
养殖池塘是一个相对封闭的生态系统,不同的浮游植物有不同的最适生长环境[23],尤其以环境理化因子与浮游植物种类和数量的关系最为密切[24],一般认为水体营养盐[25]、温度[26]、溶解氧浓度[27]等环境因子可以直接影响浮游植物的群落组成、细胞密度、生命周期及分布等[28]。胡长玉等[29-31]研究发现,不同流域、不同水体类型中,影响浮游植物群落结构的环境因子具有一定的差异性。本试验中,温度、pH、溶解氧质量浓度对试验组微藻密度变化均有显著影响(P<0.01),其余两种环境因子对密度变化影响较差。可见温度、pH、溶解氧质量浓度是影响接种普通小球藻对虾池塘浮游植物的主要环境因子,结合亚硝态氮及氨氮质量浓度的变化可知,接种普通小球藻的对虾池塘较未接种普通小球藻的对虾池塘亚硝态氮和氨氮平均质量浓度在时空尺度内分别下降了47.27%、44.26%,这与刘梅等[32]的研究结果——小球藻以及衣藻、隐藻等其他藻类均能显著降低水体中氨氮和亚硝态氮质量浓度相符,但未达到张继平等[33]的研究结果——小球藻能显著降低水体中亚硝态氮的含量及最高降解率达75.6%的程度,这可能与小球藻的接种密度不够有关。
虽然普通小球藻显著抑制了铜绿微囊藻的生长,但微囊藻的缓慢生长说明蓝藻仍然会有负面影响,蓝藻不但影响了池塘内浮游植物的生长也影响了理化因子对浮游植物群落的调控作用。夏季蓝藻暴发产生大量的微囊藻毒素[34],Sedmak等[35]研究发现,微囊藻毒素参与浮游植物的种群调节,可调控藻类的增殖。微囊藻毒素正是通过抑制藻类的光合系统PS Ⅱ活性从而使两池内浮游植物藻类生长受到阻碍。微囊藻毒素也会对理化因子造成影响。苏发文等[36]在微囊藻和普通小球藻对水环境pH的研究中发现,温度在25 ℃以上微囊藻抑制pH的升高,而普通小球藻会促进pH的升高。但本试验中,两池pH均偏高,一方面可能是由于试验用水为对虾养殖池塘水,另一方面可能是接种普通小球藻后,在铜绿微囊藻与普通小球藻的共同作用下导致池塘内的环境理化因子升降趋势不明显。
本试验结果表明,接种普通小球藻不仅对浮游植物群落结构产生影响,也会抑制环境理化因子的失控,降低亚硝态氮、氨氮等有害水质因子的质量浓度。由于普通小球藻的生长周期一般为10 d,且小球藻昼夜迁移时,0:00—8:00分裂增殖缓慢,8:00—12:00迅速生长,12:00—24:00缓慢生长,因此笔者建议接种频率为1次/10 d,接种时间为8:00,此条件下接种普通小球藻效果最佳。但仍需对接种小球藻的密度以及采样频率进行试验优化,进一步找到小球藻的最适接种密度,以便为合理控制环境因子调控凡纳滨对虾养殖池塘提供参考。
4 结 论
(1)接种普通小球藻后凡纳滨对虾养殖池塘浮游植物种类数增加、铜绿微囊藻的贡献率显著下降,普通小球藻贡献率显著上升,使池塘浮游植物群落结构更稳定,接种普通小球藻对浮游植物群落组成和数量有积极影响。
(2)冗余分析表明,接种小球藻的对虾池塘浮游植物受温度、pH、溶解氧影响(P<0.01),是调控浮游植物的环境因子,再结合亚硝态氮、氨氮的去除效应,建议接种频率为1次/10 d,接种时间为8:00,此条件下接种普通小球藻效果最佳。
(3)试验应进一步研究在不同接种小球藻密度下,对持续接种小球藻去除亚硝态氮及氮磷的效应机制,并分别在日间和夜间监测以得到更完善的研究成果。
