JAG1影响血管生成并促进三阴性乳腺癌细胞的迁移、侵袭和粘附
2022-07-18刘俊平石宇彤吴敏敏徐梦岐张凤梅何志强
三阴性乳腺癌(TNBC)患者得益于早期筛查和联合治疗,5年生存率得到了显著提高,但由于TNBC与其他类型乳腺癌相比,其更容易发生侵袭、转移和复发,且不能从内分泌或分子靶向治疗中获益,四期TNBC患者的5年生存率仅为28%左右。TNBC较高的血管密度为肿瘤生长提供大量的营养物质,从而促进其恶性进展和侵袭转移,因此靶向血管生成可能是其治疗的突破口之一。目前TNBC抗血管治疗主要以血管内皮细胞生长因子(VEGF)信号通路为靶点,代表药物有贝伐单抗、阿帕替尼等,但临床试验显示,用药后TNBC患者的总生存期(OS)无明显改善,并且由于替代性促血管生成因子的上调,耐药也成为抗血管治疗的重要挑战。关于肿瘤血管生成,目前较为明确的是VEGF和DLL4/Notch1信号通路。Notch信号在进化过程中较为保守,几乎在所有器官中表达,协调细胞增殖、分化和凋亡,决定细胞命运;其有4个受体(Notch1,Notch2,Notch3,Notch4)和5 个配体(JAG1,JAG2,DLL1,DLL3,DLL4,与乳腺癌的发生发展关系已经得到证实,但不同配体和受体其的作用具有一定异质性,比如JAG1与乳腺癌的骨转移和不良预后相关;缺氧诱导的JAG2可以促进乳腺癌转移和干细胞的自我更新;DLL1通过影响细胞增殖和血管生成来促进管腔型乳腺癌的肿瘤生长和转移,并且DLL1与乳腺癌化疗耐药有关;DLL4 在乳腺癌细胞中也过表达,并与淋巴结和远处转移有关。众所周知,Notch1在乳腺癌中主要作为癌基因发挥作用,而Notch2 在乳腺癌中的具体作用仍然不明确。Notch 3通过抑制乳腺癌的EMT从而抑制肺转移,但是也有功能研究证明Notch 3可以促进基底乳腺癌的生长,表现出促癌作用;Notch 4 可以触发与乳腺癌转移和复发相关的EMT过程。不同Notch分子发挥着不同的功能,因此需要系统研究Notch信号在乳腺癌中的作用。
现有的研究显示,DLL4-Notch1也参与了肿瘤血管生成,但Notch信号通路中的其他配体,比如JAG1等,在肿瘤血管生成中的研究较少,而JAG1与乳腺癌血管生成的关系尚未还未见报道。因此,本研究拟通过体内外实验明确JAG1对TNBC增殖、迁移、侵袭等生物学功能的影响,初步研究JAG1对TNBC微环境血管生成的影响,探讨其是否能成为TNBC的诊疗新靶点。
1 材料和方法
1.1 材料
人正常乳腺上皮细胞MCF-10a、TNBC细胞MDAMB-231(231)、侵袭性TNBC 细胞MDA-MB-231-B(231B)以及人脐静脉内皮细胞(HUVEC)保存于重庆医科大学临床检验诊断学教育部重点实验室。JAG1重组蛋白(rJAG1)及DAPT(MedChemExpress);胎牛血清(BS)、青霉素、链霉素(S110JV)和DMEM高糖培养基(上海源培生物);MCF-10a细胞专用培养基(武汉普诺赛);基质胶(matrilgel matrix 356234)及Transwell小室(康宁);RNA快速提取试剂盒(ES-RN001)(上海奕杉生物科技);RT-PCR及Q-PCR 相关试剂(TaKaRa);蛋白质提取与定量试剂、Western blot相关试剂、DAPI、Hoechst染色试剂盒及HE染色试剂盒均(上海碧云天);ECL 发光液(Millipore);鼠抗人β-actin 抗体(钟鼎生物);兔抗人JAG1、Twist1、Snail、Cyclin-B1、Cyclin-E、Bcl-2、VEGFA、CD31 抗体(沈阳万类生物科技);兔抗人ERK及p-ERK抗体(Abcam);小鼠SP试剂盒,兔SP试剂盒,二抗(山羊抗鼠IgG/HRP标记,山羊抗兔IgG/HRP标记)(中杉金桥);兔抗人FITC荧光二抗(proteintech);Q-PCR引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 细胞培养 MCF-10a正常乳腺上皮细胞用专用培养基培养,231、231B和HUVEC用含1000 U/mL青霉素、100 mg/mL链霉素和100 mL/L FBS的DMEM培养基培养,并静置于37 ℃、50 mL/L CO的培养箱。细胞用2.5 g/L的胰蛋白酶消化传代。处于对数生长期的细胞用于实验。
1.2.2 细胞处理及分组 231和231B细胞生长至对数生长期后,胰蛋白酶消化1 min,传代接种于20 cm的培养皿内(1×10),待细胞长至50%~60%的汇合度。弃去原培养基,每个培养皿加入2 mL新鲜培养基。rJAG1以50 ng/mL的量加入231细胞培养皿,DAPT以50 μmol/L的浓度处理231B细胞。TNBC实验细胞分为4组:(1)231 空白对照组(231-Blank);(2)rJAG1 处理231 组(231-rJAG1);(3)231B空白对照组(231B-Blank);(4)DAPT处理231B组(231B-DAPT)。轻轻晃动混匀后放孵箱培养24~48 h,用于细胞功能实验。收集上述各组乳腺癌细胞条件培养基(CM)用于后续血管实验。以CM:新鲜培养基=1∶1的比例处理HUVEC细胞24~48 h后,进行后续处理。血管生成实验细胞分为5组:(1)HUVEC细胞阴性对照组(NC);(2)231空白条件培养基处理组(231-Blank-CM);(3)rJAG1处理231的条件培养基处理组(231-rJAG1-CM);(4)231B空白条件培养基处理组(231B-Blank-CM);(5)DAPT处理231B的条件培养基处理组(231B-DAPT-CM)。
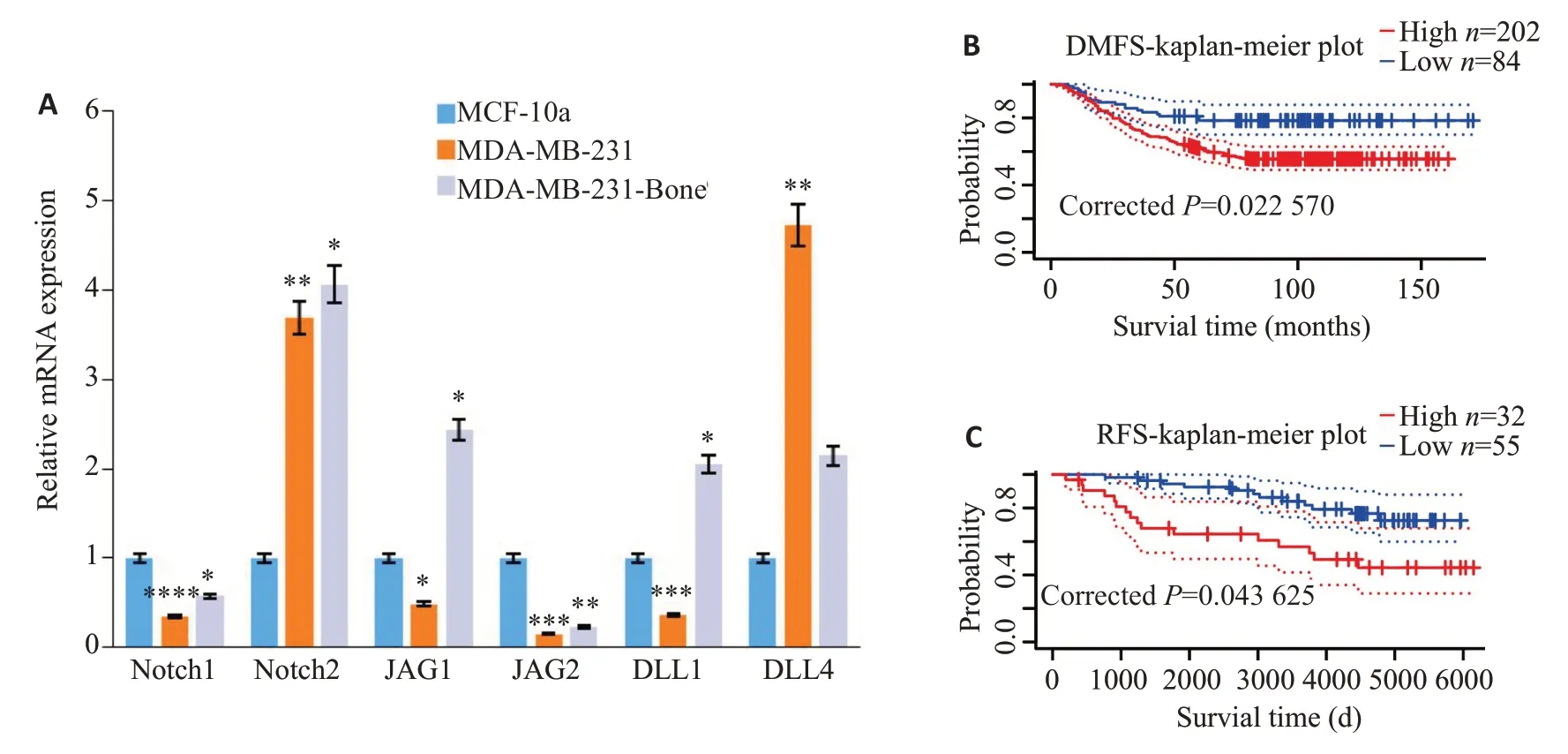
通过Q-PCR 实验筛查Notch 信号通路相关分子(Notch1、Notch2、JAG1、JAG2、DLL1、DLL4)发现,231细胞的JAG1 表达低于MCF-10a 正常乳腺上皮细胞(<0.05),同时,231B 细胞的JAG1 表达高于231(<0.05)和MCF-10a(<0.05)(图1A),DLL1的表达情况和JAG1一致。PrognoScan数据库分析JAG1对乳腺癌患者无远处转移生存率(DMFS)和无复发生存率(RFS)。发现JAG1高表达的乳腺癌患者有相对较差的DMFS(图1B)和RFS(图1C)。

1.2.4 Western blot 法检测231、231B乳腺癌细胞Actin、JAG1、Twist1、Snail、Cyclin-B1、Cyclin-E及Bcl-2蛋白表达 231乳腺癌株用rJAG1处理24~48 h和231B侵袭性乳腺癌细胞株用DAPT处理24~48 h后,收集细胞,使用RIPA裂解后提取总蛋白,并使用BCA法测其浓度。取35 μg蛋白质经10%的SDS-PAGE分离(90 V 30 min,120 V 60 min),210 mA恒流冰浴条件下将蛋白质湿转到PVDF膜上,用50 g/L的牛血清白蛋白于37 ℃摇床上封闭2 h,4 ℃条件下一抗孵育过夜,Actin、JAG1、Twist1、Snail、Cyclin-B1、Cyclin-E及Bcl-2 的抗体使用一抗稀释液以1∶1000稀释。TBST洗膜10 min×3次,分别加入HRP标记的1∶5000稀释的山羊抗兔IgG或HRP 标记的1∶5000 稀释的山羊抗小鼠IgG,37 ℃孵育1 h,TBST洗膜10 min×3 次,ECL发光液显影并统计。
风影还想红琴,想她为什么要在林子里挂一根红腰带,带子挂到树枝上了,她还拿什么去系裤子,没有带子系裤子,万一掉下来怎么办?他的脸忽然红了。他又去想那红腰带上的结,为什么要打结,为什么要打七七四十九个,如果打一千个结的话,绳子短了没法再打怎么办?他忽然又笑了,打一千个结,那要打到猴年马月?难道要打到自己变成像师父那样的老和尚么?难道要打到红琴变成白发苍苍的老太婆么?那就早点瞅个机会下山去吧,让她早点打完七七四十九个结。对了,这次下山千万别忘了带上那支竹笛,她喜欢听就吹给她听呗。
各实验均独立重复3次后,用GraphPad Prism 6进行数据分析。实验数据用均数±标准差表示,多组间比较采用单因素方差分析,组内差异采用Tukey检验。以<0.05为差异具有统计学意义。
玉米品比试验采用间比法排列,不设重复,每6个品种设置1个对照品种,4行区,小区面积20平方米。同一排首、末小区必须是对照品种,并设不少于4行的保护区。测产时收取小区中间2行(面积10平方米)全部果穗,风干脱粒后称籽粒重量,测含水量,折成14%水分计产。
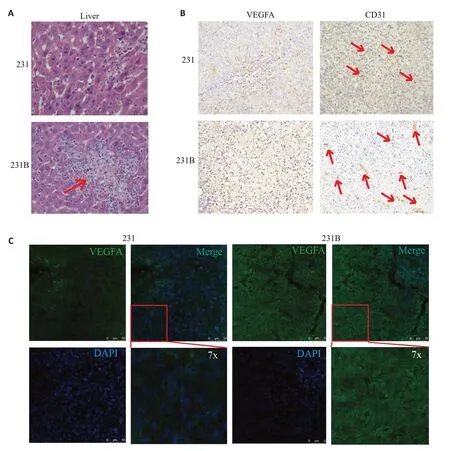
HE染色裸鼠肝脏组织,接种231B细胞的裸鼠较231表现出更强的肝脏转移(图2A),肝脏转移常常伴随着大量新生血管的形成,为肿瘤细胞的定植提供营养。免疫组化实验结果显示231B肿瘤比231肿瘤表达更高的VEGFA,且CD31标记的血管数量也更多(红色箭头所示)(图2B)。免疫荧光染色实验同样表明231B肿瘤较231肿瘤表达更高的VEGFA(图2C)。
1.2.9 基质胶血管形成实验检测TNBC微环境对血管生成的影响 96孔板加入基质胶50 μL/孔,随后将96孔板置于37 ℃孵箱45 min。胰蛋白酶消化HUVEC后,使用231和231B的条件培养基重悬细胞,加入50 μL 3×10细胞至上述96孔板内,放入37 ℃孵箱,4~6 h后倒置显微镜下观察血管形成情况,并对血管节点数进行统计量化。
1.2.6 Wound healing实验检测JAG1和DAPT对TNBC细胞迁移的影响 将231和231B细胞传至6孔板(3.0×10/孔),待细胞长满孔板,使用10 μL 的枪头垂直于孔板对细胞划一条直线,PBS洗去漂浮细胞。每孔加入2 mL不含血清的DMEM培养基,其中231-rJAG1组加入50 ng/mL 的rJAG1,231B-DAPT 组加入50 μmol/L的DAPT。显微镜下拍摄0、24和48 h同一位置的划痕图片。平均划痕愈合率的计算采用以下公式:(0 h划痕宽度-24 h 划痕宽度)/0 h划痕宽度和(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度,其中划痕宽度利用AI软件分析得到。
由2.1节介绍可以看出,不论是哪种传统的交叉方法都是随机选则父代中的交叉位置,这样容易破坏父代种群的优良基因,且易造成局部收敛。本文利用蚁群算法的正反馈机制,将染色体等分为若干个区间,并给每个区间添加信息素。由此可以得到信息素与适应度之间的公式为:
1.2.8 内皮细胞粘附实验检测JAG1对231细胞粘附的影响 各组231和231B细胞使用GFP病毒转染,24 h后细胞90%以上细胞被转染上GFP绿色荧光蛋白,添加rJAG1/DAPT 条件处理24 h。胰蛋白酶消化HUVEC细胞至24 孔板,待HUVEC 长至满视野后,消化各组乳腺癌细胞,加入3×10/孔231和231B细胞至上述24孔板,随后将24孔板置于37 ℃孵箱1 h。PBS洗去未贴壁细胞,荧光显微镜下观察贴在HUVEC表面的231和231B乳腺癌细胞数量,贴壁细胞使用Image J 软件计数。
1.2.10 免疫组化和免疫荧光实验检测肿瘤VEGFA和CD31表达雌性裸鼠分为231组(5只,乳腺脂肪垫注射231 细胞1×10/只)和231B 组(5 只,乳腺脂肪垫注射231B细胞1×10/只)。4~6周后取出肿瘤保存于4%多聚甲醛溶液。对肿瘤组织行石蜡切片后,进行免疫组化染色,VEGFA和CD31使用一抗稀释液以1∶200稀释,更多步骤参考中杉金桥小鼠SP试剂盒说明书,倒置显微镜观察VEGFA和CD31表达并拍照。免疫荧光实验中,对组织行冰冻切片,4%多聚甲醛固定15 min,50g/L山羊血清室温封闭1 h,PBS洗3 min×2次,1∶200稀释的VEGFA一抗4 ℃冰箱孵育过夜。荧光二抗室温孵育1 h,PBS洗3 min×2次,DAPI染色10 min,激光共聚焦显微镜下观察绿色荧光表达强度并拍照。HE 染色检测TNBC肝脏转移灶,具体实验步骤参考碧云天HE染色试剂盒说明书,普通光学显微镜观察并拍照。所有涉及动物的实验操作均按照《实验动物护理和使用指南》进行,并经重庆医科大学伦理委员会(2021-023)批准。
1.3 统计分析
1.2.5 CCK-8法检测JAG1和DAPT对TNBC细胞增殖的影响 将231 和231B 细胞传入96 孔板培养(3000/孔),其中231-rJAG1组加入50 ng/mL的rJAG1,231BDAPT 组加入50 μmol/L 的DAPT,每组设置5 个孔,37 ℃孵箱培养0、24、48、72 h后,每孔加入10 μLCCK-8试剂,37 ℃孵育1h 后酶标仪测其的光密度()。Hoechst染色实验检测JAG1和DAPT对TNBC细胞凋亡的影响。24孔板每孔3×10个231和231B细胞,接受处理24 h后,加入4%多聚甲醛固定15 min,PBS洗3 min×2次。加入500 μL/孔Hoechst 33258染色液,染色5 min,PBS洗3 min×2次。荧光显微镜检测呈蓝色的细胞核。
2 结果
2.1 JAG1与TNBC的恶性程度和不良预后相关
1.2.3 实时荧光定量PCR检测MCF-10a正常乳腺上皮细胞和231、231B乳腺癌细胞中JAG1的表达 细胞中总RNA用RNA快提试剂盒提取,并用紫外分光光度计测其浓度和纯度。取1 μg RNA逆转成cDNA,利用实时荧光定量PCR 检测并分析Notch1、Notch2、JAG1、JAG2、DLL1、DLL4、VEGFA和GAPDH的相对表达水平,其中GAPDH作为内参对照。引物序列见表1。
2.2 动物实验证明高表达JAG1的231侵袭细胞株表达更高的VEGFA和CD31
1.2.7 Transwell小室实验检测JAG1和DAPT对TNBC细胞侵袭的影响 为了检测231和231B乳腺癌细胞的侵袭性,将Transwell小室放入24孔板,上室加入1∶10无血清培养基稀释的基质胶50 μL,随后将24孔板置于37 ℃孵箱1 h。胰蛋白酶消化细胞后用双无培养基重悬,上室加入200 μL 含3×10细胞的悬液,下室加入500 μL含10%血清的培养基,37 ℃孵箱培养24 h后,取出上室,4%多聚甲醛固定15 min,0.05%结晶紫染色或DAPI染色10 min,棉签轻轻擦拭掉小室上方细胞,干燥后在倒置显微镜(结晶紫染色)和荧光显微镜(DAPI染色)下观察侵袭到小室下方的细胞数量。
司马迁生年迄无确认,最有代表性的有两说,即以李长之先生《司马迁生年为建元六年辨》及郭沫若先生《〈太史公行年考〉有问题》为代表的生于汉武帝建元六年(前135)说,和以王国维先生《太史公行年考》及钱穆先生《司马迁生年考》为代表的生于汉景帝中五年(前145)说,两说各执其辞,争论将近一个世纪。本文拟对此问题作一分析。
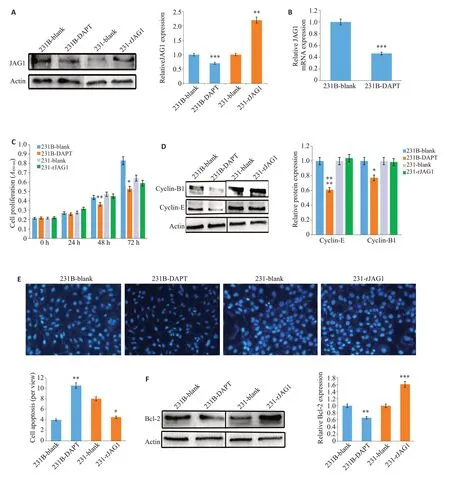
2.3 JAG1通过抑制凋亡影响TNBC的数量
WB实验结果显示,JAG1重组蛋白可以促进231的JAG1蛋白水平(<0.01),而DAPT可以抑制231B的JAG1蛋白表达(<0.001,图3A)。Q-PCR实验结果表明DAPT可以抑制JAG1的基因表达水平(<0.01,图3B)。CCK-8实验结果显示,JAG1对231乳腺癌细胞的增殖没有显著影响(>0.05),而DAPT处理231B细胞72 h后,其活力明显受到了抑制(<0.05,图3C)。Western Blot实验检测231和231B增殖相关蛋白显示,JAG1不影响231的Cyclin-B1和Cyclin-E表达,而DAPT可以显著抑制231B 的Cyclin-B1(<0.0001)和Cyclin-E(<0.05)的蛋白表达(图3D)。Hoechst染色结果显示(图3E),231细胞经过rJAG1处理后,细胞凋亡出现了明显的减弱,231空白对照组细胞凋亡数为8.0±0.9个/视野,rJAG1 处理组细胞凋亡数为4.5±0.6 个/视野,rJAG1处理组较空白组凋亡数显著降低(<0.05)。同样,DAPT-231B组的细胞凋亡数为10.5±1.0个/视野,231B 空白对照组的细胞凋亡数为4.0±0.9 个/视野,DAPT 处理组较空白组凋亡数显著升高(<0.01)。Western blot结果同样显示,233细胞经过rJAG1处理后,可上调231细胞中抗凋亡蛋白Bcl-2的水平(<0.05),相反,DAPT 处理231B 细胞则会下调其抗凋亡蛋白Bcl-2的表达(<0.05,图3F)。
随着社会的发展,我国的环保意识不断增强,很多地区的林业建设慢慢成为重要的生产活动,笔者结合从业经验,围绕生态林业建设中林业技术推广存在的问题,阐述了新时期林业技术推广的有效方式,以期为业内人士提供参考。
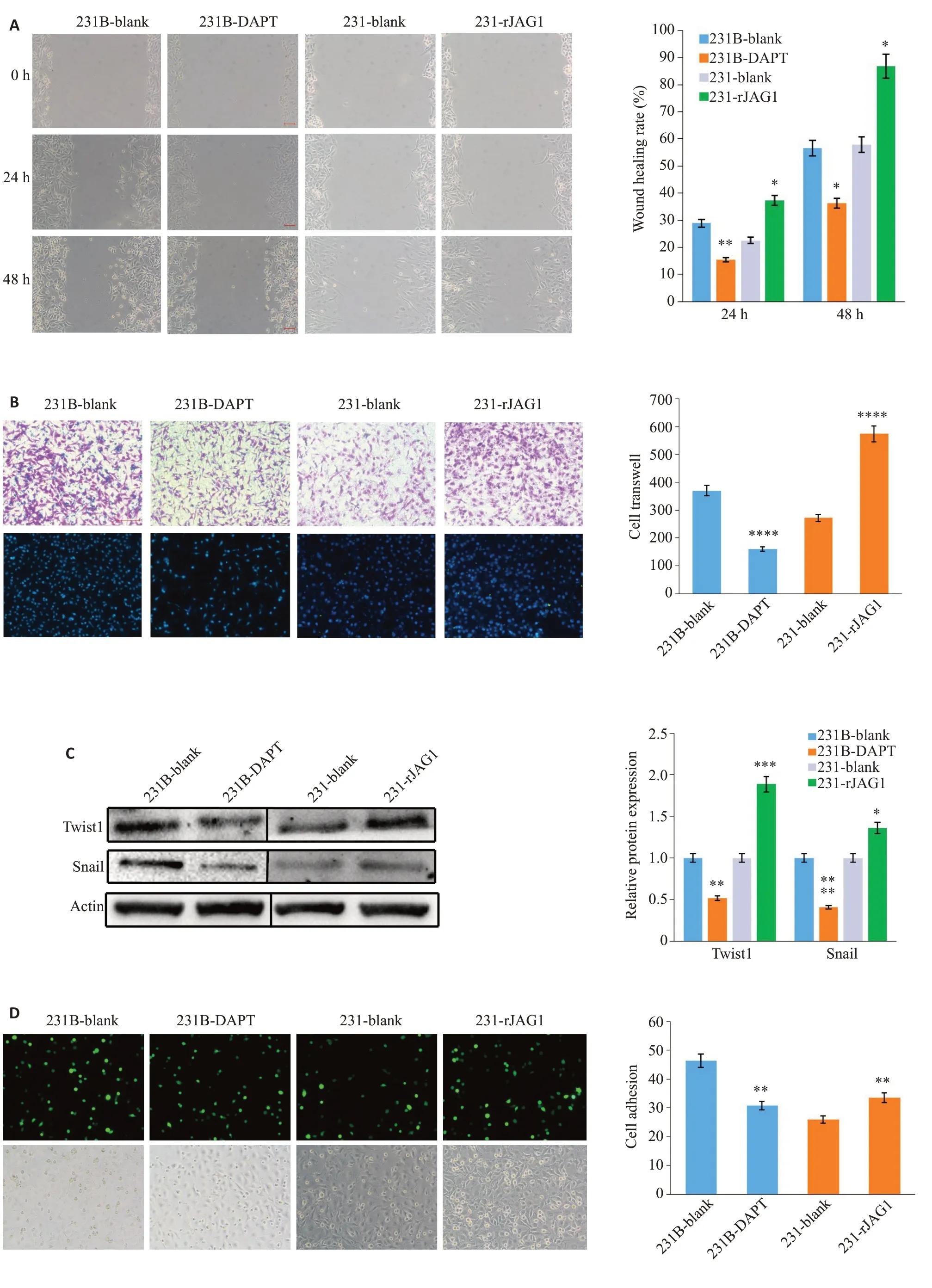
2.4 JAG1促进TNBC的迁移、侵袭及黏附能力
划痕愈合实验结果显示(图4A),在rJAG1处理48 h后,231乳腺癌细胞的迁移受到了明显的促进(<0.05),愈合率为85.95%,而与231空白对照组相比,48 h后231空白对照组的愈合率仅为58.52%。DAPT处理231B乳腺癌细胞后,231B细胞的迁移能力受到了明显的抑制(<0.05),48 h愈合率为36.62%。未加DAPT的231B空白对照组的迁移率为53.31%。使用Transwell小室实验检测rJAG1和DAPT对TNBC细胞侵袭性的影响,在处理24 h后,rJAG1处理组231乳腺癌细胞穿透小室的数量为629个,而231空白对照组穿过了270个细胞;同样使用DAPT 处理231B 细胞后,其穿过的细胞数(154 个)远低于231B 对照组穿过的细胞数(397 个)(图4B)。Western blot实验检测231和231B迁移侵袭相关蛋白显示,JAG1促进了231的Twist1和Snail的蛋白表达,而DAPT可以显著抑制231B的Twist1和Snail的蛋白表达(图4C)。内皮细胞粘附实验表明,DAPT显著(<0.01)抑制了231B细胞对血管内皮细胞的粘附性,而rJAG1显著增加了231乳腺癌细胞的粘附性。
2.5 TNBC的JAG1过表达促进血管生成
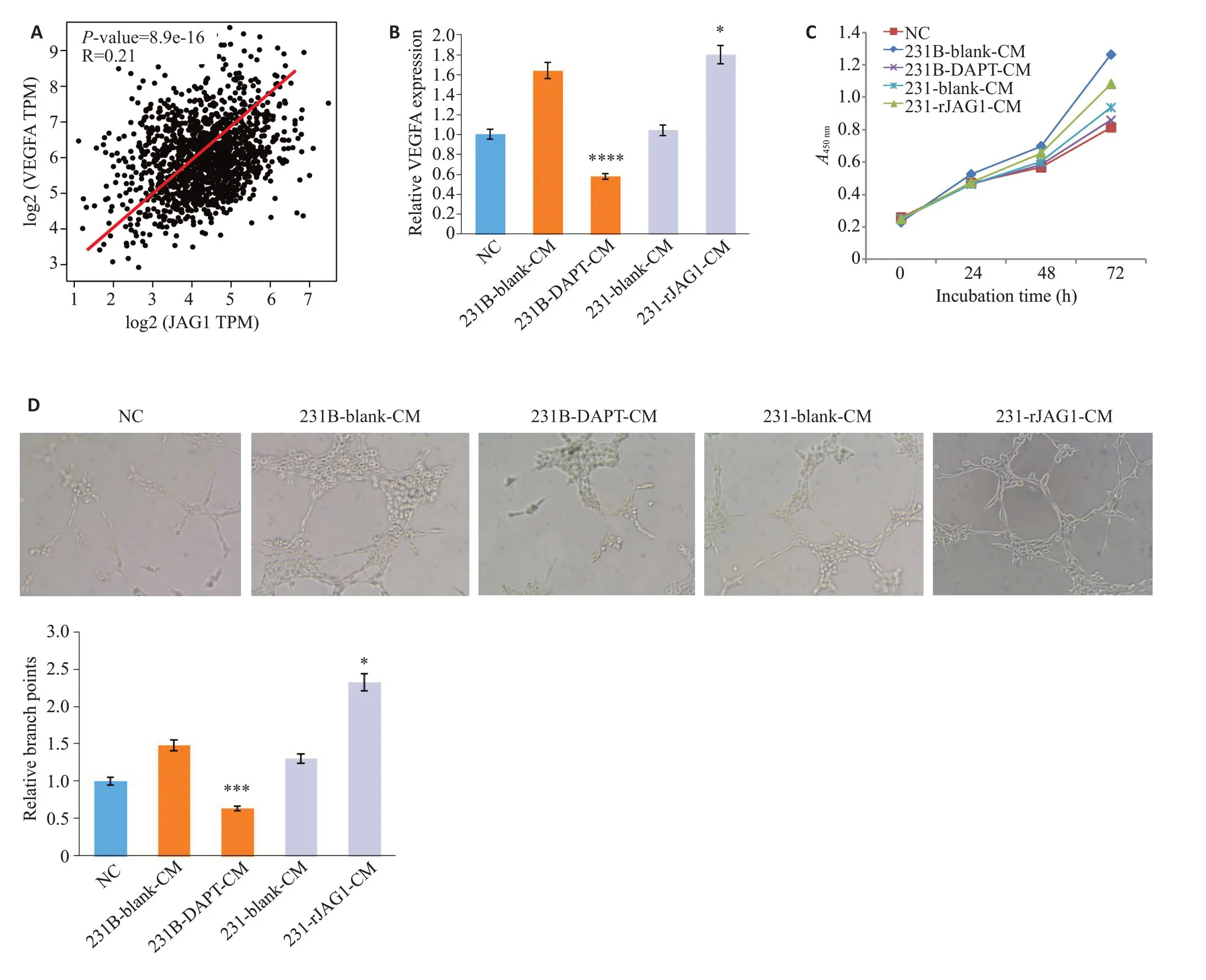
GEPIA数据库分析JAG1与血管生成因子VEGFA的相关性,发现二者成正相关,差异具有显著统计学意义(=8.9e-16,图5A)。在乳腺癌细胞条件培养基处理24~48 h 后,231B-DAPT-CM 组的HUVEC 的VEGFA表达较231B-Blank-CM 组明显受到了抑制(<0.0001),而231-rJAG1-CM组的HUVEC的VEGFA表达较231-Blank-CM 组的VEGFA 表达明显升高(<0.05,图5B)。CCK-8的实验证明,乳腺癌的JAG1过表达可促进HUVEC血管内皮细胞的增殖,DAPT可以抑制这一现象(图5C)。231B条件培养基的促血管生成能力明显强于231的条件培养基(<0.05),并且可以被DAPT抑制(图5D)。
3 讨论
研究显示,乳腺癌已取代肺癌成为全球肿瘤发病率最高的肿瘤,占新发肿瘤的11.7%。虽然针对乳腺癌治疗的方法有了长足的进步,包括手术治疗、放疗、化疗和以免疫检查点抑制剂为代表的免疫治疗,但乳腺癌导致的死亡仍占女性癌症患者死亡原因的1/6,尤其是TNBC。由于TNBC的雌激素受体、孕激素受体和人表皮生长因子受体2(HER2)为阴性,因此患者不能从内分泌或分子靶向治疗中获益;另一方面,研究发现TNBC血管密度高,患者或许能从抗血管治疗中获益,研究显示现有的抗血管生成药物(靶向VEGFVEGFR)的疗效并未达到预期,提示关于TNBC的肿瘤血管生成机制研究至关重要。
综上所述,MRAA-LDA-DAO产前超声具有较典型的超声特征,但是仅根据其3VT切面上的表现,不易与右弓优势型DAA鉴别,而这两种疾病预后完全不同,DAA胎儿因形成完全血管环,左、右弓压迫食管,出生后多会出现相关的临床症状而需手术治疗,而MRAA-LDA-DAO胎儿多无临床症状,不需特殊处理。所以建议在扫查中增加扫升弓部冠状切面,明确主动脉“第一分支”与LDA的关系,明确诊断MRAA-LDA-DAO或者右弓优势型DAA,为围产期咨询和产后及时救治提供更全面可靠的信息。
本研究首先通过实验室研究发现侵袭性强的TNBC细胞株231B中JAG1表达明显增加;JAG1是乳腺癌的预后不良因子之一,与DMFS和RFS显著相关,这一结果与Xue和刘野的临床研究结论一致。进一步裸鼠成瘤实验发现JAG1高表达的231B肿瘤表现出更强的肝脏转移能力,肿瘤组织中血管内皮生长因子VEGFA和血管内皮标志物CD31表达增强。通过生物学功能实验,我们证实JAG1能明显增强231的迁移、侵袭能力,还可通过抑制凋亡促进肿瘤生长,这与Yihong chen等在宫颈癌中的研究一致。内皮细胞粘附实验表明,DAPT显著(<0.01)抑制了231B细胞对血管内皮细胞的粘附性,而rJAG1显著增加了231乳腺癌细胞的粘附性,同样,可以发现侵袭性更强的231B乳腺癌细胞株比普通231细胞株具有更强的黏附性。DAPT可以抑制Notch1、JAG1信号通路的分子表达,本研究中DAPT抑制了231B的生物学功能,由于Notch1在231B中表达低于正常乳腺上皮细胞(<0.05),并且231和231B的Notch1表达没有差异,因此JAG1发挥了促进TNBC侵袭性的功能。
那么JAG1 对TNBC 肿瘤血管生成有什么影响呢?我们通过基因共表达分析发现JAG1与血管内皮生长因子VEGFA成正相关,提示JAG1与VEGFA可能协同促进血管内皮细胞生成。我们利用高表达JAG1的231B条件培养基处理血管内皮细胞,Q-PCR实验和CCK-8实验结果表明其能显著促进血管内皮细胞的增殖能力,而基质胶成管实验表明JAG1高表达的TNBC能明显促进血管内皮细胞的成管能力,这些结果与Tsung-hoying等关于VEGFA对血管生成的影响相一致,支持我们关于JAG1与VEGFA功能相似,协同促进血管内皮细胞的成管能力的猜想。
综上所述,本研究通过一系列体内外功能实验进一步揭示了JAG1 对TNBC 恶性表型的影响,初步证实JAG1能促进乳腺癌血管生成,可能与VEGFA协同促进血管生成。这一研究结果提示JAG1可以作为TNBC抗血管治疗的潜在靶点,但JAG1 是否与DLL4 等其他Notch配体相互配合调控肿瘤血管生成,尚需进一步实验证实。
