白蛋白结合型紫杉醇联合奥沙利铂一线治疗晚期胃癌的临床观察
2022-07-18朱万里王鹏王晖王红丽程鹏苟菲
朱万里 王鹏 王晖 王红丽 程鹏 苟菲


关键词白蛋白结合型紫杉醇;奥沙利铂;晚期胃癌;化疗;临床疗效;安全性
我国是胃癌高发国家,根据国际癌症研究机构(International Agency for Research on Cancer,IARC)公布的数据,2020 年我国新发胃癌病例为48 万,因胃癌死亡的病例为37 万,虽然其发病率和病死率有下降趋势,但总体新发病例和死亡病例仍较多[1]。多数胃癌患者在发现时已属进展期(中晚期),手术切除是当前进展期胃癌的主要根治手段,但仅有不到50%的患者可实现R0切除[2]。对于晚期不可手术切除的胃癌患者,化疗是主要的治疗方式[3]。紫杉醇是晚期胃癌的常用化疗药物之一,其中白蛋白结合型紫杉醇是一种新的化疗药物,它利用白蛋白的生物学特性,使肿瘤组织局部产生高浓度的紫杉醇,同时能提高人体中紫杉醇的转运、吸收和药物利用率,从而增强对肿瘤细胞的杀伤力,且不良反应少[4]。奥沙利铂作为化疗常用药物,能通过DNA加合物的形成干扰肿瘤细胞DNA的复制和转录,对进展期胃癌疗效确切[5]。替吉奥是一种新型氟尿嘧啶类抗肿瘤药物,口服吸收后可在肝脏内持续生成5-氟尿嘧啶,半衰期长,可以维持12 h 的较高血药浓度,抗癌活性强,用于治疗不可切除的局部晚期或复发性胃癌效果较好[6]。据报道,白蛋白结合型紫杉醇联合铂类药物治疗晚期妇科肿瘤显示出了良好的抗癌活性和可耐受毒性[4]。基于此,本研究以奥沙利铂联合替吉奥为对照,探索白蛋白结合型紫杉醇联合奥沙利铂一线治疗晚期胃癌的临床疗效和安全性,以期为临床合理用药提供参考依据。
1 资料与方法
1.1 一般资料
1.1.1 纳入标准本研究的纳入标准为:(1)经病理学确诊为胃腺癌,临床上经影像学确诊为转移性胃癌,肿瘤分期为Ⅳ期或出现肝、肺、骨、脑、腹膜、卵巢及远处淋巴结等远处转移,已无法通过手术治疗;(2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2 分[7];(3)近1 个月内未接受过化疗或其他影响本研究结果的治疗措施;(4)无脑转移;(5)具有可测量病灶以进行疗效评估,包括腹膜后淋巴结、锁骨上淋巴结、腹腔淋巴结、肝、肺、骨及肾上腺转移灶。
1.1.2 排除标准本研究的排除标准为:(1)因肝、肾、血液等状况而存在药物使用绝对或相对禁忌者,包括白细胞(white blood cell,WBC)<3.00×109个/L、中性粒细胞(neutrophil,N)<2.00×109个/L、血小板计数(platelet,PLT)<100×109 个/L、血红蛋白(hemoglobin,Hb)<90g/L、血清肌酐(serum creatinine,Scr)>1.5 mg/dL、肌酐清除率(creatinine clearance rate,Ccr)<50 mL/min、总胆红素(total bilirubin,TBIL)>2.0 mg/dL、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)>100 U/L 及谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)>100U/L 者;(2)预期寿命短于6 个月者;(3)存在其他部位原发性恶性肿瘤者;(4)因精神疾病或个人原因无法坚持医嘱用药及复查者。
1.1.3 纳入对象按照上述纳入和排除标准,选取2018年9 月-2020 年1 月在我院就诊的晚期不可手术切除的胃癌患者90 例作为研究对象,按照随机数字表法分为观察组和对照组,各45 例。2 组患者的性别、年龄、ECOG评分、胃癌原发部位、癌症分化等级、转移灶、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)表达等一般资料比较,差异均无统计学意义(P>0.05),具有可比性(表1)。本研究经我院医学伦理委员会审批通过(批件号为2018-KY002),所有患者对本研究均知情同意并签署相关知情同意书。
1.2 治疗方法
观察组患者应用注射用紫杉醇(白蛋白结合型)(江苏恒瑞医药股份有限公司,国药准字H20183378,规格为100 mg)120 mg/m2,于化疗第1、8 天静脉滴注;同时,应用奥沙利铂甘露醇注射液(江苏恒瑞医药股份有限公司,国药准字H20050962,规格为每100 mL含奥沙利铂0.1 g 与甘露醇5.0 g)130 mg/m2,于化疗第1 天静脉滴注。对照组患者在应用奥沙利铂甘露醇注射液(用法用量同上)的同时应用替吉奥胶囊(山东新时代药业有限公司,国药准字H20080802,规格为20 mg),于化疗第1~14 天口服,每日2 次,单次用量按照患者体表面积计算(体表面积<1.25 m2,每次40 mg;1.25 m2≤体表面积≤1.5 m2,每次50 mg;体表面积>1.5 m2,每次60mg)。2 组患者在化疗期间均予以质子泵抑制剂和5-羟色胺受体拮抗剂止吐。21 d 为1 个化疗周期,2 组患者均进行6 个周期的化疗。化疗2 个周期后进行近期疗效评估,6 个周期后进行中期疗效评估。化疗后每2 周进行1次随访观察。
1.3 观察指标
1.3.1 近期疗效化疗2 個周期后,结合CT复查结果,依据《实体肿瘤临床疗效评价标准》(1.1 版)(ResponseEvaluation Criteria in Solid Tumours 1.1,RECIST 1.1)对2 组患者的近期疗效进行评估。RECIST 1.1 将实体肿瘤临床疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。客观缓解率(objectiveresponse rate,ORR)=(CR+PR)例数/患者总例数×100%,疾病控制率=(CR+PR+SD)例数/患者总例数×100%[4]。
1.3.2 中期疗效化疗6 个周期后,再次进行疗效评估,评价方法同“1.3.1”项下。同时,采用德国西门子ADVIACentaur CP型化学发光免疫分析仪检测2 组患者的肿瘤标志物水平:抽取患者空腹外周静脉血3 mL,静置30min 后离心,获取血清,检测血清中癌胚抗原(carcinoembryonicantigen,CEA)、糖类抗原(carbohydrate antigen,CA)724、CA199 和CA242 的表达水平,并比较2 组患者治疗前后各肿瘤标志物的变化情况。
1.3.3 远期疗效化疗结束后,每2 周对患者进行1 次电话或微信随访,询问患者的生存情况及最近一次的增强CT结果,随访截止日期为2021 年5 月31 日。随访的主要终点为无进展生存时间(progression-free survival,PFS),即从开始治疗至疾病进展的时间;次要终点为患者的总生存时间(overall survival,OS),即从治疗开始至患者因任何原因死亡或末次随访时间。比较2 组患者的中位无进展生存时间(median progression-free survival,mPFS)和中位总生存时间(median overall survival,mOS)。
1.3.4 生活质量采用《中国癌症患者化学生物治疗生活质量量表》(Quality of Life Questionnaire for ChineseCancer Patients with Chemobiotherapy,QLQ-CCC)评估2 组患者的生活质量。分别于化疗前、化疗中(用药后3~4 d)、化疗后(化疗结束后5~7 d)对患者进行问卷调查,问卷内容包括躯体功能、心理功能、社会功能及其他功能4 个维度,共计35 个条目,每个条目分值为1~4 分,分数越高表示患者生活质量越好[8]。比較2 组患者各单项维度评分和QLQ-CCC总分。
1.3.5 不良反应记录治疗过程中患者出现的不良反应,按《美国国立癌症研究院通用毒性标准4.0 版》(NationalCancer Institute Common Toxicity Criteria v4.0,NCI-CTC v4.0)进行评估。不良反应发生率=不良反应发生例数/患者总例数×100%。
1.4 统计学方法
采用SPSS 22.0 软件进行数据统计分析,利用Graphpad Prism 7.0 软件绘图。计量资料若符合正态分布则以x±s 表示,采用独立样本t 检验;若不符合正态分布则以M(P25,P75)表示,采用Wilcoxon 秩和检验。计数资料以例数或率(%)表示,采用χ2 检验。等级资料采用Wilcoxon 秩和检验。肿瘤患者生活质量评估采用单因素方差分析;生存分析采用Kaplan-Meier(K-M)法和Log-Rank χ2检验,并计算mOS、mPFS 及各自对应的95%CI。检验水准α=0.05。
2 结果
2.1 2 组患者近期疗效比较
化疗2 个周期后,观察组患者的ORR显著高于对照组(P<0.05);但2 组患者的疾病控制率比较,差异无统计学意义(P>0.05)。结果见表2。
2.2 2 组患者中期疗效比较
所有患者均完成了6 个周期的化疗。化疗完成后,观察组患者的ORR 显著高于对照组(P<0.05);但2 组患者的疾病控制率比较,差异无统计学意义(P>0.05)。化疗完成后,2 组患者血清中CEA、CA724、CA199 和CA242 的表达水平均较治疗前显著降低(P<0.05),且观察组患者上述肿瘤标志物的表达水平均显著低于对照组(P<0.05)。结果见表3、表4。
2.3 2 组患者远期疗效比较
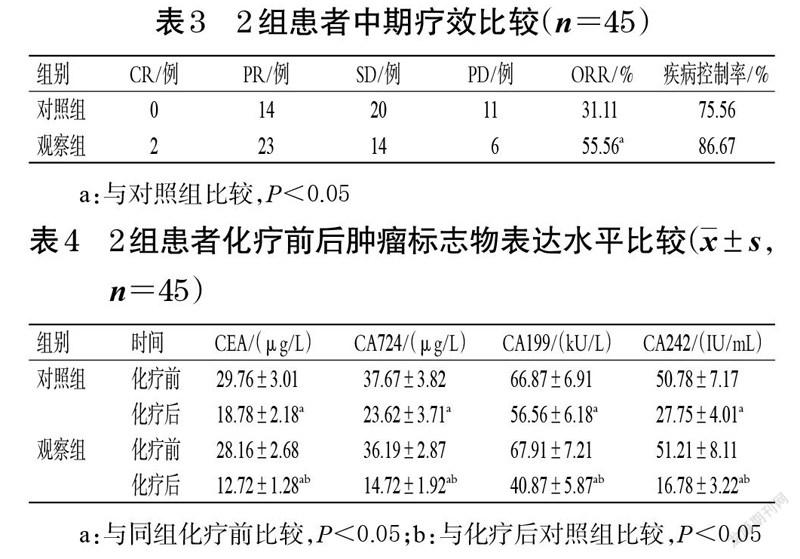
截至随访结束,对照组共有21 例患者出现PD(含15例死亡),观察组共有17 例患者出现PD(含14 例死亡)。观察组患者的mPFS 为8.78(95% CI 为6.94~11.01)个月,mOS 为13.02(95%CI 为12.78~15.62)个月;对照组患者的mPFS 为6.99(95%CI 为3.67~10.88)个月,mOS为10.42(95%CI 为8.72~13.22)个月。观察组患者的mPFS 和mOS 均显著长于对照组(P<0.05)。2 组患者的生存曲线见图1。
2.4 2 组患者生活质量比较
观察组患者化疗后的躯体维度评分显著高于本组化疗前和化疗中(P<0.05),也显著高于化疗后的对照组(P<0.05)。除此之外,2 组患者化疗前、中、后的心理维度、社会维度、其他维度评分及QLQ-CCC 总分比较,差异均无统计学意义(P>0.05)。结果见表5。
2.5 2 组患者不良反应发生情况比较
依据NCI-CTC v4.0,2 组患者发生的不良反应以1~2 级毒副反应为主,包括骨髓抑制、白细胞减少、腹泻、恶心呕吐、肝肾损伤、周围神经毒性、脱发、过敏等。其中,观察组患者的周围神经毒性发生率显著高于对照组(P<0.05);2 组患者的其他不良反应发生率比较,差异均无统计学意义(P>0.05)。结果见表6。
3 讨论
当前,我国胃癌的发病率和病死率依然很高,且不断趋于年轻化[9]。因该病早期症状轻微,故难以得到患者的足够重视,待症状明显时多已进入中晚期,甚至出现远处器官转移[10-11]。中晚期胃癌在确诊时多已无法进行手术切除,一般只能采取姑息性化疗[12]。化疗可有效延长中晚期胃癌患者的生存时间,提高其生存质量[13]。氟尿嘧啶、铂类与紫杉醇类药物是晚期胃癌主要的化疗药物,其中奥沙利铂是第3 代铂类药物,相对于顺铂、洛铂具有更高的有效性和安全性;而替吉奥是一种氟尿嘧啶衍生物口服抗癌剂,对胃癌的疗效好且不良反应少,因此奥沙利铂联合替吉奥是一种临床常用的晚期胃癌治疗方案[14]。相对于紫杉醇,白蛋白结合型紫杉醇可更有效渗透到肿瘤组织,发挥更强的抗肿瘤效应[15],在晚期胃癌的一线或二线治疗中均有应用[16-18]。有研究表明,白蛋白结合型紫杉醇联合替吉奥一线治疗晚期胃癌,患者的mPFS和mOS分别为9.3 个月和14.6 个月,ORR达58.9%,疾病控制率达87.7%[17];而白蛋白结合型紫杉醇单药二线治疗晚期胃癌,患者的mPFS和mOS分别为4.8 个月和10.4 个月,ORR为24.3%,疾病控制率为59.5%,也取得了不错的效果[18]。基于此,本研究以奥沙利铂联合替吉奥为对照治疗方案,考察了白蛋白结合型紫杉醇联合奥沙利铂一线治疗晚期不可手术切除胃癌的临床疗效和安全性,以期为临床用药提供参考。
本研究主要通过3 个时间段来观察白蛋白结合型紫杉醇联合奥沙利铂的临床疗效和安全性。第1 个时间段为化疗2 个周期后,观察组的ORR为60.00%,显著高于对照组的37.78%(P<0.05)。第2 个时间段为化疗完成后,观察组的ORR 为55.56% ,显著高于对照组的31.11%(P<0.05);同时,观察组患者的肿瘤标志物表达水平均显著低于对照组(P<0.05)。第3 个时间段为随访结束后,观察组患者的mPFS为8.78(95%CI 为6.94~11.01)个月,mOS 为13.02(95%CI 为12.78~15.62)个月,均显著长于对照组(P<0.05)。在生活质量方面,观察组患者化疗后的躯体维度评分显著高于对照组(P<0.05),表明在一定程度上,观察组治疗方案较对照组方案更能缓解胃癌患者的躯体痛苦。在安全性方面,除周围神经毒性外,观察组和对照组之间无明显差异,提示观察组治疗方案整体安全性较好。而神经毒性也是紫杉醇类药物的普遍不良反应,患者难以忍受时可在医生指导下使用塞来昔布、双氯芬酸钠等非甾体抗炎药缓解炎症状态,也可口服相关神经营养药物予以改善。
综上所述,白蛋白结合型紫杉醇联合奥沙利铂一线治疗晚期胃癌具有良好的疗效和安全性,可在一定程度上缓解患者躯体痛苦,延长患者生存时间。但是,本研究也存在一定的局限性,如研究样本量较小、随访时间较短等,有待后续研究继续完善。
