低能N+注入诱导大肠杆菌对喹诺酮耐药的研究
2022-07-17李天宇钱卫东蔡长龙
王 婷, 张 敏, 李天宇, 钱卫东, 唐 朝, 蔡长龙*
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.西安工业大学 光电工程学院, 陕西 西安 710021)
0 引言
大肠杆菌(Escherichiacoli,E.coli)是人和动物肠道内共生菌,也是导致腹泻、腹膜炎和败血症等临床病状最常见的条件致病菌[1].
喹诺酮类药物(4-quinolones)是一类人工合成的广谱抗菌的抗生素,是临床治疗大肠杆菌感染的主要抗生素之一[2].近年来由于抗生素的滥用,导致大肠杆菌耐药性出现.张小江等[3]、方洁等[4]、黎文君[5]、Wang Y等[6]发现临床分离的大肠杆菌对喹诺酮类的耐药比率大约在50%~58%以上,并呈现多药耐药(Multidrug resistance)和逐年上升的趋势,给人体健康和畜禽养殖带来极大的威胁和挑战.
毛培宏等[7,8]研究发现低能离子注入介导获得的离子束重组沙漠寡营养细菌DOB073基因组中有21个新基因与磷霉素、青霉素及万古霉素等抗生素的耐药性相关.提示低能离子辐照可诱导微生物体内染色体畸变、DNA多态性变化[9,10],从而改变细菌的耐药特性,但其具体剂量效应目前研究较少,其分子机制尚未阐明.
本研究通过不同剂量的低能N+注入诱变大肠杆菌ATCC25922获取变异菌株库,以抗性平板选择对喹诺酮类耐药的菌株,采用纸片扩散法(K-B法)和微量肉汤稀释法测定诱变菌株耐药谱和最小抑菌浓度(MIC),并通过PCR和Sanger测序分析诱变菌株16SrRNA的序列差异,从而研究低能N+辐射对大肠杆菌抗喹诺酮类抗生素耐药性的影响,为探索大肠杆菌的耐药性形成机制研究提供参考.
1 材料和方法
1.1 菌株和试剂
大肠杆菌ATCC-25922, 购自中国工业微生物菌种保藏管理中心.
头孢西丁(FOX30)等抗生素药敏片,诺氟沙星(NOR),MH培养基购自中国赛默飞世尔科技有限公司;细菌gDNA提取试剂盒、2×Taq Master Mix、PCR产物纯化试剂盒购自天根生化科技(北京)有限公司.
1.2 仪器和设备
生物改性离子注入装置,西安工业大学离子束生物工程及生物多样研究中心;梯度PCR仪和电泳仪,美国Bio-rad;Alpha Ease FC凝胶成像分析系统,美国Alpha Innotech.
1.3 实验方法
1.3.1 菌株复苏及菌膜制备
将大肠杆菌ATCC25922株按照说明书稀释并接种LB培养基,37 ℃,160 r/min活化培养24 h,再分离单菌落,以单菌落接种斜面继续活化传代2次,即得斜面种子.取1环斜面种子接种LB培养基,37 ℃,200 r/min,培养至对数生长期,6 000 r/min离心5 min,洗涤3次,用无菌水将菌悬液稀释至1×108CFU/mL,然后取100μL菌悬液均匀涂布于无菌培养平皿中,无菌风吹干成菌膜.
1.3.2 低能N+注入诱变剂量与大肠杆菌存活率
将菌膜置于生物改性离子注入装置靶室中,设置真空度为10-3Pa,N+注入能量15 keV,注入剂量分别为0×1014ions/cm2、25×1014ions/cm2、50×1014ions/cm2、75×1014ions/cm2、100×1014ions/cm2、125×1014ions/cm2,并设置平行的真空对照.N+注入后,每板加1 mL LB培养基进行冲洗,重悬,随后以100μL/板将所有诱变菌液均匀涂布于LB平板上,37 ℃培养24~72 h,记录平板菌落数,按公式(1)计算存活率,确定实验诱变剂量.

(1)
1.3.3 大肠杆菌耐药谱的K-B 法鉴定
根据美国临床和实验室标准化协会(CLSI)《抗微生物药物敏感性实验执行标准》[11]进行大肠杆菌耐药谱的检测和判定.将大肠杆菌接种MHB,于37 ℃、200 r/min培养到对数期,然后将菌液稀释至0.5麦氏标准浊度,均匀涂布于MHA平板,将药敏纸片紧贴于培养基表面,于37 ℃倒置培养16~18 h,测定其抑菌圈直径,判读结果.
1.3.4 抗生素对大肠杆菌的MIC检测
采用微量肉汤稀释法确定诺氟沙星(NOR)对大肠杆的MIC.分别向96孔深孔板中加入400μL 0.5麦氏标准浊度的大肠杆菌悬液,并加入倍比稀释的NOR,使药物终浓度分别达到800μg/mL、400μg/mL、200μg/mL、100μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.125μg/mL和1.56μg/mL,并分别设置阴性对照(不含药物)和空白对照(不含菌),于37 ℃,200 r/min培养16~20 h,用酶标仪测定OD600值,分析药物对大肠杆菌的MIC.
1.3.5 耐喹诺酮类大肠杆菌突变菌株的筛选
根据1.3.2确定的注入剂量对大肠杆菌ATCC2592进行低能N+注入,随后分别涂布于LB平板和含20 ug/mLNOR的抗性平板(LB-NOR+),37 ℃培养24~72 h,记录平板菌落数,并对初筛的耐药株在LB-NOR+平板传代3次,以获得遗传稳定的耐NOR大肠杆菌突变株.
1.3.6 大肠杆菌16S rRNA的扩增、测序和分析
选择上游引物8F 5′-AGA GTT TGA TCA TGG CTC AG-3′,下游引物1942R 5′-TAG GGT TAC CTT GTT ACG ACT T-3′作为大肠杆菌16sRNA的基因引物.按照 DNA 提取试剂盒提取大肠杆菌DNA做模板,并按照PCR 扩增试剂盒操作指南进行PCR扩增.具体反应体系为: PCR Master Mix (2×) 10 μL,引物各 0.5 μL ,模板1 μL 的,补ddH2O至20 μL ;PCR 的反应程序:95 ℃5 mim→94 ℃30 s,60 ℃30 s,72 ℃1 min,重复 40个循环→72 ℃10 min.利用琼脂糖凝胶电泳分析大肠杆菌中16S rRNA 基因扩增情况,扩增正确的送上海生工有限公司进行测序,用NCBI-blast对测序结果进行对比分析.
1.3.7 大肠杆菌acc(6′)-Ib-cr基因的扩增和分析
氨基糖苷类乙酰转移酶基因(acc(6′)-Ib-cr),分别以5′-TTGCGATGCTCTATGAGTGGCTA-3′为上游引物,5′-CTCGAATGCCTGGCGTGTTT-3为下游引物,按照1.3.6方法进行PCR扩增(退火温度为53 ℃)分析.
1.3.8 数据统计分析
每组实验设3组平行,结果采用平均数±标准差(Mean±SD)表示,用SPSS 20.0软件和 Origin2018进行数据统计分析和图片绘制.
2 结果与讨论
2.1 低能N+注入剂量对大肠杆菌存活率的影响
由图1可知,当真空度为10-3Pa,N+离子源注入能量为15 keV,大肠杆菌的存活率随着注入的剂量增加,呈现下降-上升-下降的马鞍形曲线,在注入剂量为100×1014ions/cm2时,细菌的存活率达到二次高峰,为15.99%.
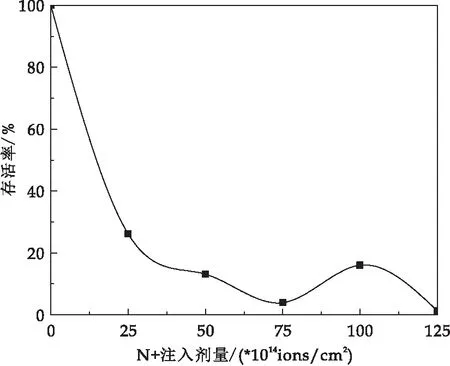
图1 低能N+注入剂量对大肠杆菌存活率的影响
因为加速后低能N+具有一定的静止质量,注入后可使质量、动量、能量和电荷共同作用于细菌,诱导产生大量自由基,从而造成胞内蛋白质的降解,双链DNA的解链和碱基的损伤.随着注入剂量不断增加,N+离子束损伤作用越来越强,导致细菌存活率下降;但随着注入剂量继续增加,细菌的修复机制被激活,使得存活率略有回升;在该剂量下,低能N+离子束会产生的大量次级粒子,从而引起细菌DNA双链断裂,进而发生遗传变异,出现新的表征.因此,根据低能离子束辐射生物效应的“反常照射损伤”原理[12,13],确定100×1014ions/cm2为最适诱变剂量.
2.2 大肠杆菌的耐药谱及对诺氟沙星的MIC
应用K-B法对大肠杆菌ATCC-25922的耐药特征进行检测.结果如表1所示,出发菌株ATCC-25922菌株对β内酰胺类抗生素,如阿莫西林/克拉维酸(AMC3)、头孢西丁(FOX30)和头孢曲松(CRO30),氟喹诺酮类抗生素,如诺氟沙星(NOR10)、环丙沙星(CIP5)、左氧氟沙星(LEV5)和莫西沙星(MXF5),以及替考拉宁(TEC30)、阿奇霉素(AZM15)、庆大霉素(CN30)等抗生素都比较敏感,无耐药现象.采用微量肉汤稀释法和琼脂稀释法确定大肠杆菌ATCC25922对喹诺酮类抗生素NOR敏感,其MIC为1.56 μg/mL.

表1 低能N+注入对大肠杆菌耐药谱的影响
随着抗生素使用频率和剂量不断增加,细菌耐药性不断增加.ATCC25922是CLSI推荐的大肠杆菌参考菌株,本研究检测结果ATCC25922对多数抗生素敏感,与CLSI[11]的参考范围一致,并且其遗传背景清晰,适于作为诱导筛选耐药菌株的出发菌株.
2.3 低能N+注入诱变大肠杆菌获得诺氟沙星抗性
设置离子源注入能量为15 keV,注入剂量为100×1014ions/cm2对大肠杆菌ATCC25922进行低能N+注入,随后分别涂布于LB和LB-NOR+平板,37 ℃培养48 h后,LB平板共计长出4 797个菌落(如图2(a)所示),LB-NOR+平板共计长出12个菌落(如图2(b)所示),且传代3次后有5个仍然能在LB-NOR+平板生长,说明低能N+注入诱变大肠杆菌获得了NOR抗性,阳性突变率为1.04‰,并将其依次命名为25922-NOR1、25922-NOR2、25922-NOR3、25922-NOR4和25922-NOR5.

图2 耐诺氟沙星大肠杆菌的筛选
低能N+离子束引起细菌发生遗传变异,耐药表征经常出现代次间不稳定现象,可能随着菌体传代发生耐药基因突变的修复、丢失,或者旁路途径的代偿,从而失去耐药表征[12,13].因此本研究通过反复的抗生素平板筛选和传代的方法,筛选获得遗传和表征稳定的ATCC25922抗诺氟沙星耐药突变株,为进一步分析耐药菌株表型和基因变化提供可靠的研究材料.
2.4 低能N+注入对大肠杆菌耐药性的影响
大肠杆菌NOR抗性菌株25922-NOR1~25922-NOR5,对氟喹诺酮类抗生素NOR10、CIP5和LEV5抑菌圈直径减小,耐药性增强(如图3所示).特别是菌株29522-NOR1和2获得了对NOR10、CIP5、LEV5、MXF5四种喹诺酮类抗生素的交叉耐药性,并且对FOX30、CRO30的耐药性增强,产生多药耐药趋势(如表1所示).进一步,耐药株25922-NOR1、2、3和5的对NOR生物MIC分别增加为100μg/mL、100μg/mL、50μg/mL、50μg/mL(如图4所示),耐药指数(RI)分别为16~32倍,说明低能N+注入使参考株ATCC25922获得了耐NOR的特征.
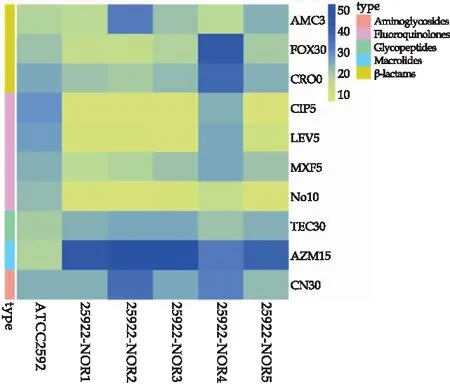
图3 低能N+注入对大肠杆菌抑菌圈的影响

图4 大肠杆菌耐药株对NOR的MIC
目前,临床上广泛使用第三代喹诺酮类药物主要包括诺氟沙星、左氧氟沙星和环丙沙星.近几年,第四代喹诺酮类药物莫西沙星上市,该类药物活性更高,抗菌谱更广,能通过多位点抑制Ⅱ、Ⅳ拓扑异构酶,诱导耐药难度大,临床耐药现象比较罕见[14,15].本研究仅2株诱导菌株对莫西沙星产生耐药,与临床耐药现象一致.
2.5 低能N+注入对大肠杆菌16S rRNA的影响
对大肠杆菌分别进行16S rRNA基因扩增,扩增片段送上海生工生物技术有限公司测序,用NCBI的Blast分析发现,耐药株29522-NOR1~5的16S rRNA与参考株ATCC25922同源性分别为96.5%、96.5%、97.5%、99.2%和97.5%,其中菌株29522-NOR4与出发菌株ATCC25922,三重耐药的菌株29522-NOR3和29522-NOR5同源性达到99.2%,四重耐药的菌株29522-NOR1和29522-NOR2同源性达到99.6%(如图5(a)所示),基因的V4区(约600-900)点突变发生较多(如图5(b)所示).

图5 大肠杆菌16S rRNA基因同源性分析
16S rRNA是目前公认的原核微生物系统发育和分子进化的分子计时器,其突变与进化可能是耐药相关基因的起源[16].包姗姗等[17]对低能离子注入介导获得的31株离子束重组沙漠寡营养菌株测序,结果其16S rRNA 基因均发生了不同程度的突变,其中3株的16s rRNA基因的拷贝数增加了5个拷贝,其新基因数目增加了34~37个,有21个新基因与抗生素抗性相关.
本研究测序结果表明,低能离子注入能诱导大肠杆菌16sr RNA基因突变和对NOR耐药表征改变,且16sr RNA基因突变率与耐药指数呈正相关(r=0.342,p≤0.05),说明低能离子注入可能通过诱导大肠杆菌16sRNA基因突变从而获得对喹诺酮类抗生素的耐药表征.
2.6 低能N+注入对大肠杆菌acc(6′)-Ib-cr基因影响
通过对大肠杆菌分别进行acc(6′)-Ib-cr基因扩增,凝胶电泳鉴定,仅四重耐药株29522-NOR1和29522-NOR2扩增得到大约481 bp扩增片段(如图6所示),其余菌株均未扩增出.

图6 大肠杆菌acc(6′)-Ib-cr基因扩增结果
大肠杆菌产生喹诺酮耐药主要由QRDR类基因(gyrA和parC)基因突变和质粒介导的喹诺酮类耐药基因(qnrS、acc(6′)-Ib-cr)造成,其中acc(6′)-Ib-cr可使大肠杆菌等革兰氏阴性菌获得对氨基糖苷类和喹诺酮类的耐药性[18].王丽娟等[19]、Piekarska K等[20]研究发现分离的75株大肠杆菌中有16株acc(6′)-Ib-cr基因阳性(21.33%)并且具有氟喹诺酮类药物耐药性,说明acc(6′)-Ib-cr基因与大肠杆菌的氟喹诺酮耐受性相关,并可能通过质粒水平传播,提高敏感菌株的耐药风险.
3 结论
(1)通过低能N+注入诱变大肠杆菌 确定了低能N+注入诱变大肠杆菌ATCC25922的最佳诱变剂量为100×1014ions/cm2.
(2)通过低能N+注入,建立了4 797株诱变菌株库,结合抗生素平板筛选获得了5株耐诺氟沙星的大肠杆菌菌株,其耐药指数为16~32倍.
(3)耐诺氟沙星的诱变菌株16S rRNA的突变率0.8%~3.6%,其中四重耐药菌株29522-NOR1和29522-NOR2的突变率较高,且检出了耐药基因acc(6′)-Ib-cr1.
研究结果说明低能N+注入可以引发大肠杆菌16S rRNA基因的突变和进化,从而引发其耐药基因的发生和起源.研究为探索低能离子注入介导大肠杆菌的耐药发生机制提供参考.
