加强脑静脉研究,提升神经系统疾病诊疗水平
——脑静脉系统解剖、生理和临床概述
2022-07-14周一帆姜慧敏卫慧敏谷雨航胡文伯吉训明
周一帆 姜慧敏 卫慧敏 谷雨航 胡文伯 刘 璐 周 陈 吉训明
(1.首都医科大学脑重大疾病研究中心,北京 100069;2.北京航空航天大学大数据精准医疗高精尖中心,生物与医学工程学院,北京 100191;3. 吉林大学中日联谊医院,长春 130033;4.首都医科大学宣武医院神经内科,北京 100053;5.首都医科大学宣武医院神经外科,北京 100053)
正常成人的大脑质量约1 400 g,占体质量的2%左右,但却需要全身血容量的20%。成年人脑组织每分钟约需要50~60 mL的氧气,75~100 mg的葡萄糖,为了维持这种不间断的需求,每分钟需要约750~1 000 mL含有氧气及葡萄糖的血流经过大脑,才能够提供维持正常功能活动所需的能量[1]。脑功能的稳态依赖于持续的血流灌注来输送氧气和葡萄糖,任何危险因素导致的血流障碍都会导致急慢性脑功能障碍。在正常机体中,脑灌注稳态依赖脑动脉和脑静脉功能的协调。从脑动脉系统流入大脑的血容量与通过静脉系统流出的血容量总体上是匹配的,脑动脉收缩,可防止过量的动脉血流入脑实质,脑动脉扩张,可允许更多的血流进入脑实质,动脉通过收缩和舒张的协调,来维持大脑的总血容量的恒定。动脉血流的中断可导致包括脑卒中在内的多种缺血性脑血管病,但脑静脉病变的相关的研究经验远少于对脑动脉的研究,本综述主要对脑静脉系统解剖以及在维持大脑功能和中枢神经系统疾病中的作用进行阐述。
1 脑静脉系统的解剖和引流
1.1 脑静脉的主要分支
脑静脉容纳约 70%~80% 的颅腔内的血容量,脑静脉不仅在个体之间存在差异,而且在同一个体左右大脑半球之间也存在差异。一般而言,颅内静脉系统可以分为5组,分别是:①幕上皮质静脉;②硬脑膜窦;③脑膜静脉;④脑深部静脉;⑤后颅窝静脉。脑静脉流入与之邻近的静脉窦,大脑浅静脉与Trolard 和 Labbé静脉形成吻合,大脑半球的上外侧流入上矢状窦,而下侧则流入横窦(图1),深静脉系统大脑内静脉、基底静脉汇合形成Galen静脉,后者经直窦汇入窦汇[2]。整个大脑内的静脉管壁较动脉薄,缺乏肌层,没有瓣膜,与颅内动脉以及外周静脉相比在结构上存在显著的异质性[2]。
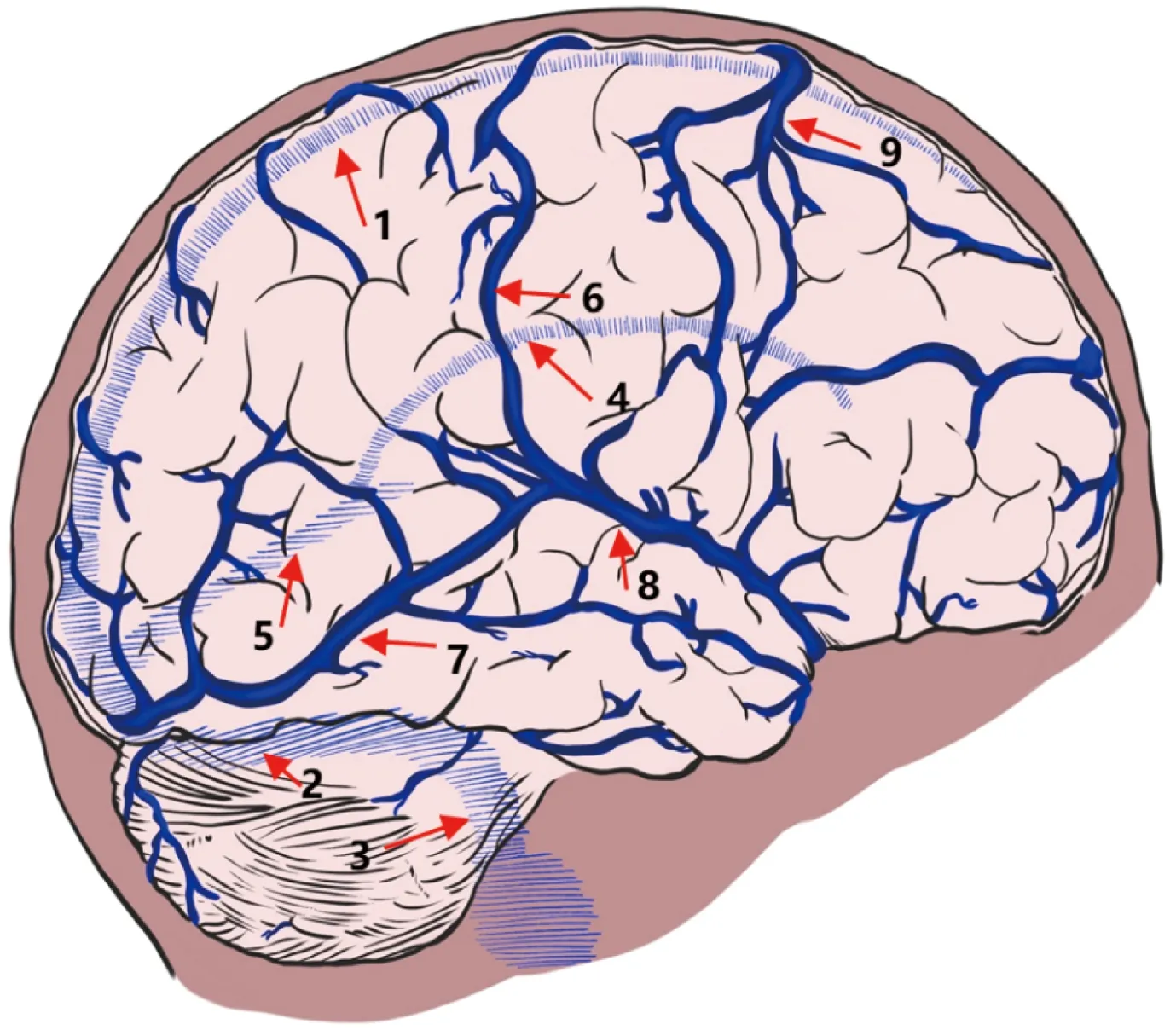
图1 上矢状窦和皮质静脉Fig.1 Superior sagittal sinus and cortical veins
1.1.1 幕上浅表皮质静脉(superficial supratentorial cortical veins)
皮质静脉沿着脑皮质沟走行,引流大脑皮质的静脉血[3]。根据主要引流静脉可将皮质静脉分为4组:上矢状窦组(superior sagittal group)、蝶窦组(sphenoidal group)、镰状窦组(falcine group)和小脑幕组(tentorial group)[2, 4]。上矢状窦组由额叶、顶叶和枕叶的上部以及额叶的眶面的静脉组成;蝶窦组由外侧裂皮质静脉的终末支和外侧裂相邻的额叶、顶叶和颞叶的部分静脉组成,这些静脉主要流入蝶顶窦和海绵窦,少数情况下汇入蝶底或蝶窦。镰状窦组由流入下矢状窦或经大脑内静脉、基底静脉、大脑大静脉以及直窦的静脉组成,该组主要引流边缘系统的血液。小脑幕组主要由流入小脑幕窦的桥静脉以及流入横窦和从小脑幕边缘流入岩下窦的静脉组成,包括颞基底静脉和枕基底静脉以及流入横窦的Labbé静脉[5]。
1.1.2 硬脑膜窦和静脉(dural sinuses and veins)
硬脑膜窦接收来自浅部和深部的脑静脉,是位于两层硬脑膜之间的较大的静脉通道,包括上矢状窦和下矢状窦、直窦、横窦、小脑幕窦、海绵窦和岩上窦等[6],硬脑膜窦通常与脑膜静脉和脑静脉相连接,并通过导静脉与颅外静脉相吻合[7]。
上矢状窦(superior sagittal sinus )位于大脑镰上缘和颅顶内板正中线的矢状窦沟内,起自盲孔向后到枕内粗隆,后端膨大形成窦汇,与横窦、直窦相汇合,上矢状窦两旁存在局部扩大部分,称为静脉陷窝,有许多蛛网膜粒突入陷窝,呈米粒状,大小不一,多集中于上矢状窦中段侧壁及窦旁的静脉陷窝内,多呈“指状”突入窦腔内[8]。约10~15条大脑上静脉与上矢状窦相吻合,其中包括沿中央前沟走行的上吻合静脉和沿中央沟走行的中央沟静脉。在上矢状窦近窦汇处的窦腔内多有纵行板层状纤维结构,可将管腔分为左右两个通道[9]。此外,瓣膜状的条索状纤维组织可起到活瓣和阀门作用,推测在调节血流及颅内压方面可能发挥作用。
下矢状窦(inferior longitudinal sinuses)位于大脑镰下缘,收集大脑半球内侧面、大脑镰和胼胝体的部分静脉血后汇入直窦,向后注入窦汇,窦汇内可见交错复杂网格状纤维间隔/小梁[8]。
直窦(straight sinuses)位于大脑镰与小脑幕交界处的硬脑膜内,横切面呈三角形,接收下矢状窦、小脑上和大脑大静脉的血液,汇入窦汇,其通过大脑大静脉、大脑内静脉以及基底静脉收集丘脑、第三脑室以及侧脑室脉络丛、豆状核、尾状核、胼胝体、部分海马、中脑等部位的血液[8]。
横窦(transverse sinus)位于小脑幕缘的两层硬脑膜之间,右侧多呈优势,常常为上矢状窦的延续,左侧横窦往往较对侧细小,横窦腔内可见多种形态的纤维小梁及蛛网膜颗粒,板层状纵行纤维索可将横窦分隔成2个或多个通道。在岩骨脊后方,横窦及岩上窦汇合后离开小脑幕,移行为乙状窦(图2),进而连接颈内静脉[6, 10]。
海绵窦(cavernous sinus)位于蝶窦和垂体两侧的两层硬脑膜之间,前起自眶上裂内侧端,与视神经管和颈内动脉床突上端毗邻,后至岩尖,与颈动脉毗邻,窦内存在许多纤维交织错综,如同海绵[11],其通过海绵间窦左右沟通,接受来自上下眼静脉的血液,通过岩上窦与横窦和乙状窦的交界处沟通,并通过岩下窦与乙状窦连通[12]。
小脑幕静脉窦(tentorial venous sinus)也称天幕窦,是走行在小脑幕间的变异脑膜静脉,形状扁平,直径较为粗大(图2A)。小脑幕静脉窦在幕上主要引流大脑半球颞、枕叶的侧面及底面的血液,在幕下主要接受小脑和基底静脉的血液[13]。
岩上窦(superpetrosal sinuses)位于颞骨岩部上缘,岩上沟内的两层硬脑膜之间,常左右对称,与海绵窦后部相沟通(图2B),收集岩上静脉血液并引流小脑前部及部分脑干外侧的血液,其外侧段与横窦末端相连[14]。
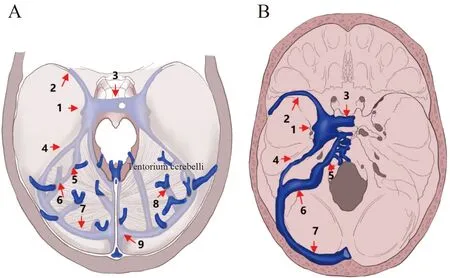
图2 横窦、乙状窦和小脑幕窦Fig.2 Transverse sinus, sigmoid sinus, and cerebellar sinus
岩下窦(subpetrosal sinuses)位于岩枕裂两层硬脑膜之间,常左右成对出现,起源于海绵窦后部,向后走行于颈静脉孔前,汇入乙状窦(图2B),收集来自迷路静脉、延髓、桥脑、小脑下部的静脉血[14]。
乙状窦(sigmoid sinus)位于颞骨乳突部,乙状窦沟内,沿着乙状窦沟弯曲向下走行,至颈静脉孔处移行为颈内静脉球,接收岩上窦和岩下窦,以及来自脑桥和延髓外侧的静脉[15](图2)。该窦上部与鼓室及乳突小房仅通过薄层骨质相隔,且可通过乳突导静脉与皮肤静脉网吻合[8]。
1.1.3 脑膜静脉(meningeal veins)
引流硬脑膜的小静脉叫作脑膜静脉,通常与脑膜动脉伴行,硬脑膜静脉与静脉窦及板障静脉间有交通支,脑膜静脉在颅底流入硬脑膜窦,在上缘流入静脉陷窝和上矢状窦,脑膜中静脉是其中较大的一支,其分为两干,分别穿过棘孔和卵圆孔回流至翼状静脉丛[9]。
1.1.4 幕上深静脉(deep upratentorial veins)
深静脉负责引流侧脑室、第三脑室和基底池周围的深部白质和灰质结构的静脉[15]。深静脉包括室管膜下静脉、大脑内静脉、基底静脉、Galen 静脉及其分支[16],根据主要排出的静脉可将深静脉分为两组:脑室组和脑池组。脑室组由排出侧脑室壁的静脉组成,主要分布于基底节、内囊、丘脑、透明隔、穹隆和深部邻近脑白质,它们负责引流额角和侧脑室体的静脉血液到大脑内静脉,大脑内静脉也接受来自丘脑和第三脑室的引流静脉,而颞角和侧脑室的静脉也可汇入基底静脉[2, 15, 17]。脑池组引流第三脑室前部的区域,包括交叉池、脚间池、环池、四叠体池,主要引流静脉为基底静脉和Galen 静脉[2, 15, 17]。
1.1.5 后颅窝静脉(posterior fossa veins)
后颅窝的静脉包括浅静脉、深静脉、脑干静脉和桥静脉[15]。浅静脉根据它们引流的区域可分为:小脑幕表面主要由小脑半球上静脉和蚓上静脉引流,枕下表面主要由小脑半球下静脉和蚓下静脉引流,岩骨表面由半球前静脉引流。浅表、深部和脑干组终止为桥静脉,它们聚集成3组:分别流入Galen静脉的Galen组、岩窦的岩组和小脑幕组,其中小脑幕组流入横窦、直窦或岩上窦[2, 18](图3)。
1.2 脑静脉的微观结构
脑组织中血液经毛细血管流入直径小于 20 μm 的小静脉,后者逐渐汇聚,并与较大的静脉汇合,随着静脉向皮质表面的移行,其管径逐渐增大,与皮质静脉相汇合[19]。皮质内小静脉通常延伸到整个皮质深度,少数与脑内髓静脉相连[15]。颅内静脉血管在结构上不同于动脉血管,小动脉具有内膜、中膜和外膜3层完整结构,而小静脉壁主要由内皮细胞层构成,表面有周细胞松散覆盖并被星型胶质细胞终足包裹[19-22]。根据管径的大小划分,小静脉可分为毛细血管后小静脉(8~30 μm)、集合小静脉(30~50 μm)和肌小静脉(50~100 μm),平滑肌细胞可少量见于直径小于 200 μm 的皮质或脑膜静脉中[19, 21]。值得注意的是,只有管径超过200 μm的静脉才会出现规则的平滑肌细胞。周细胞在血管壁外形成长而交错的突起,具有调节收缩的功能[21, 23]。但由于静脉和小静脉没有平滑肌细胞包围,因此,它们不能像动脉那样活跃的收缩[21]。
缺乏平滑肌细胞层支撑的结构特点使得静脉系统比动脉系统更容易受到脑组织水肿和颅内压(intracranial pressure,ICP)升高的影响。生理条件下,脑静脉仅发生轻微的直径变化,因此,它在调节血流中的作用很小[24]。但病理情况下,当ICP升高时,脑静脉很容易被压缩甚至塌陷,导致上游静脉血管扩张以及静水压升高,血液流出减少[24]。
2 脑静脉生理功能
2.1 血液运输和灌注调节
脑循环包含大动脉、小动脉、毛细血管以及下游的小静脉和中静脉及静脉窦,颅内静脉容纳颅腔内约 70%~80% 的血容量[25]。在脑组织中,动脉从大动脉、小动脉到微动脉,逐级分支,管腔逐级变小,管壁逐级变薄,以便通过浓度梯度扩散,将氧气和其他营养物质输送到神经元及胶质细胞,血流在毛细血管中交换氧气和营养物质,并将脑实质中的代谢废物经静脉系统带离脑组织[26-27]。Zhang等[28]提出了“血管神经网络”的概念,它强调了包括神经血管单元及其上游小动脉/动脉和下游小静脉/静脉在急慢性脑损伤病理过程中的作用。
当脑血液循环发生障碍,大脑便会出现一系列的功能紊乱和脑组织损害。脑自动调节机制依赖着脑动脉和静脉的协调,即从动脉系统进入大脑的血容量应与通过静脉系统离开大脑的血容量相匹配。因此,脑静脉系统在维持脑灌注的稳态、生理和病理环境中的颅内压调节中发挥着重要作用。脑内的静脉系统通过以下几种不同的方式调节血液的流出,包括Starling阻力模型-被动调节模式、交感神经控制的主动调节模式和 Windkessel效应调节模式[29]。
2.1.1 Starling阻力模型-被动调节
该模型[30]认为颅内压取决于动脉血压,而动脉血压取决于脑血管阻力,即动脉和静脉阻力的协调作用,由于小动脉阻力可通过血管收缩或舒张进行改变,以快速的适应不同的灌注压。因此,静脉阻力在正常情况下,通常是保持恒定的[2, 30]。当小动脉网络的自动调节达到极限时,即达到最大血管舒张或收缩极限,静脉阻力就会发生显著变化[30]。该模型表明当跨壁压超过静脉压时,无论流入压力如何,静脉都会出现阻力变化进而影响脑血流灌注,研究[31-32]显示,皮质静脉内的压力随着颅内压的线性增加而逐渐升高,静脉腔外的压力使静脉压缩且静脉内阻力增加。皮质静脉在蛛网膜下腔终止,在硬膜下,它们汇入桥静脉并最终汇入硬脑膜窦[9]。硬膜下腔充满脑脊液,颅内压升高时,经脑脊液直接压力传递,桥静脉在进入静脉窦之前被压缩,静脉内的阻力逐渐升高,上游皮质静脉充血扩张[25, 33-34]。Murtha等[35]同样证明了在高颅压的情况下,桥静脉在进入硬脑膜窦之前被压缩及静脉流出量减少,进而造成血液瘀滞并加剧了颅内高压的风险。
2.1.2 交感神经的主动调节
早在1982年,Edvinsson等[36]就在较大的软脑膜静脉(管径约为 200 μm)血管壁中,发现存在网格状神经纤维。后来他在较大的脑静脉周围,甚至观察到密集的神经纤维丛[37]。神经纤维在改变脑静脉容量中发挥重要作用[38],在病理情况下,例如在高碳酸血症和急性高血压的情况下,交感神经刺激可导致小静脉的扩张进而调节血流量和保护血-脑脊液屏障(blood-brain barrier,BBB)[39]。而这些反应可以通过交感神经切除术逆转[36]。在以动脉血压突然升高为特征的急性高血压情况下,静脉交感神经的激活减缓了血液向静脉侧的流出,从而缓解了对静脉血管壁的高剪切力的作用,减轻了对小静脉壁和BBB的破坏,交感神经阻断后这一保护作用消失[39]。因此,推测交感神经对脑静脉系统的调节能起到减轻颅内压、脑水肿和出血性转化的作用。
2.1.3 Windkessel 效应——动脉和静脉的交流
“Windkessel效应”[40]认为,来自心脏的脉冲会在弹性动脉中产生振荡的血流,并在静脉系统中衰减,在一个心动周期中,在心脏舒张期,颅内的静脉血流速度是降低的,而在收缩期从颅腔中排出的静脉血量会相应的增多,脑组织储存的多余动脉血主要被脑毛细血管床所容纳[41-42]。动脉流入和静脉流出的速率会因脉搏而发生变化,颅腔中的脑脊液体积也会发生变化,当静脉压力增加或脑脊液吸收不足时,静脉搏动就会增加,并产生向毛细血管甚至动脉的反向扩散[43]。这会导致血管甚至脑组织的顺应性受损,甚至造成脑动脉的病变或功能障碍[42]。在静脉阻塞的情况下,有研究者[44]发现局部脑血流显著减少。“血管神经网络”的概念强调了动静脉功能协调在维持大脑灌注稳态方面的作用[28]。新的成像技术证明了皮质中小动脉和小静脉之间的稳态模式[45-46]。在生理环境中,一个小动脉中的血液不是均匀分布的,而是由附近的两个小静脉引流,这意味着皮质中存在一对二的动静脉耦合,在这个单元中,小动脉和小静脉区域在皮质区域长距离共享耦合,并遵循接近原则,汇合成更大的血管[45]。
2.2 血-脑脊液屏障和物质转运
血-脑脊液屏障是一系列结构、运输和代谢屏障,它们共同限制非特异性分子进入中枢神经系统,同时确保特定营养物质的输送,从而控制脑组织环境稳态。小的非极性分子通过被动扩散,不受限制地进入脑组织,相反,大分子或极性分子则需要特殊转运蛋白才能扩散[47]。不同类型的脑血管之间的基因表达存在异质性,在动脉和小动脉中BBB 内皮转录因子占优势、在毛细血管和静脉中转运蛋白以及核糖体蛋白表达占优势,与内皮细胞沿动静脉轴的逐渐表型变化相同,壁细胞形成两个不同的亚组,包括静脉和毛细血管的周细胞和静脉平滑肌细胞,以及动脉和小动脉的平滑肌细胞,也呈现出沿动脉到毛细血管到静脉的基因和蛋白质的差异表达[48]。这种异质性使毛细血管、小动脉和小静脉能够在调节溶质转运、血流和炎症方面存在功能的差异[47]。Kucharz等[49]利用双光子显微镜与药物载体纳米技术相结合,研究了纳米脂质体颗粒在穿过 BBB 到大脑的所有运输阶段的传递过程,结果显示,毛细血管后小静脉是脂溶性纳米颗粒转运至脑组织的主要部位,提示了毛细血管、小动脉和小静脉在药物透过BBB方面的差异性。
Macdonald等[50]通过对已知在血-脑脊液屏障功能中起作用的 87 个基因检测发现,小静脉更倾向于炎症相关基因的表达。Bruno等[51]发现血-脑脊液屏障关键标志物 P-糖蛋白 (P-glycoprotein,P-GP) 和内皮屏障抗原 (endothelial barrier antigen, EBA)均在脑小静脉中高水平表达,并推测淀粉样脑血管病中β-淀粉样蛋白不优先在小静脉上积累归因于小静脉上P-GP和EBA的高表达。卒中病理过程中,包括血管细胞黏附因子-1(vascular cell adhesion molecule-1,VCAM-1)、细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)和血管内皮钙黏蛋白(vascular endothelial-cadherin, VE-cadherin) 在内的黏附因子以及白细胞转运受体主要也在毛细血管后小静脉内皮细胞上表达上调[52-53]。上述研究表明,不仅在小动脉/毛细血管/小静脉之间存在差异,重要的是内皮细胞的异质性也决定了脑小静脉在血-脑脊液屏障和物质转运方面独特的功能。
2.3 抗凝血和促纤溶功能
150 多年前,Rudolf Virchow 提出了血栓形成所需的三要素——即血管壁、血流和血液成分的异常变化,也被称为“Virchow 血栓三要素”,即内皮损伤或功能障碍、血流异常以及血液成分(如血液浓缩、血小板、凝血级联激活、炎症)异常[54]。脑静脉内皮细胞的重要生理功能包括抗凝和促纤溶的作用,内皮细胞为血管内流动的血液提供光滑的内表面,同时抑制血小板的黏附和凝集。内皮细胞通过释放前列环素I2(prostacyclin I2, PGI2)和一氧化氮(nitric oxide,NO),协同增加血小板中的环磷酸腺苷(cyclic adenosine monophosphate,cAMP)含量,进而抑制血小板的聚集及多种凝血途径[55]。生理条件下,内皮细胞作为脑血管稳态的主要调节细胞,在血管最内侧呈“上皮样”极性排列,细胞间紧密相连,并且通过黏附连接(adherens junctions)、紧密连接(tight junctions)和缝隙连接(gap junctions)维持着BBB的完整性,内皮细胞通过发挥抗凝作用维持着管腔内血液的正常流动[48, 56]。病理条件下,内皮细胞受损后会合成血小板激活因子,引起血小板聚集,促进中性粒细胞聚集和释放大量炎性介质,后者更进一步促进内皮细胞合成凝血酶和纤维蛋白,血小板黏附蛋白以及凝血因子Ⅴ、Ⅷ、vWF、血小板反应蛋白等导致血栓形成风险增加[57]。内皮细胞的抗凝和促凝的平衡协调,才能使脑静脉血流通畅。内皮细胞通过响应各种激素、细胞因子以及理化因素甚至药物的刺激,合成和释放能够调节血管生成、炎症反应、凝血以及血管舒缩和BBB通透性相关的各种因子,调控血小板黏附和聚集、调控血栓形成和纤溶之间的动态平衡[58]。当脑静脉内有血栓形成时,包括微血栓,静脉内皮细胞表现出促纤溶作用,激活的内皮细胞合成和分泌组织型纤溶酶原激活剂 (tissue-type plasminogen activator,t-PA)、尿激酶型纤溶酶原激活剂 (urinary type plasminogen activator,u-PA) 以及1型纤溶酶原激活剂抑制剂(plasminogen activator inhibitor-1,PAI-1),t-PA和u-PA 参与纤溶反应,PAI-1抑制t-PA进而抑制纤溶,通过促纤溶作用,溶解和去除血栓中的纤维蛋白,防止其交联聚集所诱发或加重的血栓形成[59]。因此,脑静脉血管内皮细胞受损是脑静脉血栓形成的关键因素之一[60-61]。
2.4 颅内压调节
ICP是指颅腔内容物对颅腔壁上所产生的压力,又称脑压。脑血流的流入和流出之间的平衡对于维持正常的ICP至关重要,然而,静脉的重要性常常被忽视,但越来越多的证据[34]表明,脑静脉病变是导致 ICP 升高的重要病理基础。Monro-Kellie 学说[62]指出,颅腔内部由3个主要成分组成:血液、脑脊液和脑实质,一种或多种成分的体积增加可能会增加ICP。
早在1896年,Leonard Hill就证明静脉压力和脑脊液压力是一致的,随后,Bedford 和 Ferris相继证明了静脉系统在 Monro-Kellie 学说中的重要性,当脑静脉顺应性丧失时,静脉压的增加会导致 ICP 增加,静脉引流不足时会导致静脉高压和颅高压的发生[34]。
局灶性横窦狭窄与特发性颅内高压(idiopathic intracranial hypertension, IIH)相关[63-64]。多达 90% 的IIH患者存在双侧横窦狭窄[65]。重要的是,狭窄区域的腔内支架置入可以显著改善颅高压症状[66]。一项研究[67]显示,经脑脊液(cerebral spinal fluid,CSF)分流后,ICP压力下降到低于中心静脉压 (central venous pressure, CVP),而此时上矢状窦压力仅下降到 CVP 水平而不是更低,在许多 IIH 病例中存在脑静脉的功能性的流出障碍也证实了该结论。VENOST 研究[68]也证实在脑静脉窦血栓患者脑静脉窦闭塞期间有明显的颅高压症状。
脑静脉还通过影响CSF的生成和循环来影响ICP,CSF由脑室内的脉络丛产生,并通过蛛网膜下腔循环,然后从蛛网膜颗粒、沿颅神经穿过颅骨孔的路径(包括筛状板)和硬脑膜的淋巴管3个主要解剖学途径清除[69]。目前认为脑脊液通过蛛网膜颗粒并进入静脉窦的吸收途径构成了主要的流出途径[70]。Zakharov等[71]验证了当颅高压时,脑脊液-静脉窦压力梯度较高,颅静脉系统中存在脑脊液示踪剂的富集,提示脑脊液通过蛛网膜流入硬脑膜窦中来降低颅内压。上述结果在狗[72]、猴[73]等动物体内也得到了证实。因此,静脉系统通过影响脑脊液吸收来影响颅内压,在临床中,静脉系统因局灶性壁外静脉窦压迫、局灶静脉窦狭窄、长段/全程静脉压迫等静脉疾病导致静脉压升高时会出现颅内压升高的现象[63, 74-76]。
2.5 脑静脉功能的新发现
有研究[77-78]已经证明,在没有神经炎症的情况下,外周激活的循环 T 细胞具有穿过 BBB 到达血管周围或蛛网膜下腔的特定能力,可以确保中枢神经系统免疫监视功能。这允许免疫细胞到达血管周围或蛛网膜下腔,在那里它们可以遇到组织驻留的抗原呈递细胞 (antigen-presenting cells, APC)、巨噬细胞。在这些与中枢神经系统(central nervous system,CNS)相关的 APC 上识别它们的抗原导致 T 细胞的激活,随后 T 细胞穿过神经胶质界限迁移到 CNS 实质[79-80]。营养物质的运输发生在中枢神经系统毛细血管水平,但免疫细胞运输发生在中枢神经系统毛细血管后小静脉水平[81]。在神经炎症发作时,已显示 T 细胞穿过蛛网膜下腔中的小静脉并在蛛网膜下腔内移动[79]。组织病理学上,早期多发性硬化症的活动性病变以局灶性白质脱髓鞘为特征,伴有静脉周围免疫细胞浸润,主要由 CD8 T 细胞、CD20 B 细胞、浆母细胞和巨噬细胞组成[82]。毛细血管后静脉血管内皮细胞上整合素构象的激活是T细胞滞留-活化-跨内皮迁移所必需的[83],在实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)诱导的中枢神经系统炎症模型中,可见位于 ICAM-1 和 VCAM-1 阳性 CNS 小静脉周围的炎症细胞和α4β1-整合素的共定位[84]。
此外,近年来发现脑静脉窦与脑膜淋巴管伴行,脑膜淋巴管位于硬脑膜层内,具体位置与上矢状窦及横窦伴行[85-86],Antoine等[85]利用脑膜淋巴管内皮细胞特异性分子淋巴管内皮细胞透明质酸受体-1(lymphatic endothelium specific hyaluronan receptor-1,Lyve-1)染色证实脑膜淋巴管与上矢状窦及横窦伴行,与“类淋巴”系统一起参与脑组织间液及脑脊液的引流。Martina等[87]通过T2-液体衰减(抑制)反转恢复序列和T1-加权黑血成像研究了人和狨猴脑膜淋巴系统磁共振成像(magnetic resonance imaging,MRI),利用重建技术展示了脑膜淋巴管与静脉窦的毗邻关系。脑膜淋巴管具有排除脑脊液[88]、生物大分子代谢废物[86, 89]、维持免疫稳态[90]等一系列功能,与脑脊液循环障碍、认知功能障碍、神经免疫性疾病、肿瘤转移等密切相关[91]。脑膜淋巴管毗邻上矢状窦及横窦,颈深部淋巴管及淋巴结更是攀附于颈静脉之上,因此静脉窦病变,包括血栓形成、外压性狭窄、内皮细胞炎症等极有可能导致脑膜淋巴系统重塑,影响脑脊液吸收、大分子的排泄、甚至免疫反应。颅内静脉系统参与CSF、组织间液吸收、免疫细胞转运和极化、代谢产物的排泄,与脑膜淋巴系统功能上重叠。Bolte等[92]对小鼠进行双侧颈内静脉结扎,静脉结扎后 3 h,颈淋巴结的引流明显减少并且结扎小鼠的脑膜淋巴脉管系统周围的物质积累减少,这表明双侧颈内静脉引流障碍后中枢神经系统淋巴脉管系统对脑脊液内容物的转运受损。
随着对脑静脉的深入研究,脑静脉的生理功能也有新的发现。Sallusto等[93]证明了记忆T细胞存在于中枢神经系统中。这些记忆免疫细胞可能对中枢神经系统的免疫监视很重要。脑脊液的记忆T细胞首先从血液中穿过有孔内皮迁移到脉络丛中,然后它们穿过基质,经脉络丛上皮进入脑脊液,最后经过脑静脉流出,因此,认为脑静脉存在免疫监视的功能[81]。Rustenhoven等[94]利用质谱流式结合单细胞测序技术发现CSF中的抗原在硬脑膜窦周围富集,APC细胞将抗原提呈给从硬脑膜窦内迁移出来的T细胞,从而使T细胞活化,该发现强调了硬脑膜窦是免疫-血液-脑组织免疫交互的场所,具有对 CNS 抗原进行免疫监视的重要作用。
3 脑静脉与中枢神经系统疾病
3.1 脑静脉与卒中
越来越多的证据[28]证明了脑静脉系统在卒中中的重要性 。除动脉因素外,卒中的预后可能在某种程度上受到静脉引流的影响。在缺血性卒中或其他脑损害期间,静脉循环的变化包括:由于主动收缩或被动压迫引起的静脉管腔形态变化;白细胞和血小板倾向于大量积聚在小静脉中,而不是小动脉,在小静脉中血细胞凝结在一起并黏附在内皮上,形成微栓子,进而阻塞小静脉[95-96]。动物研究[97]表明,在脑血流量 (cerebral blood flow,CBF) 急性减少后 30 min内,小静脉中就会出现微血栓。
在脑循环系统中,脑静脉系统容纳颅内约70% ~80%的血液,其中小静脉和微静脉容纳约75%[98]。卒中的病理生理学不仅与神经元的反应有关,还与由上游动脉、小动脉、毛细血管和下游小静脉和静脉组成的血管神经网络有关[28]。研究[99]显示,脑静脉还通过 “静脉盗血”机制参与缺血半暗带和核心梗死区的病理演变,脑组织在缺血后产生缺血核心区和半暗带,由于细胞毒性和血管源性水肿导致缺血核心区的血管外组织压力升高,静脉末端的血管受压甚至塌陷,因此,静脉血流从缺血核心区向半暗带转移,直到半暗带静脉压力增加到等于核心梗死区组织压力。当低灌注区域完全依赖于侧支供血时,可能会发生更严重的静脉盗血,从而出现缺血核心区的“无血流”现象[29, 100]。利用磁敏感加权成像(susceptibility weighted imaging, SWI)发现卒中后同侧深部白质中出现突出的髓静脉与缺血性卒中患者的不良预后相关[101-102]。此外,静脉期皮质静脉充盈延迟与动脉侧支范围和低灌注相关,且影响卒中患者预后[103- 104]。 缺血区域缺乏脑静脉引流还与偏瘫严重程度和梗死体积相关[105]。
越来越多的研究[106-108]也同样提示,脑静脉在缺血后维持 CBF 和脑功能方面起着至关重要的作用。Zhang等[107]通过对228名急性缺血性卒中患者的研究发现,与大脑中浅静脉(superficial middle cerebral veins,SMCV)充盈正常的患者相比,SMCV充盈缺失患者24 h梗死体积更大、不良结局率和病死率更高,且与3个月后的不良预后相关。越来越多的研究[103, 109-110]同样证实了皮质静脉引流状态与卒中患者临床预后相关。重要的是,皮质静脉引流还影响血管内治疗的效果,一项针对565例接受血栓切除术治疗的大动脉粥样硬化性卒中患者的多中心回顾性队列研究[111]显示,良好的皮质静脉显影与再灌注程度和良好的功能结局相关。荷兰急性缺血性卒中血管内治疗多中心随机临床试验数据[108]显示,皮质静脉不显影的缺血性脑卒中患者不能从血管内治疗中获益。急性缺血性卒中患者的病例回顾性研究[112-114]表明,皮质静脉充盈缺失与恶性脑水肿发生率显著相关,影响卒中患者的功能预后。
静脉窦发育不全(不对称发育)可能是另一个加剧与卒中相关的 ICP 和静脉受压的促发因素。一些个体的静脉窦或颈内静脉发育不良可能无法适应卒中后再灌注显著增加的血流,特别是当其他病理状况如ICP升高、脑水肿时。再灌注增加了动脉流入量的同时,静脉流出量未增加,因此会增加静脉压升高和脑肿胀的风险。静脉的回流不良有可能降低动静脉压力梯度,从而减少了脑的总灌注,因此,卒中研究人员在考虑患者的治疗和实验研究时需要注意脑小静脉和静脉的回流情况[115]。相应地,Yu等[116]报道称,在大面积脑梗死后,静脉窦发育不全或闭塞的患者更易发生恶性脑水肿和死亡。在急性前循环大血管闭塞患者中,横窦发育不良或者未发育者其颅内循环时间延长,除了梗死面积外,同侧颅静脉引流的发育不全或闭塞与大脑中动脉梗死的早期致死性水肿有关[116]。
此外,脑静脉病变还是部分类型脑出血的危险因素,少数脑静脉血栓(cerebral venous thrombosis,CVT) 患者表现为非动脉瘤性蛛网膜下腔出血[117-119],一项回顾性研究[120]显示其在CVT急性期的发病率约为2.2%。自发性脑凸面蛛网膜下腔出血(convexal subarachnoid hemorrhage, cSAH)是蛛网膜下腔出血的少见亚型,其特点是出血局限在1个或几个大脑半球凸面皮质沟内,不累及邻近的脑实质、大脑纵裂、基底池或脑室,易漏诊或误诊。一项针对233例CVT患者的研究[118]显示,有 10 例患者出现凸面蛛网膜下腔出血,且均由于上矢状窦血栓形成所致。
3.2 脑静脉与特发性颅高压
脑静脉窦狭窄(cerebral venous sinus stenosis, CVSS)是一种因颅脑外伤[121]、颅内肿瘤[122-123]、蛛网膜颗粒[124]、血栓[125]甚至颅高压等因素造成的脑静脉窦狭窄,以脑静脉窦回流受阻为特征的脑血管病。静脉窦狭窄所造成的静脉回流受阻会引起狭窄远端的静脉窦内压力增高,进而引起脑脊液的吸收障碍及颅内压升高[126]。磁共振成像[63]显示,IIH患者中高达93%的患者存在静脉窦狭窄,因此,静脉窦狭窄被认为是IIH的病因之一。一项针对143例特发性颅高压合并静脉窦狭窄的支架治疗研究[127]显示,术后88%的患者头痛有改善,97%的患者视盘水肿有改善或消退,87%的患者视觉症状有改善或消退,93%的患者搏动性耳鸣消退。
3.3 脑静脉与视听功能障碍
脑静脉病变一般导致远端静脉窦内压力增加、静脉扩张,相对脑灌注压降低[128]。脑静脉充血和功能不全不仅会影响局部血液循环,还会影响脑脊液的循环,以及大脑整体的代谢和功能活动[129-130]。研究表明,脑内静脉血液回流障碍可导致脑血流动力学障碍[131]、脑脊液动力学改变[132-133]、脑静脉血液瘀滞[133]、脑静脉压力增高以及脑灌注的减低[42, 134]、脑白质疏松样改变[135-136]、视网膜血管直径增宽[137]等。这些改变与诸多神经科症状体征相关,现已证实一些中枢神经系统疾病,如短暂性全面性遗忘症[138-141]、短暂性单眼失明[142]、原发性劳动性头痛[143-146]被报道与颈内静脉回流障碍密切相关。常见临床表现:睡眠障碍、头鸣、耳鸣、头晕、头痛、视力障碍、听力障碍、认知能力下降和颈部不适甚至自主神经功能障碍[147],其中视听功能症状(耳鸣、脑鸣、视力障碍、听觉异常)尤为常见[136, 148-150]。耳鸣常为“搏动性”,也称为血管搏动性耳鸣(vascular pulsatile tinnitus, PT),与脑静脉异常侧枝所致的涡流有关[151-153]。研究[154]显示,66%的PT患者存在横窦狭窄。新近的研究[155]显示,82%的PT患者存在内源性横窦狭窄,原因可能是狭窄引起的喷射状血流更易直接冲击到邻近乙状窦及其骨壁,从而引起乙状窦周骨壁缺失(sigmoid sinus wall dehiscence, SSWD)和乙状窦憩室 (sigmoid sinus diverticulum, SSD),通过支架成形术解除横窦狭窄后,PT几乎可以完全消失[156-158]。此外,颈静脉球高位(high jugular bulb,HJB)和乙状窦壁异常,包括SSWD和/或SSD,也被报道与PT 密切相关[159]。随着颅内压的下降,头痛和耳鸣症状可以改善,但研究[136, 160]显示,横窦、乙状窦狭窄的患者的颅内压常比头颈其他部位静脉狭窄的患者的颅内压升高更严重而持久,由于视网膜细胞长期水肿,大量视网膜细胞凋亡会导致永久性视力下降甚至失明[160]。一项纳入 43 名患者的回顾性研究[161]显示,100%的脑静脉窦狭窄的患者存在头痛,65%的患者出现视盘水肿,88.4%的患者出现视力受损,37.2%的患者出现视野变化。
3.4 脑静脉与神经变性病
既往对阿尔茨海默症(Alzheimer’s disease,AD)发病机制的研究主要集中在动脉血管壁上的β-淀粉样蛋白(amyloid β-protein,Aβ)沉积。然而,越来越多的证据[162]表明,当静脉和小静脉也受到Aβ积聚的影响时会加剧与AD相关的微血管病变。Joo等[163]证明了Aβ沉积并不是小动脉独有的,也可以在小静脉中发现沉积。一项对 16 名AD患者尸检的研究[164]显示,软脑膜和皮质静脉中均存在Aβ沉积,因此认为小静脉淀粉样蛋白沉积可能是AD发病机制的一个组成部分。Keith等[165]报道AD患者的脑室周围静脉胶原增生的同时合并静脉狭窄,这两者都与白质高信号呈正相关并预测其严重程度,静脉胶原病会因AD 相关病理而加重,并且会损害脑血管结构,导致静脉功能不全,增加血管源性水肿, 并阻塞血流[166]。此外,脑血管Aβ沉积与AD中血管搏动和阻力的损伤直接相关[167]。静脉系统中的小静脉淀粉样蛋白沉积和相关功能障碍,包括静脉胶原病、高搏动和阻力指数,会损害间质液和 Aβ从大脑的流出,加剧 Aβ沉积和血管功能障碍,加速疾病进程[162]。
特发性帕金森病 (idiopathic Parkinson’s disease,IPD) 是仅次于AD的第二大常见神经退行性疾病。有研究[168]表明,IPD 患者脑白质病变的风险增加。脑室周围小静脉胶原病引起的缺血和静脉功能不全可导致脑白质病变的发生[166]。Manju等[169]利用MRI对23 名IPD患者进行了脑结构扫描、颅内外血管造影以及血管的血流定量检查,发现57%的IPD患者存在脑静脉解剖结构和血流的异常,并且血流异常程度似乎与白质高信号体积相关。
4 总结和展望
静脉系统在维持脑灌注的稳态、血-脑脊液屏障的构成、调节颅内压、免疫监视、清除代谢废物和影响脑膜淋巴管的功能等生理功能中发挥着复杂的作用。随着对静脉系统的深入的研究,脑静脉系统在维持脑功能稳态方面的病理生理作用正在一步步地揭开。脑静脉系统作为新的研究领域,在各种急慢性脑疾病的病理生理机制方面还需要深入研究,有望成为探索中枢神经系统疾病病因的新的方向,甚至可为多种疾病的治疗及药物研发提供借鉴,值得深入研究。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明周一帆、姜慧敏:设计文章架构,撰写论文;吉训明、周陈:提出研究思路,设计文章架构,总体把关,审定论文;卫慧敏、谷雨航、胡文伯、刘璐:调研整理文献,审定论文。
