茶足柄瘤蚜茧蜂滞育蛹与非滞育蛹体内主要生化物质浓度比较
2022-07-14孙程鹏黄海广刘爱萍韩海斌
刘 敏,孙程鹏,黄海广,刘爱萍*,韩海斌*
(1. 中国农业科学院草原研究所,呼和浩特 010010;2. 内蒙古自治区林业科学研究院,呼和浩特 010000)
滞育(diapause)是节肢动物中广泛存在的一种适应不利生存环境的遗传现象(Tauberetal., 1986; Saunders, 2012)。滞育对于昆虫来说,有着积极的意义。昆虫可以通过进入滞育状态来度过不良环境,从而使个体在不利条件下仍能继续存活,还可以保持种群发育整齐,使交配率得以提高,以确保种群的繁衍(王满囷和李周直, 2004)。滞育的昆虫,在较长一段时间内会处于发育缓慢或发育停滞的状态,具体表现为不食不动。环境的变化会引起昆虫体内生化物质的改变,正是由于这样的原因,才导致了昆虫发育速度的减缓(徐卫华, 2008)。昆虫的滞育与生化物质的种类及浓度密切相关,这些生化物质包括糖、醇类物质、蛋白质、酶等。当昆虫处于不利于其生存的环境条件,这些生化物质能够为机体的发育需求提供保障(王满囷和李周直, 2004)。有研究认为,滞育和滞育解除可以依靠昆虫体内生化物质浓度的变化来进行区分(高玉红等, 2006)。明确茶足柄瘤蚜茧蜂Lysiphlebustestaceipes滞育过程中体内生化物质浓度的变化和保护酶活性的差异,为进一步探索茶足柄瘤蚜茧蜂滞育调控的分子机制提供依据。
作为重要的能源物质,糖类与昆虫的生命活动密不可分,同时糖类也是一些代谢途径中的中间产物。研究发现,糖类物质与昆虫滞育也存在着一定的关系,糖原与海藻糖在滞育阶段就有明显变化。滞育状态的昆虫,体内的主要能源物质就是糖原,而糖原也重要的抗冻保护剂;海藻糖在维持蛋白结构稳定与保持细胞膜完整方面起到重要作用(任小云等, 2016)。随着滞育时长的变化,昆虫体内的糖类物质也会发生变化。糖原浓度在烟蚜茧蜂Aphidiusgifuensis滞育期间呈线性下降,海藻糖浓度呈倒“U”型变化(李玉艳, 2011)。鞭角华扁叶蜂Chinolydaflagellicornis在滞育过程中,血淋巴中的糖原逐渐减少,海藻糖浓度逐渐增加,在滞育前期,海藻糖与糖原相互转化,同时发现滞育阶段及温度与这种转化关系有关(王满囷和李周直, 2002)。斑蛾Zygaentrlfolii进入滞育后糖原是最重要的能源物质,在滞育虫体中糖原浓度是非滞育虫体的2倍多(Wipkingetal., 1995)。糖原是棉铃虫Helicoverpaarmigera滞育蛹生命活动的主要能量来源,随着滞育强度的深入,糖原浓度逐渐降低(张韵梅, 1994)。
昆虫在滞育期间通过积累甘油、山梨醇等醇类物质来实现过冷却点的降低、细胞膜的固定、渗透压的减少,以此来维持内稳态,使虫体免受低温损伤(Baust, 1982)。在滞育昆虫体内,甘油是变化最明显的醇类物质之一,也是重要的抗冻保护剂,使昆虫能够抵御低温环境(陈永杰, 2005)。桑螟Diaphaniapyloalis幼虫体内甘油浓度从越冬早期到越冬末期呈现先升高后降低的现象(陈永杰, 2005)。非滞育灰飞虱Laodelphaxstriatellus幼虫体内的甘油浓度明显低于滞育幼虫,通过提高甘油浓度来抵抗滞育期间的低温(宋菁菁等, 2017)。但有研究显示,有些昆虫在滞育期间并不会合成甘油,甘油的积累并不是昆虫滞育所必需的(Joneetal., 1984)。对欧洲玉米螟Ostrinianubilalis低温诱导的分析显示,甘油累积的能力并不是所有过程的固有属性,王智渝(1998)等对滞育和非滞育棉铃虫蛹的甘油浓度展开对比,发现二者甘油浓度无明显区别,在滞育期间不存在甘油积累现象。
不同滞育昆虫体内山梨醇的浓度变化也不相同。随着滞育时长的增加,大斑芫菁Mylabrisphalerata的山梨醇浓度呈增加趋势(朱芬等, 2008)。越冬过程中的麦红吸浆虫Sitodiplosismosellana,随环境温度下降,山梨醇浓度呈现逐渐增加的发展趋势(王洪亮, 2007)。桃小食心虫Carposinaniponensis在整个滞育过程中,仅在15℃条件下处理45 d和5℃条件下处理15 d能够检测到山梨醇,猜测可以通过山梨醇是否存在定性评价该虫的滞育深度(丁惠梅等, 2011)。
蛋白质是生命活动的主要承担者,处于滞育状态的昆虫为提高抵御恶劣环境的能力,通常会通过增加蛋白浓度来达到保护自身的目的。对棉铃虫进行研究发现,进入滞育后,血淋巴中的蛋白浓度平稳增加,脂肪体中的蛋白却呈现先上升缓慢,后显著下降(王方海等, 1998)。滞育棉铃虫体内的蛋白浓度要显著高于非滞育虫态,在化蛹后的15~60 d内,蛋白质浓度始终处于比较平稳的状态,说明蛋白浓度与棉铃虫滞育的发生与解除密切相关(Salama and Miller, 1992),由此推测蛋白浓度与其它昆虫的滞育也相关。
目前对于昆虫的保护酶系的研究主要集中在CAT、POD以及SOD,在昆虫体内的这几种酶在生长发育、代谢活动、抗逆性等方面具有重要作用,可以保护昆虫顺利越冬(Felton and Summers, 1995)。有研究显示,松黄叶蜂Neodiprionsertifer在越夏期间,滞育蛹中的过氧化氢酶活性降低(Trofimov, 1975);对黑纹粉蝶Pierismelete的滞育展开分析注意到,与非滞育蛹进行比较,滞育蛹体内的过氧化氢酶与过氧化物酶活力明显更低(薛芳森, 1996; 1997);在对二化螟Chilosuppressalis进行的研究发现,与非滞育幼虫相比,滞育虫体内的过氧化氢酶、过氧化物酶、超氧化物歧化酶3种酶活性较高(林炜等, 2007);草地螟Loxostegesticticalis在滞育过程中上述3种酶活性会提高,以顺利度过恶劣环境(张晓燕等, 2015)。
目前对于茶足柄瘤蚜茧蜂的滞育研究中,涉及生理生化物质的研究较少,其滞育的生理机制尚不明确。本实验对茶足柄瘤蚜茧蜂滞育期间的生理生化物质进行测定,着重分析与非滞育虫态相比,这些生理生化物质的改变,以期为深入进行滞育研究提供一定的指导。
1 材料与方法
1.1 供试虫源
寄生性天敌茶足柄瘤蚜茧蜂、寄主蚜虫苜蓿蚜AphiscraccivoraKoch.采自中国农业科学院草原研究所沙尔沁基地,供试寄主植物为蚕豆Viciafaba。
苜蓿蚜采自基地的羊柴Hedysarummongolicum植株上,并转接在室内的水培蚕豆苗上繁殖,接虫后对蚕豆苗进行笼罩(100目防虫网笼,55 cm×55 cm×55 cm),确保苜蓿蚜未被天敌寄生。试验用苜蓿蚜2~3龄若蚜作为寄主,在温室内饲养5代以上作为供试虫源。
从基地采集被寄生的苜蓿蚜僵蚜,从中挑取未羽化破壳的僵蚜置于人工气候箱温度25℃±1℃,相对湿度70%±1%,光周期L ∶D=14 h ∶10 h条件下培养,待蜂羽化后,挑选茶足柄瘤蚜茧蜂转移至试管(长10 cm×直径3 cm)内,用20%蜂蜜水作为补充营养,接入具有苜蓿蚜的蚕豆苗上,建立茶足柄瘤蚜茧蜂种群作为供试虫源,并在室温下用苜蓿蚜有效扩繁10代以上。取羽化24 h内的成蜂待用。
1.2 滞育蛹与非滞育蛹的获取
在室温下养虫笼中将刚羽化成蜂按1 ∶100的蜂蚜比释放成对茶足柄瘤蚜茧蜂。根据试验前期研究可知,苜蓿蚜若蚜被茶足柄瘤蚜茧蜂寄生后,寄生蜂卵继续发育120 h,此时僵蚜体内寄生蜂处于高龄幼虫(3~4龄)阶段,高龄幼虫是茶足柄瘤蚜茧蜂感受到滞育讯号的敏感虫态,将此时的僵蚜放入人工气候箱中进行滞育诱导。高龄幼虫处于滞育环境条件时,并不会立刻停止发育,而是继续发育一段时间,经试验验证,当发育至蛹时,便不再继续发育(孙程鹏, 2008)。
本试验中,诱导茶足柄瘤蚜茧蜂滞育的温光组合为,温度8℃、光周期L ∶D=8 h ∶16 h,诱导时长为30 d、45 d、60 d、75 d,共设4个滞育处理组,每个处理30头蛹。选取经过滞育诱导的僵蚜进行解剖,对茶足柄瘤蚜茧蜂蛹进行收集,以获得滞育组样品,将解剖出的茶足柄瘤蚜茧蜂活蛹放入液氮中速冻暂时保存,以获得滞育组样品,将样品放入-80℃冰箱中保存,以备使用;苜蓿蚜若蚜被茶足柄瘤蚜茧蜂寄生后,放置在25℃±0.5℃、RH 70%±5%、光周期L ∶D=14 h ∶10 h、光照强度8 800 Lx(人工气候箱,上海一恒公司MGC-HP系列)条件下,寄生蜂卵继续发育168 h(此时蚜茧蜂处于蛹态),将正常发育组样本记为滞育处理0 d,以方便后续统计。设置1个非滞育处理组,每个处理30头蛹。对僵蚜进行解剖,挑选饱满、有活力的蛹作为正常发育组样品放入液氮中速冻暂时保存,作为正常发育组样品,将收集好的样品放入-80℃冰箱中保存,方便后续试验使用。
1.3 茶足柄瘤蚜茧蜂蛹体糖类和醇类的提取与测定
将收集好的滞育蛹与正常发育蛹样品各30头从冰箱中取出,用蒸馏水对虫体进行冲洗,体表水分用吸水纸吸干备用。对蛹体称重并记录,虫体质量(g) ∶提取液体积(mL)=1 ∶5,倒入研钵中对蛹进行研磨,将匀浆冰浴,将该组织匀浆在4℃、8 000g情况下,离心10 min,取上清液。参照试剂盒说明书对5组样品进行糖类和醇类的测定,每组样品重复测定3次。
1.4 茶足柄瘤蚜茧蜂蛹体总蛋白浓度的提取与测定
将收集好的滞育蛹与正常发育蛹样品各30头从冰箱中取出,放于2 mL离心管中称重并记录,每0.1 g样品中加入1 000 μL工作液,倒入研钵中对蛹进行研磨,用匀浆器在冰上匀浆,冰浴10 min,设离心机转动速度为8 000 r/min,离心10 min,取上清液。根据SOD、CAT和POD试剂盒(苏州科铭生物技术公司)说明书对试样完成测定,每组样品重复测定3次。
1.5 酶液提取与保护酶活性测定
将收集好的滞育蛹与正常发育蛹样品各30头从冰箱中取出,放于2 mL离心管中称重并记录,倒入研钵中加入液氮进行研磨,虫体质量(g) ∶磷酸盐缓冲溶液(0.05 mol/L,pH 7.0)体积(mL)=1 ∶9,冰浴匀浆,设置离心机转速为5 000 rpm/min,在4℃下离心10 min,取上清液即为酶液。对SOD活性来进行测定时,将匀浆稀释10倍;对POD及CAT完成活性测定时,直接用上清液。根据蛋白定量测试盒说明书对样品进行总蛋白测定,每组样品重复测定3次。
1.6 数据统计与分析
运用DPS统计分析软件完成数据分析和模型模拟,使用Duncan’s氏新复极差法完成差异显著性检验。
2 结果与分析
2.1 滞育期间茶足柄瘤蚜茧蜂糖类浓度的变化
2.1.1滞育期间茶足柄瘤蚜茧蜂总糖浓度的变化
滞育期间的茶足柄瘤蚜茧蜂蛹体内总糖浓度要高于非滞育状态下蛹体内的总糖浓度。在5个处理中,滞育30 d时总糖浓度最高,平均浓度为120.47 μg/mg,随着滞育时间的延长,总糖浓度逐渐降低(图1)。
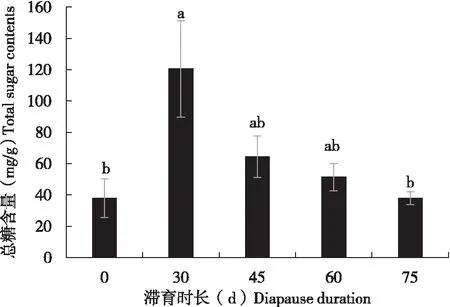
图1 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内总糖浓度Fig.1 Contents of total sugars of the diapausing pupa of Lysiphlebus testaceipes注:图中数据为平均数±标准误,不同字母者表示不同滞育时间之间总糖浓度差异显著(Duncan’s氏新复极差法,P<0.05),下同。Note: Data in the figure were mean±standard error. Different letters meant that there was significant difference in total sugar concentration between different diapause times (Duncan’s new multiple range test, P<0.05), same below.
2.1.2滞育期间茶足柄瘤蚜茧蜂海藻糖浓度的变化
与其它4个滞育组处理相比,非滞育的茶足柄瘤蚜茧蜂蛹体内海藻糖浓度最低,为5.62 μg/mg,且随着滞育时间的延长,海藻糖浓度呈现增加趋势,当滞育时长为75 d时,海藻糖浓度最高,为15.06 μg/mg。由此可以发现,在滞育期间,茶足柄瘤蚜茧蜂属海藻糖累积型(图2)。

图2 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内海藻糖浓度Fig.2 Contents of trehalose of the diapausing pupa of Lysiphlebus testaceipes
2.1.3滞育过程中茶足柄瘤蚜茧蜂糖原浓度的变化
滞育蛹体内的糖原浓度高于非滞育蛹,且随着滞育时间的延长,糖原浓度逐渐减少,与滞育蛹体内的海藻糖浓度变化呈相反的发展趋势,茶足柄瘤蚜茧蜂在滞育30 d时,糖原浓度最高,约为非滞育个体的5倍多,当滞育时间达到75 d时,与非滞育个体相比,糖原浓度无显著差异(图3)。

图3 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内糖原浓度Fig.3 Contents of glycogen of the diapausing pupa of Lysiphlebus testaceipes
2.2 滞育时间对茶足柄瘤蚜茧蜂醇类代谢的影响
2.2.1滞育过程中茶足柄瘤蚜茧蜂甘油浓度的变化
甘油在非滞育蛹体内浓度最低,为3.60 μg/mg,随着滞育时间的增加,甘油浓度也呈现上升趋势,当滞育75 d时,甘油浓度最高,为16.16 μg/mg,是非滞育蛹的4倍多(图4)。

图4 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内甘油浓度Fig.4 Contents of glycerol of the diapausing pupa of Lysiphlebus testaceipes
2.2.2滞育过程中茶足柄瘤蚜茧蜂山梨醇浓度的变化
随着滞育时间的增加,山梨醇的浓度出现先增加后减少的趋势,当滞育45 d时,出现山梨醇浓度的最大值,82.55 μg/mg。总体来看,非滞育蛹体内的山梨醇浓度低于滞育虫体,但与滞育30 d相比,浓度差异不大。同时,滞育60 d与75 d的蛹,山梨醇浓度也无差异差异(图5)。

图5 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内山梨醇浓度Fig.5 Contents of sorbitol of the diapausing pupa of Lysiphlebus testaceipes
2.3 滞育时长对茶足柄瘤蚜茧蜂蛋白浓度的变化
非滞育的茶足柄瘤蚜茧蜂蛹体内的蛋白浓度与滞育组的4个处理相比,非滞育组显著高于滞育组。随着滞育时间的增加,蛋白浓度越来越低。当滞育诱导时间为30 d时,蛋白浓度仍有18.31 μg/mg,但是当滞育时间延长到75 d时,蛋白浓度仅有8.80 μg/mg(图6)。
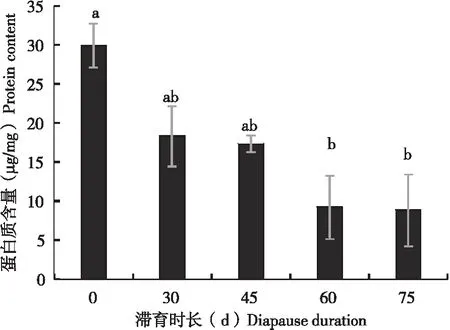
图6 不同滞育时间下茶足柄瘤蚜茧蜂蛹体内蛋白浓度Fig.6 Contents of protein of the diapausing pupa of Lysiphlebus testaceipes
2.4 滞育时间对茶足柄瘤蚜茧蜂体内保护酶活力的影响
非滞育蛹体内POD、SOD、CAT3种保护酶活性均最低,随着滞育时间的延长,活性均呈现上升趋势(表1)。
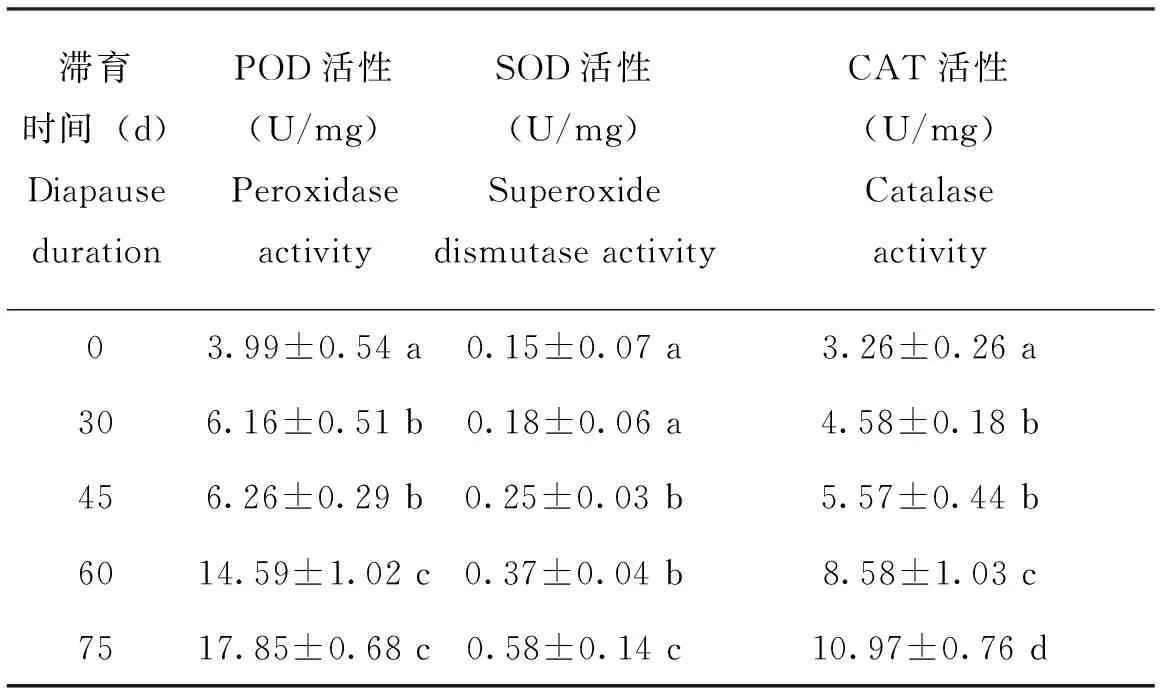
表1 不同滞育时间下茶足柄瘤蚜茧蜂体内的保护酶活性Table 1 Activities of protective enzymes of of the diapausing pupa of Lysiphlebus testaceipes
3 结论与讨论
昆虫在滞育期间代谢减弱,但仍需要大量能源物质来维持基本的生命活动,包括糖、醇、蛋白质等物质。有研究显示,麦红吸浆虫在不同滞育年份下,滞育虫态幼虫,体内的总糖浓度无显著差异,表明该虫在滞育状态下,耗能极少,从滞育过程中的能量消耗来看,能够证明该虫滞育12年的可能性(仵均祥和袁锋, 2004)。在本实验中,非滞育茶足柄瘤蚜茧蜂蛹体内的糖原浓度显著低于滞育30 d糖原浓度,说明了在滞育期间糖原与抵抗低温有关。随着滞育时长的增加,总糖的浓度呈现降低的趋势,这也说明处于滞育状态的茶足柄瘤蚜茧蜂蛹仍需要较多能量维持生命活动。在茶足柄瘤蚜茧蜂滞育试验中观察到的滞育持续时间约3个月,可能与其滞育过程中耗能较大有关。
在冬滞育的昆虫中,大多数体内都会有浓度较高的甘油,甘油能够使昆虫体液冰点降低,使其具有较高的抗冻能力(Barnes, 1969; Wu and Yuan, 2004)。本研究结果表明,滞育状态下的茶足柄瘤蚜茧蜂蛹体内甘油浓度高于非滞育状态,表明在滞育期间茶足柄瘤蚜茧蜂体内合成大量甘油,推测滞育期间茶足柄瘤蚜茧蜂蛹体内甘油浓度的增加是虫体自身应对低温而引起的体内物质代谢转化,最终达到提高抗寒性的目的。而山梨醇随滞育时间的延长呈现浓度先增加后减少的趋势,推测在糖醇转化的过程中可能存在某种障碍,而使滞育时间为45~60 d的山梨醇浓度降低,具体原因需进一步研究。
处于滞育状态的多数昆虫是消耗蛋白质的,或将蛋白质转化为其他物质来参与一些代谢过程(Denlinger and Lee, 2010)。在本次实验中也得出了类似结论,非滞育茶足柄瘤蚜茧蜂蛹体内有较高浓度的蛋白质,而在滞育情况下,蛹体内蛋白浓度降低,可能是为抵御不利环境而将蛋白质转化为其他物质,提供能量。而草地螟幼虫、棉红铃虫在滞育期间蛋白浓度会增加,从而提高虫体的防护能力,以顺利度过滞育阶段,因此在滞育过程中需要更多地蛋白来满足正常生命活动(Salama and Miller, 1992; 张健华等, 2012)。
昆虫体内的POD、CAT、SOD是重要的防御系统保护酶,处于滞育状态的昆虫通过调节这些酶的活性来保护自身在不利条件下能够继续生存。研究发现,CAT、SOD和POD在滞育的幼虫体内,随着滞育时长的延长,酶活性会呈现增强趋势(杨光平, 2013)。在滞育二化螟幼虫中发现,这3种酶的活性均高于非滞育幼虫(张晓燕等, 2015)。本研究中,POD,CAT和SOD这3种酶在滞育过程中,随着滞育时间的延长,活性会逐渐增强,当滞育时间达到60 d时,酶活性最高,昆虫通过调节这3种保护酶的活性达到自我保护的作用。
本研究测定了滞育与非滞育茶足柄瘤蚜茧蜂蛹体内的总糖、海藻糖、糖原、甘油、山梨醇、总蛋白的浓度,结果发现,总糖、海藻糖、甘油、总蛋白浓度在滞育蛹与非滞育蛹中存在显著差异,而糖原与山梨醇则没有明显差异。在茶足柄瘤蚜茧蜂滞育过程中,滞育时间的不同,虫体内的生理生化物质的浓度、种类也不完全相同,这些物质的变化,与在逆境下保证虫体的生存密切相关,通过物质浓度变化的幅度,可以衡量茶足柄瘤蚜茧蜂蛹的抗寒性能力,但上述物质对滞育昆虫所起的作用,以及浓度发生变化的原因与变化机制仍需要进行进一步的研究。
