一株裂解多重耐药性无乳链球菌噬菌体的分离及生物特性分析
2022-07-13锡林高娃梅振宇任洪宝菅瑞珍
锡林高娃,梅振宇,任洪宝,菅瑞珍
(1.内蒙古民族大学生命科学与食品学院,内蒙古 通辽 028043;2.内蒙古自治区乳源性致病菌防控工程技术研究中心,内蒙古 通辽 028043;3.内蒙古民族大学乳源性致病菌研究所,内蒙古 通辽 028043;4.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010030)
我国乳腺炎病牛分布广泛,患病牛基数大,患病机制复杂且难以根治,每年都会造成重大的经济损失[1]。研究表明,无乳链球菌是导致奶牛患乳腺炎的病菌之一,人饮用被污染的牛奶会患病,造成潜在危险[2]。现阶段在生产过程中对牛乳腺炎治疗经常使用大剂量联合抗生素,无乳链球菌在多种抗生素的选择性压力下发生变异,产生多种突变[3-4]。
噬菌体是一类能够感染细菌的病毒。噬菌体专营寄生,通过宿主菌才能完成生命周期,在其内复制繁殖。裂解性噬菌体通过杀灭宿主释放子代,生命周期短,生长速度快,短时间可以暴发性繁殖出大量子代,可以有效杀灭宿主细菌[5]。
本文以由临床患病奶牛奶样中分离的多重耐药性无乳链球菌为宿主菌,筛选1株可以有效抑制无乳链球菌生长繁殖的噬菌体,为使用噬菌体疗法治疗因多重耐药性无乳链球菌引发的牛乳腺炎提供理论依据,治疗因多重耐药性无乳链球菌引发的牛乳腺炎提供新的方法,对保障乳原料安全具有研究价值,对公共安全具有极大意义。
1 材料
1.1 菌株
本试验所用的多重耐药性无乳链球菌,分离于临床患乳腺炎且症状明显的奶牛牛乳,由内蒙古乳源性致病菌防控工程技术研究中心分离保存。
1.2 噬菌体样品的采集
试验所用样品采集于内蒙古通辽市郊区某养牛场,采集奶牛生活区的污水、粪水,采用5点取样法取样,2 h内送往实验室进行处理。
2 方法
2.1 样品处理
将采集的污水及粪水样用无菌水稀释到100 mL,加入 CaCl2使终浓度达到 1 mmoL/L,混匀,静置12 h,10 000 r/min离心10 min,取上清液,用0.45 μm的滤器过滤,涂布于无菌LB平板上,隔夜培养验证有无杂菌存在,收集过滤液。
2.2 活化无乳链球菌及对其耐药性进行检测
多重耐药无乳链球菌的活化及耐药性分析。将冻存于-80℃的无乳链球菌解冻,吸取10μL菌液添加到灭菌的含5%血清的LB液体培养基内,180 r/min 37℃恒温振荡培养10 h,利用平板划线法培养12 h。挑取单菌落,重复3次,纯化得到多重耐药性无乳链球菌。以纸片扩散药敏试验的方法进行耐药性试验,结果可参照美国临床实验室标准委员会(NCCLS)的规定[5-6]。
2.3 无乳链球菌噬菌体的分离及富集
在多重耐药性无乳链球菌菌液中分别加入1 mL过滤灭菌后的污水样、粪水样过滤液,静置15min,37℃、180 r/min振荡培养12 h。取菌液,经10 000 r/min离心10 min,取上清液,0.45μm滤膜过滤除菌保留除菌液,保存记录为噬菌体原液。
通过点样试验[7]验证噬菌体,观察结果计算噬菌斑直径平均值并记录。
用3次富集的方法[8]提高噬菌体浓度,保存标注备用。
2.4 噬菌体的纯化
挑选边缘光滑、颜色透明、较大的单株噬菌斑,用移液枪枪头挑取,混入无乳链球菌菌液,37℃、180 r/min振荡培养 6 h,经 10 000 r/min离心10 min。取上清液,经0.45μm滤膜过滤除菌,再次使用双层平板法[7]纯化,多次重复以上步骤纯化,保存噬菌体液。
2.5 噬菌体生长特性试验
2.5.1 噬菌体一步生长曲线的测定。200μL噬菌体液与预先准备的1 mL多重耐药性无乳链球菌菌液混合,混入20 mL含5%血清的LB液体培养基,37℃、180 r/min振荡培养2 h。每10 min取500μL菌液经10 000 r/min离心10 min,0.45μm滤膜过滤上清液除菌。梯度稀释除菌上清液6次,取第6次稀释液200μL与1 mL菌液混合,静置15 min,混入20 mL、37℃含5%血清的半固体LB培养基(琼脂浓度0.5%),倒在提前制备的薄LB平板上,静置10 min,37℃恒温培养24 h,观察噬菌斑个数,计数后计算滴度[9-10]。
2.5.2 噬菌体的抑菌试验。取1 mL纯化得到的噬菌体,梯度稀释5次,分别与20 mL预先培养的无乳链球菌菌液混合,按照梯度顺序记录为5个试验组,对照组只含有20 mL无乳链球菌菌液。6组样品37℃、180 r/min振荡培养,每隔20 min取1 mL用紫外分光仪在600 nm波长下测量OD值,测试6次,共2 h,计算每组平均值并记录。
2.5.3 噬菌体热稳定性试验。取噬菌体液等体积分装若干管后,分别在水浴锅内20℃、30℃、40℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃处理 60 min。 经10 000 r/min离心10 min,0.45μm滤膜过滤上清液除菌。梯度稀释除菌上清液6次后采用双层平板法统计噬菌斑滴度,计算噬菌体存活率(存活率=试验组噬菌体暴发末期滴度/标准组噬菌体暴发末期滴度×100%),每组取平均数,记录结果。
2.5.4 噬菌体紫外光照射试验。将噬菌体液等体积分装若干管,经紫外光处理120 min,每隔15 min取出1组经10 000 r/min离心10 min,0.45μm滤膜过滤上清液除菌。梯度稀释除菌上清液6次,采用双层平板法统计噬菌斑,计算存活率,每组取平均数,记录结果。
2.5.5 噬菌体pH稳定性试验。将噬菌体液等体积分装若干管,用酸碱滴定法测定试验组pH值,设置pH值等于 3、4、5、6、7、8、9、10 的试验组共 8 组, 对照组正常pH值。9组共同37℃水浴1 h,经10 000 r/min离心10 min,0.45μm滤膜过滤。梯度稀释除菌上清液6次后,采用双层平板法统计噬菌斑,计算存活率,每组取平均数,记录结果。
3 结果
3.1 活化无乳链球菌及对其耐药性检测
3.1.1 无乳链球菌染色镜检。活化的细菌经革兰氏染色为蓝紫色、圆形,呈链球状,大小均一,未发现杂菌,符合博杰手册无乳链球菌特征(结果见图1)。

图1 无乳链球菌革兰氏染色镜检图(1 000x)
3.1.2 多重耐药性无乳链球菌药物敏感性试验。药敏试验结果发现,在实验室分离到的无乳链球菌对其中的4种抗生素(庆大霉素、氨苄西林、阿莫西林、盘尼西林)耐药,对其他4种中度(链霉素、氯霉素、诺氟沙星、氧氟沙星)耐药。
3.2 多重耐药性无乳链球菌噬菌体筛选及点样试验
3.2.1 多重耐药性噬菌体点样试验。多重耐药性无乳链球菌在双层平板中的上层半固体培养基中培养24 h后,观察到上层半固体培养基颜色均匀地变深,在点样位置有颜色透明、边缘光滑的噬菌斑(结果见图2)。

图2 噬菌体初步点样结果
3.2.2 多重耐药性噬菌体纯化试验。经多次筛选,筛选出裂解性较强、噬菌斑多的一株单克隆噬菌体,噬菌体滴度为5.8×108PFU/mL,噬菌斑直径为1.3 mm,噬菌体边缘光滑、透明。图3为经5次梯度稀释形成的拥有密集噬菌体斑的双层平板。

图3 噬菌体双层平板试验结果
3.3 多重耐药性无乳链球菌噬菌体生长特性试验
3.3.1 噬菌体一步生长曲线。由于数值过大,图表数据经计算采用滴度值的Lg数值。第一阶段10~30 min,是噬菌体的潜伏期,噬菌体结合多重耐药性无乳链球菌,菌液中游离噬菌体减少,体现为10~30 min噬菌体滴度降低,在30 min降至最低点。第二阶段30~80 min,是噬菌体的暴发期,表现为 30~80 min 噬菌体滴度呈快速增长,使噬菌体经潜伏期在多重耐药性无乳链球菌内繁殖,裂解释放新的噬菌体;新噬菌体再次侵染细菌,形成链式反应,噬菌体快速繁殖呈指数增长。第三阶段80~120 min,噬菌体数达到最高,增长速度放缓,到达稳定期,表现为80~120 min噬菌体滴度稳定,是在经历快速增长后,菌液中的多重耐药性无乳链球菌大部分被裂解,噬菌体独自无法完成整个生命周期,增长速度放缓。经试验确定,噬菌体潜伏期约为30 min,暴发期约为60 min(结果见图4)。

图4 噬菌体一步生长曲线
3.3.2 多重耐药性无乳链球菌噬菌体抑菌试验。在噬菌体对多重耐药性无乳链球菌抑制试验中,加入噬菌体液对多重耐药性噬菌体有明显的抑制作用,抑制效果与稀释倍数呈负相关,随着稀释倍数增加,对多重耐药性无乳链球菌的抑制效果降低。噬菌体梯度稀释前3次的样本基本可以在120 min内使样品内无乳链球菌完全裂解(结果见图5)。
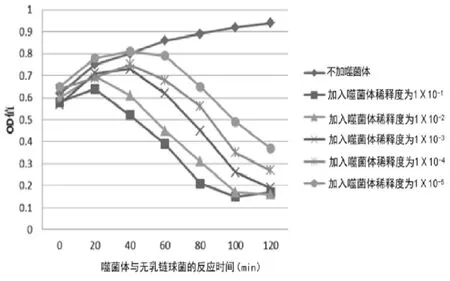
图5 噬菌体抑菌试验
3.3.3 多重耐药性无乳链球菌噬菌体对温度的敏感性试验。噬菌体可在20~40℃条件下感染细菌并增殖,50℃热处理30 min,噬菌体存活率降至78%,60℃处理30 min后,噬菌体存活率降至27%,大幅度降低。经70℃处理30 min后,存活率降至5%,80℃处理30 min后完全失活(结果见图6)。
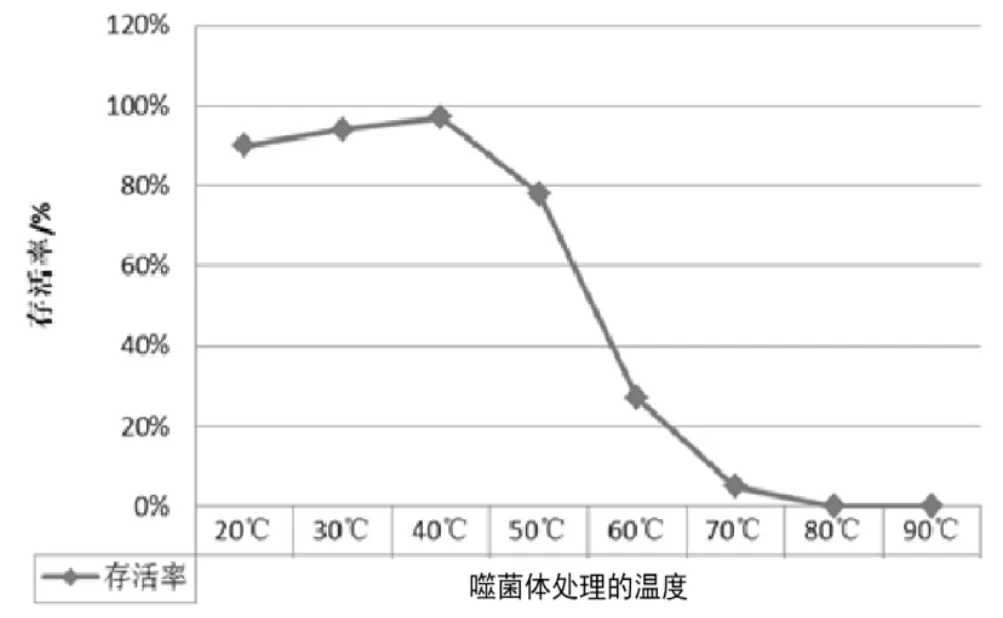
图6 温度对噬菌体生长的影响
3.3.4 多重耐药性无乳链球菌噬菌体对紫外光敏感性试验。试验结果表明,随着时间的延续,噬菌体生存率不断降低,在处理1 0 m i n时降至4 0%,在处理2 0 m i n时降至1 2%,在处理3 0 m i n后,存活率降至零(结果见图7)。

图7 紫外光照射对噬菌体生长的影响
3.3.5 多重耐药性无乳链球菌噬菌体对酸碱度的敏感性试验。试验结果表明,通过调节pH值,噬菌体在pH值为5~8时,存活率无明显变化。当pH值降至5以下或升到8以上,噬菌体活性降低(结果见图8)。

图8 pH值对噬菌体生长的影响
4 讨论
利用噬菌体预防与治疗微生物感染早在20世纪初期就被提出。近些年耐药性菌株不断出现,而噬菌体治疗细菌感染不易产生抗药性,使得噬菌体疗法的优势得以体现。目前国内外学者开始利用耐药性微生物进行筛选,寻找裂解谱宽、对耐药性微生物抑制效果好的噬菌体。通过临床动物试验,对噬菌体疗法的安全性和抑菌性进行评估,进而开发新的抑菌生物制剂[12-13]。
本试验经过初步验证(革兰氏染色试验、生化管检验、药敏片试验),确定试验菌种为一株多重耐药性无乳链球菌,经过分离提纯得到的裂解性噬菌体,裂解性较强、噬菌斑多,有着暴发速度快,对温度、酸碱度抗性高等优点。但是潜伏期较长、容易被紫外线杀灭。总体上来说对多重耐药性无乳链球菌的抑菌效果较好。在将来的研究中,有希望成为针对多重耐药性无乳链球菌进行治疗与预防的新型生物制剂。
