B细胞淋巴瘤2蛋白抑制剂在骨髓增生异常综合征治疗中的应用进展
2022-07-12宋陆茜常春康
宋陆茜,常春康
(上海交通大学附属第六人民医院血液科,上海 200233)
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组异质性造血干细胞克隆性疾病。目前,MDS治疗手段有限,预后总体较差。尽管近10年来在MDS遗传学特征和分子生物学机制方面取得了一些进展,为MDS的病理生理机制和MDS向白血病演变提供了一定解释[1],但针对MDS这种异质性疾病有确定疗效的靶向药物研究进展仍然缓慢。目前,MDS标准治疗仅有阿扎胞苷(azacitidine,AZA)和地西他滨(decitabine,DEC)2种去甲基化药物(hypomethylating agents,HMA)的方案。然而HMA疗效反应率仅29% ~ 49%,且一旦治疗失败,后续治疗选择有限,且总生存期低于6个月。自2006年HMA上市后,仅有2020年罗特西普获批用于治疗较低危MDS伴有环形铁粒幼红细胞性贫血特定亚型的新药[2]。除此以外至今没有其他新药获批用于治疗MDS。目前,虽然靶向异柠檬酸脱氢酶1(IDH1)[3]和IDH2[4]突变的小分子抑制剂在急性髓系白血病(acute myeloid leukemia,AML)中已取得临床进展,但目前尚未获得MDS适应证的批准。2020年底,美国食品和药物管理局(FDA)在评估了B细胞淋巴瘤2(B cell lymphoma-2,BCL-2)蛋白抑制剂——维奈克拉(venetoclax,VEN)联合HMA[5]或阿糖胞苷[6]治疗不适合标准化疗或年龄在75岁及以上的AML患者的Ⅱ期临床试验数据后,给予VEN突破性疗法的认定,并快速批准VEN用于AML的治疗。因BCL-2蛋白抑制剂可通过下调髓系肿瘤细胞凋亡阈值以克服化疗耐药,未来可能成为改变同为髓系肿瘤之一的MDS的治疗策略,已成为目前MDS临床研究的热点靶向药物。本文就BCL-2蛋白抑制剂的机制、药物研发过程及在MDS中的临床应用进展作一综述。
1 BCL-2家族及其介导的线粒体凋亡机制
抗肿瘤药物作为细胞损伤性因素,作用于机体后通过触发细胞内在(线粒体介导的)凋亡途径引发肿瘤细胞程序性死亡而发挥抗肿瘤作用。BCL-2家族蛋白是介导和调节该过程的一组关键蛋白,该家族成员具有蛋白质结构上的BCL-2同源结构域(Bcl-2 homology domains,BH)是其共同特征。BCL-2家族可根据各自在细胞凋亡过程中的功能分成抗凋亡蛋白(包括BCL-2、BCL-XL、MCL-1、BCL-W和BFL-1/A1蛋白)、促凋亡蛋白(包括BID、BIM、BAD、HRK、PUMA、NOXA、BMF和BIK蛋白)和凋亡效应蛋白(包括BAX、BAK和BOK蛋白)3个亚家族,它们所包含BH的数量、类型虽不一致,但共享保守的BH3结构域(见图1)[7]。其中促凋亡蛋白亚家族成员根据在凋亡激活过程中作用机制不同又进一步分成凋亡激活剂(包括BID和BIM蛋白)及凋亡致敏剂(包括BAD、HRK、PUMA、NOXA、BMF和BIK蛋白)(见图2)[8],该亚家族蛋白在结构上只含有BH3结构域而被单独定义为“BH3结构域专一蛋白”,并被认为是线粒体凋亡途径的基本发起者,各蛋白成员对应着不同的抗凋亡蛋白亚家族成员而选择性拮抗,实现了细胞凋亡阈值的动态平衡。
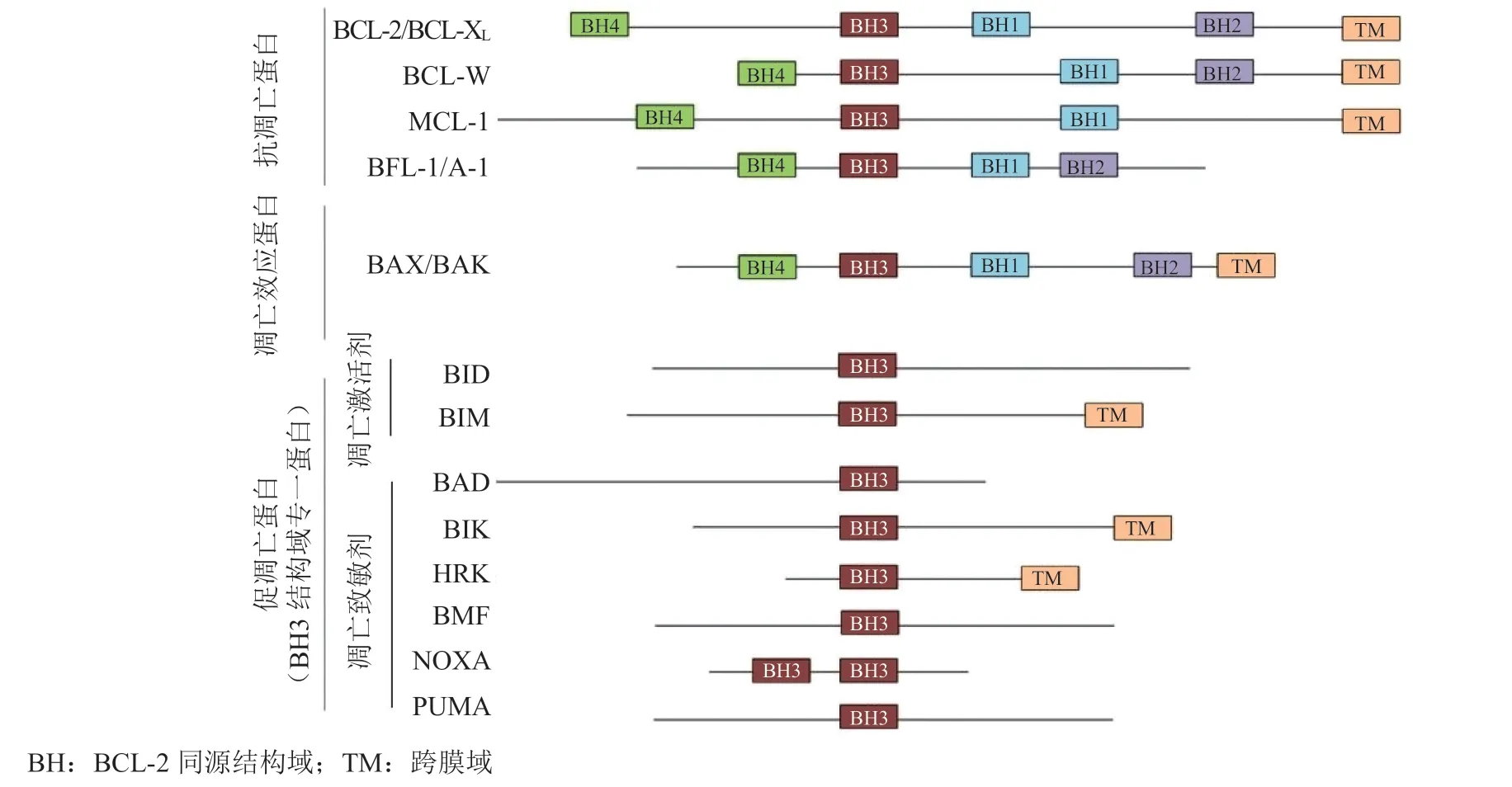
图1 不同BCL-2家族成员的结构域组织Figure 1 Domain organization of various BCL-2 family members
目前,BH3结构域专一蛋白启动细胞凋亡机制的模型有3种(见图2)。1)直接模型:BH3专一蛋白中凋亡激活剂通过直接结合并激活凋亡效应蛋白BAX和BAK。2)间接模型,也称替代模型。在该模型中的BH3专一蛋白为凋亡致敏剂,不具备直接有效激活凋亡效应蛋白BAX和BAK的能力,而是从BCL-2抗凋亡蛋白(BCL-2、BCL-XL、MCL-1、BCL-W和BFL-1)与凋亡效应蛋白(BAX和BAK)形成的聚合物中替代出BAX和BAK,然后再激活释放的BAX和BAK。3)模型1和模型2共存。经3种启动模型后凋亡效应蛋白BAX和BAK构象发生变化形成二聚体,并进一步寡聚于线粒体外膜形成BAX/BAK孔隙,改变线粒体外膜通透性(mitochondrial outer membrane permeabilization,MOMP),后续发生可溶性蛋白细胞色素C的释放,激活半胱天冬酶,最终启动细胞凋亡过程[8-9]。

图2 BH3结构域专一蛋白启动凋亡机制的不同模型Figure 2 Different models illustrating the mechanisms of BH3-only proteins induce apoptosis
2 BCL-2抑制剂研发过程
BCL-2蛋白BH3结构域及抗凋亡机制的研究推动了相关药物的临床前研究。在血液肿瘤中,肿瘤细胞通过遗传学机制过度表达BCL-2抗凋亡蛋白或低表达BH3结构域专一蛋白或凋亡效应蛋白,使恶性肿瘤细胞获得生存优势并增强其耐药能力,但同时也为选择性杀死这些肿瘤细胞提供了新型靶向疗法的机会。因此,通过靶向BCL-2抗凋亡蛋白促使髓系细胞凋亡成为血液肿瘤研究热点,推动着后续抗髓系白血病药物的研发。
2.1 BCL-2反义寡核苷酸
早期研究显示,敲除白血病小鼠模型中BCL-2等位基因可获得显著的抗白血病疗效反应,证实BCL-2蛋白是一种维持白血病细胞存活的重要蛋白[10]。BCL-2反义寡核苷酸是药物研发的最早尝试,但由于其表达的蛋白质产物半衰期长,干扰BCL-2翻译也不能快速降低BCL-2蛋白水平,限制了其作为理想反义靶点的生物制剂[11]。另外,BCL-2反义寡核苷酸对靶分子的序列特异性差,它的硫酸主链与纤维连接蛋白、成纤维细胞生长因子和人类免疫缺陷病毒逆转录酶等蛋白可发生非特异性结合的脱靶效应。因而,在后续BCL-2反义核苷酸(G3139)在AML和急性淋巴细胞白血病的临床试验中,因其使表达产物BCL-2蛋白减少丰度不足且一致差,临床疗效反应差而致最终研发失败[12]。
2.2 三代BH3结构域寡肽化合物
BH3结构域是BCL-2家族蛋白多肽链上一个双亲合的α-螺旋,能特异结合于BCL-2抗凋亡蛋白表面形成的对应的疏水槽。天然BH3结构域专一蛋白通过BH3结构域与BCL-2抗凋亡蛋白结合,替换并激活凋亡效应蛋白,从而启动细胞凋亡过程。因此,BH3结构域成为调控BCL-2抗凋亡蛋白的细胞保护活性的关键位点[13]。随着高通量小分子化合物筛选技术的发展,多项研究成功地筛选出能模拟BCL-2蛋白多肽结构中BH3结构域的小分子寡肽物质,能取代天然BH3结构域专一蛋白(如BID、BIM等)与BCL-2抗凋亡蛋白聚集形成复合物,发挥竞争拮抗作用。
最初筛选出的几种寡肽化合物抑制常数(Ki>100 nmol · L-1)较高,相对亲和力较弱,从而导致相对较低的靶向活性并存在脱靶毒性的弊端,故研发均告失败[14]。后续研究者筛选鉴定出在BCL-2的BH3结合槽中2个不同位点结合的化合物,将这2个部分通过化学键连接,形成了亲和力更大的复合物ABT-737,ABT-737是首个BCL-2的高亲和力抑制剂[15],这种高亲和力的蛋白-蛋白间相互作用抑制剂能直接激活细胞凋亡。ABT-737和BCL-2、BCL-XL和BCL-W均具有较高的亲和力(Ki<1 nmol · L-1),但与其他BCL-2家族成员,包括MCL-1结合较弱(Ki>460 nmol · L-1)[15]。临床前研究表明,ABT-737虽具有较强诱导细胞(包括原代肿瘤细胞)凋亡的作用,但其口服生物利用度低、药理学性质差阻碍了其临床应用。ABT-263即纳维克拉(navitoclax,NAV)是后续研发出的ABT-737衍生物,较前代药物改善了口服生物利用度。在ABT-263早期临床试验中表现出对慢性淋巴细胞白血病/小细胞淋巴瘤和小细胞肺癌的活性[16]。然而,由于生理性血小板存活依赖于抗凋亡蛋白BCL-XL,因而NAV易导致剂量限制的血小板减少症,从而限制其在许多肿瘤尤其是髓系肿瘤中的进一步应用。继而,药物研发者继续开发出下一代的衍生物ABT-199即VEN,这是一种高度选择性的BH3模拟小分子寡肽,对BCL-2具有更大的亲和力(Ki<1 nmol · L-1),但对BCL-XL亲和力低得多(Ki>100 nmol · L-1),可有效抑制BCL-2蛋白的活性,降低骨髓原始细胞的凋亡阈值;白血病细胞系、患者原代细胞和小鼠原代异种移植物均对ABT-199非常敏感,死亡时间不到2 h,与在慢性淋巴细胞白血病/小细胞淋巴瘤中观察到的体外敏感性一致[17]。首个进入髓系肿瘤临床应用的BCL-2小分子抑制剂药物是VEN,通过模拟BH3结构域而能特异性结合到BCL-2抗凋亡蛋白相应的疏水槽,取代原先与凋亡效应蛋白BAX结合而被阻隔活性的凋亡激活剂BIM,BIM进一步参与激活凋亡效应蛋白(如BAX、BAK),导致这些蛋白在线粒体膜寡聚,触发MOMP改变及后续细胞色素C释放而启动线粒体凋亡过程。
3 MDS中BCL-2表达的生物学特征
MDS根据疾病特征、转白血病风险初步分为较低危型和较高危型,BCL-2家族基因表达和蛋白翻译水平改变导致的细胞凋亡失调在MDS中较为常见,这为靶向凋亡途径的治疗提供了线索。Jilg等[18]研究显示,较高危MDS对比较低危型促凋亡蛋白BIM的基因表达显著降低,表明获得性凋亡抵抗可能致MDS疾病的进展,也提示BH3模拟物如VEN可通过下调凋亡阈值克服MDS细胞凋亡抵抗,具有潜在治疗价值。MDS存在凋亡失调现象,不同阶段MDS抗凋亡BCL-2家族成员的差异表达与疾病进展和化疗耐药有关,BCL-2家族成员的RNA异常剪接可促进疾病进展,但导致MDS凋亡失调的确切机制尚未完全清楚[19]。低危MDS骨髓单个核细胞的凋亡水平高于高危MDS、继发性AML或健康骨髓细胞[20]。Parker等[20]研究显示,高危型较低危型MDS凋亡蛋白效应蛋白(BAX/BAD)/抗凋亡蛋白(BCL-2/BCL-XL)比值减少,该比值变化主要是由于BCL-2表达增加所致,说明MDS恶性克隆细胞在疾病进展中获得了凋亡抗性。Tacke等[21]研究发现,化疗耐药的静止期CD34+白血病细胞中,抗凋亡蛋白BCL-2和BCL-XL存在过表达,表明白血病细胞会对化疗产生抵抗凋亡的保护机制。与健康对照组和低危MDS患者的骨髓相比,BH3模拟物ABT-737(结合BCL-2、BCL-XL和BCL-W)和VEN体外处理均能清除高危MDS/继发性AML患者的原代干细胞、祖细胞及其分化细胞[18]。
4 髓系恶性肿瘤中BCL-2抑制剂的临床前研究
研究显示,AML细胞系、MDS患者原代细胞和小鼠原代异种移植物均对ABT-199非常敏感,ABT-199诱导肿瘤细胞死亡时间均不超过2 h,与其在早期慢性淋巴细胞白血病中观察到的体外敏感性一致[22]。目前,HMA仍是唯一批准治疗较高危MDS的治疗方法,但其治疗反应率较低,临床治疗需求仍未得到满足。Bogenberger等[23]体外通过siRNA分别沉默BCL-XL、MCL-1和BCL-2基因表达发现,各组均表现出与AZA的协同抑制髓系肿瘤细胞系生长,前代BCL-XL、BCL-2和BCL-W抑制剂ABT-737相较选择性BCL-2抑制剂VEN能更有效地抑制更多的细胞系,且与AZA有更强的协同作用。目前,ABT-737的口服生物利用度较差,因而VEN联合AZA治疗成为较高危MDS中更有前途的方案。Khan等[24]研究显示,较高危MDS和AML样本中CD34+的原始细胞存在高水平的活性氧簇(reactive oxygen species,ROS)和BCL-2过表达,提示BCL-2的过表达以及高ROS水平是影响化疗敏感性的因素。Pollyea等[25]体外以VEN联合AZA处理髓系肿瘤细胞发现,细胞线粒体三羧酸循环代谢中α-酮戊二酸降低、琥珀酸水平异常升高,表明破坏细胞内线粒体氧化呼吸链可改变ROS水平,获得协同效应。此外,AZA联合VEN协同处理髓系肿瘤原代细胞后,抗凋亡蛋白复合物中NOXA和PUMA显著上调,提示AZA可能通过这种非表观遗传学机制“预启动”VEN的促凋亡过程而达到协同目的[26]。MDS因HMA治疗所致骨髓抑制的安全性事件最为常见,联合用药是否会增加如发热性中性粒细胞减少、感染性并发症等毒性风险须在临床前慎重评估,骨髓抑制等血液学毒性主要是药物抑制骨髓正常干细胞分化发育引起。因此,体外实验评估VEN联合AZA对MDS/AML患者骨髓单个核细胞生存的影响结果证实,联合方案能避免对正常造血细胞的影响[27]。
5 BCL-2抑制剂在MDS中的临床研究
克隆演化理论认为,MDS存在从正常造血-克隆性造血-低危型MDS-高危型MDS-继发性AML/AML伴MDS相关改变(AML with myelodysplasiarelated changes,AML-MRC)的病情演变过程,提示继发性AML或有MDS前驱病史的AML有别于原发性AML,更具有类似MDS的生物学特征。2018年VEN在AML受试者研究中的卓越疗效而获批用于AML的适应证,因而VEN在MDS中的临床探索首先受启示于AML研究,尤其是其中具有类似MDS的生物学特征的继发性AML或有MDS前驱病史的亚群受试者数据,下文将关注AML前期研究及MDS目前进展中VEN的相关数据。
5.1 VEN单药治疗AML
在有关32例复发/难治性AML的Ⅱ期VEN单药治疗试验中,完全缓解(complete response,CR)/CR伴不完全血细胞计数恢复(CR with incomplete blood count recovery,CRi)率 为19%(6/32),其中83%(5/6)治疗反应发生在用药后1个月内;在入组患者中,41%(13/32)存在前驱血液疾病或MDS,72%(23/32)患者接受过至少1个疗程的HMA治疗;一半的获得治疗反应者(3/6)存在MDS前驱病史和其中26%(6/23)接受过HMA治疗的患者获得了CR/CRi;常见不良事件(adverse event,AE)包括恶心、腹泻、呕吐、发热性中性粒细胞减少和低钾血症,其中发热性中性粒细胞减少发生率为28%(9/32),未发生肿瘤溶解综合征[28]。
5.2 VEN联合用药治疗AML
一项VEN联合HMA治疗不适合标准化疗的初诊AML的Ⅰb期研究(M14-358,NCT02203773)显示,相对于VEN(800 mg · d-1)联合AZA队列,VEN(400 mg · d-1)联合AZA队列中受试者获得了较高的CR/CRi率(73%),促使美国FDA于2018年11月21日加速批准VEN在髓系白血病中的适应证及后续验证性试验[5]。尽管研究人群中存在前驱或潜在MDS患者的数量未明确报告,但约1/4(36/145)的受试者为继发性AML,而亚组分析显示原发性AML与继发性AML组间的疗效反应未显示差异,提示该联合用药可能在MDS中也会取得较理想的疗效。虽然没有观察到包括实验室或临床肿瘤溶解综合征在内的剂量限制毒性,多数胃肠道AE为1级或2级,常见的3级或4级AE包括发热性中性粒细胞减少(43%)、中性粒细胞减少(17%)、血小板减少(24%)和肺炎(13%);10%患者发生包括菌血症和脓毒血症相关并发症,8%的患者发生3级或4级真菌感染;10例(7%)死于非疾病进展,主要死因是感染,包括各1例的菌血症、肺部感染、真菌性肺炎、脓毒性休克、坏死性肺炎、假单胞菌脓毒血症及各2例的肺炎和脓毒血症。上述这些联合用药AE并不较历史HMA单药研究所发生的并发症和毒性反应多。然而出于安全性考虑方案允许中断VEN最长14 d以恢复血细胞计数及延迟后续周期的治疗;发生反复中性粒细胞减少则方案中后续周期的VEN用药减至21 d(原来28 d)和(或)减少AZA剂量[5]。另一项平行开展的针对≥60岁不适合标准诱导化疗的82例初治AML患者接受VEN联合低剂量阿糖胞苷的Ⅰb/Ⅱ期研究(M14-387,NCT02287233)中,方案允许有经HMA治疗的前驱MDS病史患者入组,结果显示:49%(40/82)的受试者为继发性AML,29%(24/82)既往已接受过HMA治疗;低剂量阿糖胞苷联合VEN(600 mg · d-1)获得了CR/CRi率为54%,中位反应时间为1.4个月,中位总生存期为10.1个月,尤其值得注意的是先前接受过HMA治疗患者仍获得33%(8/24)反应(CR/CRi)率[6]。
5.3 VEN治疗MDS关键临床研究
上述AML研究中,VEN在MDS亚群受试者中所获得的积极数据极大地鼓舞了MDS的注册研究有序地开展(见表1)。首先是2项Ⅰb期研究,一项是针对复发/难治MDS患者,该研究比较了VEN单药及联合AZA用药的安全性和有效性(NCT02966782),另一项是针对初治MDS的AZA联合VEN剂量爬坡及安全性扩展研究(NCT02942290),截至2022年5月15日2项研究均完成招募。2019年12月美国血液学会年会上披露了初步结果,并于2021年6月欧洲血液学协会会议上进行了数据更新。2项Ⅰb期研究主要关注联合方案中VEN加入后的安全性及最佳推荐剂量和用药天数,最初参照AML方案中VEN的推荐日剂量即400或800 mg,28 d一个治疗周期,对比VEN在AML同期研究中的安全性事件,潜在的长期中性粒细胞减少和感染相关并发症等AE发生率显著增高[5]。为保障受试者安全,减少发热性中性粒细胞减少并发症的致死风险,研究者对MDS适应证研究的早期方案进行修正,决定减少VEN的暴露持续时间(连续28 d减至14 d)以助血液学恢复,重新进行100、200、400 mg的日剂量爬坡,研究最终确定400 mg · d-1(连续14 d)作为Ⅱ期研究的推荐剂量;此外与同期AML研究设计类似,若发生反复长期严重中性粒细胞减少的AE,允许调整VEN和AZA的剂量。最终上述Ⅰb期研究初步的安全性和有效性分析显示:总反应率80%(CR 40%+CRi 40%),摆脱输血依赖率46.5%,中位生存期28.2个月,中位反应持续时间13.8个月;3 ~ 4级AE主要集中在血液学毒性,中性粒细胞减少60%、血小板减少38%;55%的受试者有超过2次的VEN中断,中断原因非血液学毒性78%、血液学毒性35%;30 d内死亡率1%。NCT02942290研究额外设计了不同剂量调整方案的2个队列进行安全性扩展研究,探索最佳的剂量调整方案。同时据此获得了后续Ⅲ期研究所需的剂量调整方案,即发生4级以上血液学毒性先减少联合方案中1/3的AZA日推荐剂量,最低减至36 mg · m-2;若再次发生4级以上血液学毒性,再选择缩短VEN使用天数从14 d缩短至7 d。依据Ⅰb/Ⅱ期研究获得的安全性和有效性数据,扩大样本量的VEN联合AZA用于新诊断的较高危MDS的Ⅲ期注册临床研究(VERONA)正在全球范围招募进行中(截至2022年5月15日),结果尚未披露[29]。除这些系列注册研究外,MDS骨髓移植领域的适应证也在进行中。高危MDS异基因干细胞移植常采用减低强度诱导化疗(reduced intensity conditioning,RIC)方案进行预处理,RIC预处理具有延迟移植物抗白血病效应,但移植过程中受到可测量的残留病灶的影响更容易发生移植物抗宿主病,且在移植后残留病灶扩增并易导致疾病复发[30]。VEN具有不依赖P53信号通路而直接启动细胞凋亡作用,与其他活性药物联合时能协同增加抗白血病活性,且药物安全性良好,在RIC方案中添加VEN可能是一个有效的方案。目前,异基因干细胞移植高危MDS患者接受RIC联合VEN预处理方案的安全性和有效性临床试验(NCT03613532)正在进行中,该研究目的是探寻VEN能否安全地增加RIC移植预处理的抗白血病活性,而不阻碍粒细胞的植入,最终降低高危MDS人群的移植后复发率。

表 1 维奈克拉在MDS适应证中的关键注册临床试验Table 1 Introduction to key registered clinical trials of venetoclax in indications for MDS
来自于真实世界中VEN治疗MDS数据非常有限,美国纪念斯隆凯特琳癌症中心的多中心回顾性分析显示[31],44例包括初治和复发/难治在内的MDS患者对VEN联合HMA的治疗获得总反应率为59%(26/44)(CR 14%+CRi 45%),中位起效时间1.6个月,接受治疗后中位生存期19.5个月;所有受试者中,12例未接受过HMA治疗,16例为曾经暴露于HMA治疗(<4个疗程),另有16例先前接受足疗程HMA治疗失败的MDS患者,3个亚组分别获得的总反应率为75%、62%和44%,推测先前HMA的治疗对总反应率无统计学差异(P=0.26),提示VEN可能是有效克服HMA耐药的方案;与先前AML报道中一致[5],单因素分析显示,该方案仍不能改善其中28%(11/40)具有TP53基因突变和复杂核型不良预后风险特征受试者的中位生存期。在另一项来自于美国斯坦福大学癌症研究所回顾性分析中,20例接受VEN联合HMA治疗的总反应率为75%(15/20)(CR 1例+CRi 12例+部分缓解2例),该项研究中同样也包括有7例先前接受过足疗程HMA受试者[32]。2项真实世界研究均证明VEN联合HMA在高危型MDS中具有较高应答率,但因VEN的日剂量、持续时间及联合用药方案一致性差,骨髓抑制和联合用药血液学毒性在2项研究中较为突出,这就值得在临床试验中进一步研究这种联合治疗,期待Ⅲ期注册临床试验进一步证实其疗效及优化安全的推荐剂量。
6 结语
MDS的临床数据和基本原理,并讨论总结了药物研发、药物机制的相关研究。正在进行的VEN联合AZA治疗MDS的Ⅲ期注册临床试验的结果被广大血液工作者热切期待,根据Ⅰb/Ⅱ期临床数据披露的初步数据及真实世界研究结果,相信BCL-2抑制剂在MDS中将取得与AML治疗领域中一样较好的药物活性和临床疗效,改变未来MDS的治疗策略。
综上所述,BCL-2抑制剂通过下调肿瘤细胞凋亡阈值来发挥抗肿瘤效应及克服化疗耐药的作用。基于丰富的MDS凋亡特征的临床前研究和临床试验数据提示,VEN联合AZA有协同抗肿瘤作用,BCL-2抑制剂为目前治疗手段匮乏的高危MDS患者提供了潜在的治疗机会。本文概述了BCL-2抑制剂在MDS中的作用,以及VEN与AZA联合治疗
