梓醇调控miR-143-3p干预Th17糖酵解和细胞分化的机制
2022-07-11申美玉荣秋妮狄昱希田锋祥张明菲蒋宝平周玲玲
申美玉,荣秋妮,狄昱希,田锋祥,张明菲,王 祥,蒋宝平,周玲玲
(南京中医药大学药学院,江苏 南京 210023)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为特征的慢性自身免疫性疾病,涉及心血管等多系统病变,其病理机制和生物标志物目前尚未完全阐明。CD4+辅助性T细胞(CD4+helper cells,Th)是适应性免疫细胞的主要群体之一,在不同的免疫环境下,naïve CD4+T细胞能够激活并分化成为不同的亚群(Th1/Th2/Th17/Tfh/Treg等)。有研究显示[1],Th17细胞的过度分化可促进RA的发展。因此,寻找造成RA中Th17细胞异常分化的关键因素对RA的防治至关重要。
免疫代谢研究表明,T细胞各亚群具有不同的代谢程序,其中Th17细胞特别依赖于糖酵解[2]。而RA疾病状态下为保持持续的滑膜组织浸润,其CD4+T细胞始终处于高合成代谢的细胞增殖状态,主要表现为葡萄糖摄取异常增加、糖酵解增强、线粒体有氧氧化减弱,为Th17细胞分化提供了合适的条件[3]。因此,靶向CD4+T细胞中关键糖酵解酶葡萄糖转运蛋白(Glut1)、己糖激酶(HK2)、丙酮酸激酶(PKM2)、乳酸脱氢酶(LDHA)等的表达可为临床干预RA提供更多的治疗方案。
MicroRNA(miRNA)是一种内源性的保守小分子,可以通过与靶分子mRNA的3′末端非翻译区(3′UTR)结合而发挥转录后基因调节功能。多种miRNA被发现在RA CD4+T细胞中异常表达[4],并且可以通过多种机制调节细胞的糖脂代谢[5],这提示我们RA中miRNA表达异常可能通过调控糖酵解来介导Th17细胞的过度分化。最新研究显示[6],miR-143-3p可能是T细胞分化和功能的关键调节靶点,miR-143-3p过表达可通过靶向Glut1抑制葡萄糖摄取,促进记忆CD8+T细胞的分化并维持其抗肿瘤功能。同时,miR-143-3p可增加线粒体呼吸链复合物的表达水平,提示miR-143-3p的下调可能介导了细胞从线粒体有氧氧化向糖酵解的代谢转换[7]。
生地具有清热生津、凉血止血等功效,临床可治疗以“阴虚络热”为主要病机的RA,其主要活性成分梓醇(catalpol,CAT)可明显改善Th17细胞异常分化,减少炎性因子分泌,缓解RA病情[8],但其作用机制的研究还不完善。项目组前期研究已发现,CAT对miR-143-3p的表达具有调控作用,且能够显著影响CD4+T细胞中糖酵解产物水平。因此,本研究拟选取RA患者外周血CD4+T细胞,检测miR-143-3p及相关糖酵解关键酶的异常表达情况,初步分析二者的相关性,并建立体外诱导Th17细胞分化模型,结合miR-143-3p慢病毒转染,探讨CAT调控miR-143-3p对Th17糖酵解和细胞分化的干预作用和作用机制,为RA等慢性复杂疾病的临床用药提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1RA病例 经南京中医药大学附属医院伦理委员会审核(2016NL-KS14),依据美国风湿病学会(ACR)1987年发布的诊断标准,选择10例RA活动期患者。所有RA患者未进行免疫治疗。健康对照组另收集5例健康志愿者(HCs)。
1.1.2动物 10只6~8周龄的SPF级♂ C57/BL6小鼠,购自浙江维通利华实验动物技术有限公司,实验动物合格号SCXK(浙)2019-0001。动物在南京中医药大学实验动物中心饲养,自由饮食、饮水,遵循自然昼夜节律,室温为(23±2)℃,湿度为0.4~0.6。南京中医药大学动物伦理委员会审核、批准所有动物操作(202103A010)。
1.1.3药物 梓醇,购自上海源叶生物科技有限公司(货号:B21678,纯度≥0.98)。
1.1.4主要试剂 人CD4+T细胞分选磁珠(货号557767),购自美国BD公司;小鼠naïve CD4+T细胞分选试剂盒(货号130-104-453)、MACS分选缓冲液(货号130-091-221)、LS柱(130-042-401),购自德国美天旎公司;Mouse anti-CD3e(货号553057)、Mouse anti-CD28(货号553294),购自美国BD公司;Mouse IL-6(货号CG39)、Mouse IL-23(货号CI18)、Mouse TGF-β(货号CA59),购自上海近岸科技有限公司;RPMI1640培养基(货号C11875500B)、TRIzol裂解液(货号15596026),购自美国赛默飞世尔科技公司;红细胞裂解液(货号R1010),购自北京索莱宝科技有限公司;miR-143-3p mimics(货号133F0E6)、miR-143-3p inhibitor(货号1341413)、转染阴性对照(货号133F0EC)、Trans G病毒感染液(货号133F027),购自上海吉凯基因公司;miRNA 1st Strand cDNA Synthesis Kit(货号MR101-02)、miRNA Universal SYBR qPCR Master Mix(货号MQ101-02)、HiScript Ⅱ Q RT SuperMix for qPCR(货号R222-01)、ChamQ Universal SYBR qPCR Master Mix(货号Q711-02),购自南京诺唯赞生物科技有限公司;流式破膜固定剂(货号554722)、Mouse CD4-FITC抗体(货号553057)、Mouse IL-17A-PE抗体(货号561020),购自美国BD公司;小鼠IL-17A高敏ELISA试剂盒(货号EK217HS),购自联科生物技术有限公司;丙酮酸测定试剂盒(货号A081)、乳酸测定试剂盒(货号A019-2-1),购自南京建成生物工程研究所。
1.1.5主要仪器 5920R台式低温离心机,购自德国Eppendorf公司;LV100N光学显微镜,购自日本NIKON公司;Micro 21R高速冷冻离心机、HFU 486超低温冰箱,购自美国赛默飞世尔科技公司;KQ-500E型超声波清洗器,购自昆山市超声仪器有限公司;CO2培养箱,购自日本SANYO电气有限公司;autoMACS Pro全自动磁珠分选仪,购自德国美天旎公司;M200Pro酶标仪,购自瑞士TECAN公司;7500型荧光定量PCR仪,购自美国ABI公司;Gallios分析型流式细胞仪,购自美国Beckman公司。
1.2 实验方法
1.2.1RA患者临床指标观察及标本采集 根据RA诊断标准,对所有RA患者疾病活动评分(DAS28)进行评估;并于清晨空腹状态下采集患者静脉血5 mL,其中1 mL用于血沉(ESR)、类风湿因子(RF)和C反应蛋白(CRP)水平检测,4 mL用于分离外周血CD4+T细胞。RA患者及健康志愿者的具体情况如Tab 1所示。

Tab 1 Characteristics of patients with RA and HCs
1.2.2人外周血CD4+T细胞分离 无菌收集HCs和RA患者外周抗凝血,采用Ficoll密度梯度离心法提取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs);每107个细胞加入人CD4+T细胞分选磁珠50 μL,室温避光孵育30 min,BD缓冲液补足液面至1 mL并立即置于BD Imagnet磁力架上,10 min后,吸弃上清,即获得人CD4+T细胞,留作后续qPCR检测。
1.2.3小鼠naïve CD4+T细胞分离与体外Th17诱导分化 取C57BL/6小鼠脾脏制备单个核细胞悬液,照小鼠naïve CD4+T细胞分选试剂盒说明依次加入MACS buffer(40 μL/ 107个细胞)、Biotin-Antibody Cocktail(10 μL/107个细胞)、Anti-Biotin磁珠(20 μL/107个细胞)、CD44磁珠(10 μL/107个细胞),4 ℃避光孵育10 min。打开MACS全自动磁珠分选仪,设置阴性选择程序,将上述含免疫磁珠的细胞悬液加到LS柱中,收集柱下流出的液体,重复3次后离心(1 000 r·min-1,5 min),弃上清,用含10%胎牛血清的RPMI1640培养基重悬、计数,使得细胞浓度为(0.5-1)×109·L-1。
将小鼠naïve CD4+T细胞分别以2×105细胞/每孔接种于24孔板,24孔板应提前包被浓度为2 mg·L-1的anti-CD3、anti-CD28,每孔中分别加入细胞因子IL-6、IL-23、TGF-β至终浓度为25、20、5 μg·L-1[9],同时进行相应的细胞实验给药处理,于37 ℃、5% CO2环境下继续培养72 h。
1.2.4细胞实验分组及处理 将CD4+T细胞分为Control组、miR-143-3p下调组、miR-143-3p上调组,每培养孔分别加入预先配制的阴性对照、miR-143-3p inhibitor、miR-143-3p mimics慢病毒感染复合物各100 μL,以诱导miR-143-3p的高表达/低表达;将CD4+T细胞分为Control组以及不同浓度的给药组:CAT(20、40、80 mg·L-1),Control组给予相同体积1640培养基;将CD4+T细胞分为Control组、miR-143-3p下调组、miR-143-3p下调 + CAT处理组,于miR-143-3p inhibitor慢病毒感染复合物处理12 h后,miR-143-3p下调 + CAT处理组加入CAT至终浓度为40 mg·L-1,miR-143-3p下调组给予相同体积RPMI1640培养基。
1.2.5qPCR检测miR-143-3p、Glut1、HK2、PKM2、LDHA、RORγt表达 使用TRIzol法提取细胞总RNA,将其反转录成cDNA,以此cDNA为模板扩增DNA,检测miR-143-3p、Glut1、HK2、PKM2、LDHA、RORγt mRNA的相对表达量,以U6作为miR-143-3p内参,以GAPDH作为Glut1、HK2、PKM2、LDHA、RORγt内参,结果用2-ΔΔCt表示。引物根据Primer 5.0引物设计软件设计,再由生工生物工程(上海)有限公司合成,引物序列如Tab 2所示。

Tab 2 Primers used for quantitative real-time PCR
1.2.6比色法检测细胞培养上清丙酮酸、乳酸含量 收集细胞上清液及人外周血血清样本,根据说明书进行操作后混匀,在分光光度计505 nm处检测OD值,计算丙酮酸含量;在分光光度计530 nm处检测OD值,计算乳酸含量。
1.2.7ELISA法检测细胞培养上清IL-17A水平 收集细胞培养上清,严格按照小鼠IL-17A高敏ELISA试剂盒说明书操作,并分别于450和570 nm处检测OD值,计算出对应的IL-17A浓度。
1.2.8流式细胞术检测Th17细胞分化比例 收集体外诱导的Th17并用PBS洗涤1次,加入1 μLCD4-FITC流式抗体室温避光孵育30 min,PBS清洗,加入1 mL破膜剂室温避光孵育20 min,1 mL破膜洗液清洗,加入2 μL IL-17A-PE流式抗体室温避光孵育40 min,破膜洗液清洗,加入500 μL PBS重悬细胞,置于流式细胞仪上检测Th17分化比例。采用Flow Jo V10软件分析并处理流式数据。
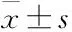
2 结果
2.1 RA患者miR-143-3p表达与糖酵解及Th17细胞分化的关联性如Fig 1所示,与HC组比较,RA患者外周血CD4+T细胞中miR-143-3p表达明显下降(P<0.05),Th17特异性转录因子RORγt mRNA表达明显升高(P<0.05),Pearson′s分析结果表明,miR-143-3p表达与RORγt mRNA水平(P<0.05)、疾病严重度DAS28(P<0.01)具有相关性且均呈负相关;如Fig 2所示,与HC组比较,RA患者外周血CD4+T细胞中糖酵解关键酶Glut1、HK2、PKM2、LDHA mRNA表达均显著升高(P<0.05);Pearson′s分析结果得出,miR-143-3p表达与Glut1、HK2、LDHA mRNA表达水平具有相关性且均呈负相关(P<0.05)。
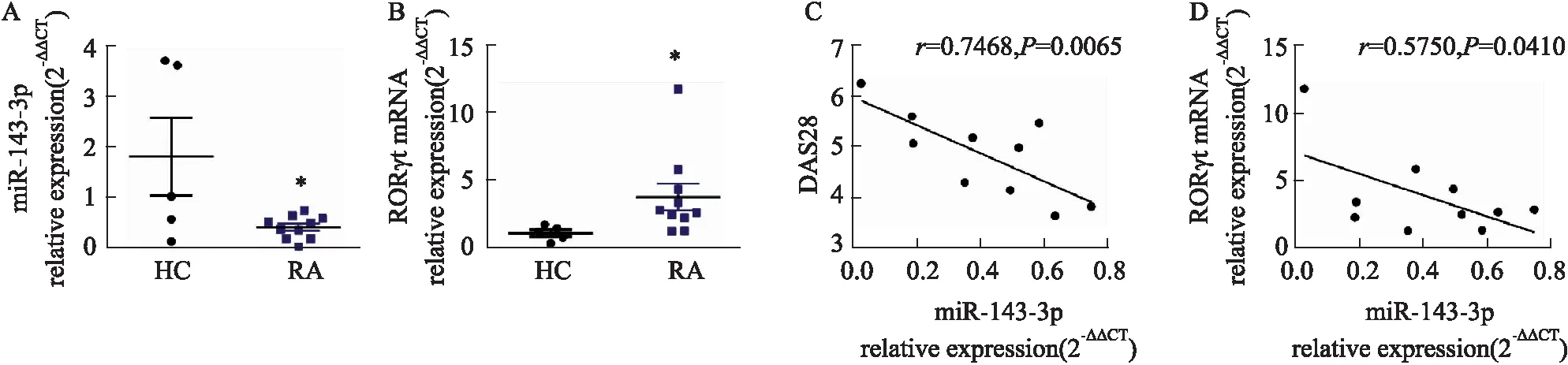
Fig 1 Correlation analysis of miR-143-3p and RORγt, DAS28 from RA patients HC: n=5; RA: n=10)(A-B) The relative expression of miR-143-3p and RORγt mRNA in peripheral blood CD4+T cells of RA patients and HCs was detected by RT-qPCR. *P<0.05 vs HC group by student′s t-test. (C) The correlation between miR-143-3p expression and DAS28 and RORγt mRNA expression. The Pearson correlation coefficient was determined.
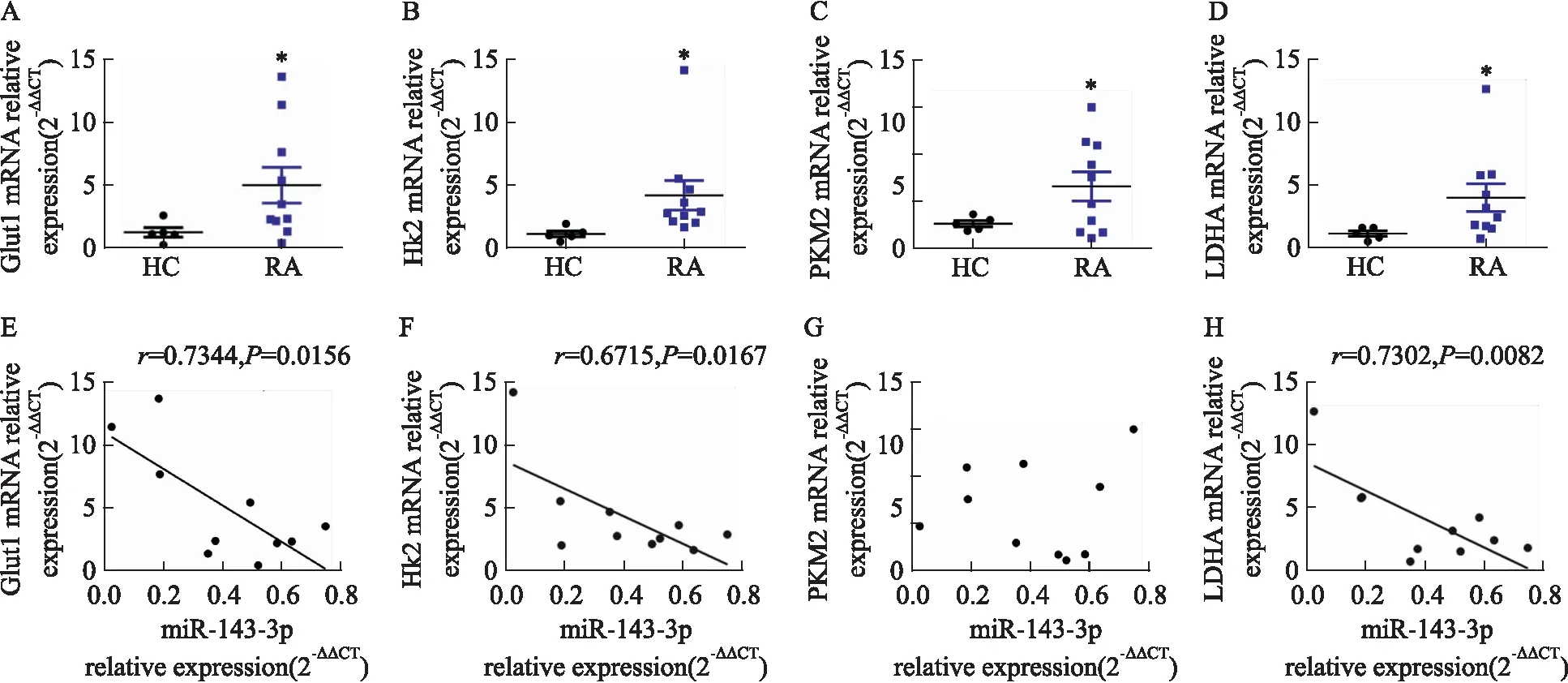
Fig 2 Correlation analysis of Glut1, HK2, PKM2, LDHA mRNA relative expression and miR-143-3p from RA patients HC: n=5; RA: n=10)(A-D) The mRNA relative expression of Glut1, HK2, PKM2 and LDHA in peripheral blood CD4+T cells of RA patients and HCs was detected by RT-qPCR. *P<0.05 vs HC group by student’s t-test. (E-H) The correlation between miR-143-3p expression and Glut1, HK2, PKM2, LDHA mRNA expression. The Pearson correlation coefficient was determined.
2.2 MiR-143-3p异常表达对Th17分化及细胞糖酵解的影响如Fig 3所示,Th17细胞转染miR-143-3p inhibitor后,miR-143-3p表达较Control组明显降低(P<0.05),转染miR-143-3p mimics后,miR-143-3p表达较Control组明显升高(P<0.01),表明转染成功;如Fig 4所示,转染miR-143-3p inhibitor后,RORγt mRNA水平及上清IL-17A水平较Control组明显升高(P<0.05),转染miR-143-3p mimics后,RORγt mRNA水平及上清IL-17A水平较Control组明显降低(P<0.05),提示miR-143-3p能够负调控Th17细胞分化及分泌活性;同时,如Fig 5所示,Th17细胞转染miR-143-3p inhibitor后,Glut1、HK2、LDHA mRNA水平较Control组明显升高(P<0.01),其细胞培养上清中丙酮酸水平也明显升高(P<0.05);而在转染miR-143-3p mimics后,HK2、LDHA mRNA水平较Control组明显下降(P<0.01),其细胞培养上清中乳酸水平也明显下降(P<0.05),提示miR-143-3p能够负调控Th17的细胞糖酵解。

Fig 3 The mRNA relative expression of miR-143-3p in miR-143-3p mimics/inhibitor-transfected Th17 cells n=3)*P<0.05,**P<0.01 vs control group.
Fig 4 The mRNA relative expression of RORγt and level of IL-17A in miR-143-3p mimics/inhibitor-transfected Th17 cells n=3)CD4+T cells were transfected with miR-143-3p mimics or inhibitor for 12 h, then cultured with the condition of Th17-polarization for 72 h. (A) The mRNA relative expression of RORγt in CD4+T cells was detected by RT-qPCR. (B) The IL-17A levels in cell supernatant was determined by ELISA. *P<0.05,**P<0.01 vs control group by one-way ANOVA with Dunnett′s post-hoc test.

Fig 5 The mRNA relative expression of Glut1, HK2, LDHA and levels of pyruvate, lactate in miR-143-3p mimics/inhibitor-transfected Th17 cells n=3)CD4+T cells were transfected with miR-143-3p mimics or inhibitor for 12 h, then cultured with the condition of Th17-polarization for 72 h. (A) The mRNA relative expression of Glut1, HK2 and LDHA in CD4+T cells was detected by RT-qPCR. (B-C) The pyruvate and lactate levels in cell supernatant. *P<0.05,**P<0.01 vs control group by one-way ANOVA with Dunnett′s post-hoc test.
2.3 CAT对miR-143-3p表达和Th17细胞分化的影响如Fig 6所示,与Control组比较,CAT处理后Th17细胞分化比例、IL-17A分泌水平、RORγt mRNA表达水平均呈剂量依赖性下降(P<0.01),提示CAT可明显抑制Th17细胞分化和分泌活性;而与Control组相比,CAT处理后miR-143-3p表达水平呈剂量依赖性上升(P<0.01),提示CAT可促进Th17细胞中miR-143-3p表达,见Fig 7。

Fig 6 Frequency of Th17 cells and level of IL-17A and RORγt mRNA relative expression after CAT treatment n=3)CD4+T cells (with the condition of Th17-polarization) were treated with CAT (20, 40, 80 mg·L-1) for 72h. (A-B) Representative dot plots and the percentage of Th17 (CD4+IL-17A+) cells was determined by flow cytometry. (C) The mRNA relative expression of RORγt in CD4+T cells was detected by RT-qPCR. (D) The IL-17A levels in cell supernatant was determined by ELISA. *P<0.05,**P<0.01 vs control group by one-way ANOVA with Dunnett's post-hoc test.
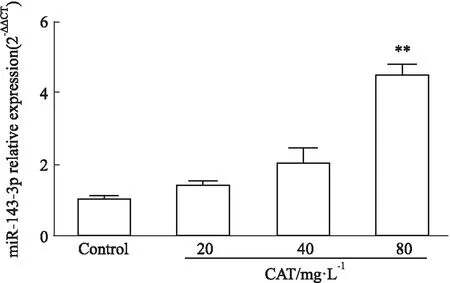
Fig 7 The mRNA relative expression of miR-143-3p after CAT treatment n=3)**P<0.01 vs control group.
2.4 CAT对Th17细胞糖酵解的影响如Fig 8所示,与Control组比较,CAT处理后糖酵解关键酶HK2、LDHA mRNA表达水平呈剂量依赖性降低(P<0.01),糖酵解代谢产物丙酮酸、乳酸也同样随剂量依赖性下降(P<0.05),提示CAT可显著抑制Th17的细胞糖酵解。

Fig 8 The mRNA relative expression of Glut1, HK2, LDHA and levels of pyruvate, lactate after CAT treatment n=3)CD4+T cells (with the condition of Th17-polarization) were treated with CAT (20, 40, 80 mg·L-1) for 72h. (A) The mRNA relative expression of Glut1, HK2 and LDHA in CD4+T cells was detected by RT-qPCR. (B-C) The pyruvate and lactate levels in cell supernatant. *P<0.05,**P<0.01 vs control group by one-way ANOVA with Dunnett′s post-hoc test.
2.5 CAT对miR-143-3p低表达状态下Th17细胞分化的干预作用如Fig 9所示,与Control组比较,miR-143-3p inhibitor组miR-143-3p表达明显降低(P<0.05),提示转染成功,而miR-143-3p inhibitor结合CAT给药组较miR-143-3p inhibitor组miR-143-3p表达明显升高(P<0.01),提示CAT可恢复Th17细胞中miR-143-3p的被抑制状态;同时,与miR-143-3p inhibitor组比较,miR-143-3p inhibitor结合CAT给药组Th17细胞分化比例、IL-17A分泌水平、RORγt mRNA水平均明显降低(P<0.01),并恢复至与Control组同等的水平(Fig 10),提示CAT可明显抑制miR-143-3p低表达状态下Th17细胞的异常分化。
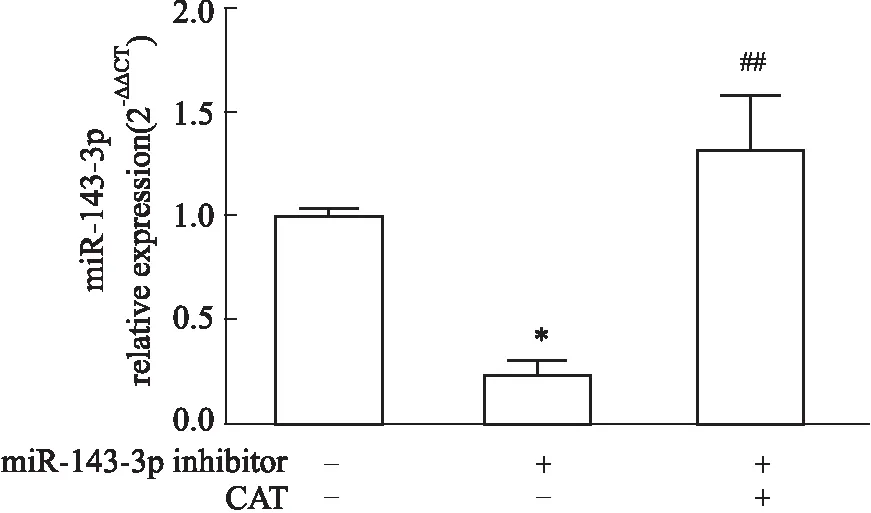
Fig 9 The mRNA relative expression of miR-143-3p in miR-143-3p low expression-Th17 cells after CAT treatment n=3)*P<0.05 vs control group; ##P<0. 01 vs miR-143-3p inhibitor group.

Fig 10 Frequency of Th17 cells and level of IL-17A and RORγt mRNA relative expression in miR-143-3p low expression-Th17 cells after CAT treatment n=3)CD4+T cells were transfected with miR-143-3p inhibitor for 12 h, then treated with CAT (40 mg·L-1) under the condition of Th17-polarization for 72 h. (A-B) Representative dot plots and the percentage of Th17 (CD4+IL-17A+) cells was determined by flow cytometry. (C) The mRNA relative expression of RORγt in CD4+T cells was detected by RT-qPCR. (D) The IL-17A levels in cell supernatant was determined by ELISA. **P<0.01 vs control group; ##P<0.01 vs miR-143-3p inhibitor group by one-way ANOVA with Dunnett′s post-hoc test.
2.6 CAT对miR-143-3p低表达状态下Th17细胞糖酵解的干预作用进一步验证CAT调控miR-143-3p对Th17分化的干预作用是否与细胞糖酵解有关。如Fig 11所示,与miR-143-3p inhibitor组比较,miR-143-3p inhibitor结合CAT给药组HK2、LDHA mRNA表达水平(P<0.01),代谢产物丙酮酸、乳酸水平均明显降低(P<0.05),其抑制程度与control组类似,提示CAT可恢复miR-143-3p低表达状态下Th17细胞的糖酵解异常上调。
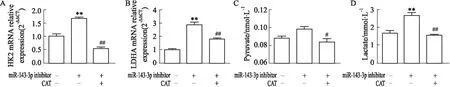
Fig 11 The mRNA relative expression of HK2, LDHA and levels of pyruvate, lactate in miR-143-3p low expression-Th17 cells after CAT treatment n=3)CD4+T cells were transfected with miR-143-3p inhibitor for 12 h, then treated with CAT (40 mg·L-1) under the condition of Th17-polarization for 72h. (A-B) The mRNA relative expression of HK2 and LDHA in CD4+T cells was detected by RT-qPCR. (C-D) The pyruvate and lactate levels in cell supernatant. **P<0.01 vs control group; ##P<0. 01 vs miR-143-3p inhibitor group by one-way ANOVA with Dunnett′s post-hoc test.
3 讨论
Th17细胞作为CD4+T细胞中特异性分泌IL-17的细胞亚群,不仅可以清除细胞外细菌及霉菌,也可介导机体炎症反应、自身免疫及移植排斥反应。RA是目前常见的自身免疫性疾病,大量研究表明Th17细胞的异常分化可影响RA的疾病进程,因此,调控Th17细胞的过度分化是RA免疫治疗的研究热点。前期项目组研究已发现,CAT可明显下调胶原诱导关节炎(CIA)小鼠中Th17细胞的分化及分泌活性,有效缓解小鼠关节炎症的进展[10]。本研究结果同样显示,生地中主要活性成分CAT可在体外显著抑制Th17细胞分化比例,下调Th17细胞特
征性转录因子RORγt mRNA水平,减少Th17细胞特征性细胞因子IL-17A分泌,进一步证明CAT可显著抑制Th17细胞的分化和功能。但CAT调控Th17细胞分化的作用机制目前尚不明确。
miRNA是一种保守的内源性非编码RNA,其调控作用几乎涉及包括细胞增殖分化、细胞间信号通路传导、自噬、凋亡在内的所有生物学过程,是CD4+T细胞分化与效应功能发挥的重要调节剂[11]。项目组前期针对RA患者、CIA小鼠外周血miRNAs表达进行检测,共筛选出包括miR-143-3p在内的6种miRNAs存在表达失调[12],其中miR-143-3p作为一种典型的多功能microRNA,已被证实在多种自身免疫性疾病及炎症模型(RA、慢性结肠炎、胶原诱导小鼠关节炎模型等)中表达出现异常下调[13-15]。同时,多项研究显示,miR-143-3p可抑制Th17细胞分化所需的IL-6、IL-23分泌[16]。结合项目组前期发现CAT可显著促进CD4+T细胞中miR-143-3p表达,本实验进一步尝试研究CAT通过miR-143-3p调控Th17细胞分化的作用机制。
本研究结果提示,与健康对照组比较,RA患者CD4+T细胞中miR-143-3p表达明显下降,Th17特异性转录因子RORγt mRNA表达明显升高,且miR-143-3p表达与RORγt水平、疾病严重度DAS28均呈负相关,提示RA患者CD4+T细胞中存在miR-143-3p的表达异常,这可能是RA中Th17异常分化、疾病持续发展的关键因素之一;进一步建立体外诱导Th17细胞分化模型,并结合慢病毒转染诱导miR-143-3p的高表达/低表达,发现过表达miR-143-3p后,RORγt mRNA水平及IL-17A分泌水平均显著降低,反之则显著升高,表明miR-143-3p可负调控Th17细胞分化及分泌活性,可成为Th17介导的RA疾病治疗的有效靶点。因此,本实验继续在miR-143-3p低表达细胞模型的基础上,结合CAT给药,以进一步观察CAT对miR-143-3p抑制状态下Th17细胞分化的调控作用。实验结果显示,与miR-143-3p inhibitor组比较,miR-143-3p inhibitor结合CAT给药组miR-143-3p的表达明显上调,表明CAT可明显逆转Th17细胞分化过程中miR-143-3p的异常下调。同时,与miR-143-3p inhibitor组比较,miR-143-3p inhibitor结合CAT给药组Th17细胞分化比例、IL-17A分泌水平、RORγt表达水平均明显降低,表明CAT通过诱导miR-143-3p表达来抑制CD4+T细胞向Th17细胞亚群分化。然而,miR-143-3p潜在的调节范围仍不确定,一种miRNA往往可以与多种基因相互作用,一种基因也往往含有多个miRNA识别位点。因此,接下来本实验重点关注miR-143-3p是通过何种途径调控Th17细胞的分化和功能。
多项研究表明,RA疾病进展与病灶处CD4+T细胞的代谢变化特点密切相关,由于RA关节滑膜腔是一个相对缺氧的局部微环境,导致了CD4+T细胞从氧化磷酸化向糖酵解的代谢转换,而糖酵解的异常上调则可诱导CD4+T细胞向致炎性的Th17细胞亚群的持续分化,加重滑膜炎症[17]。miRNAs可通过复杂的机制调控细胞代谢过程,包括直接靶向代谢过程的关键分子(转运体或酶/激酶)和调节多种信号通路[5]。而miR-143-3p作为调控抑癌基因的非编码小RNA,已被发现能够直接靶向HK2的转录表达,抑制肿瘤细胞糖酵解,减缓其增殖能力[18]。结合CAT对糖脂代谢的调控作用,推测CAT调控miR-143-3p对Th17细胞分化的干预作用是否与糖酵解有关。
本研究结果提示,RA患者外周血CD4+T细胞中糖酵解关键酶Glut1、HK2、LDHA mRNA表达显著上调,且与miR-143-3p呈负相关,提示RA患者CD4+T细胞中的糖酵解失调可能与miR-143-3p有关;慢病毒转染诱导Th17细胞体外分化过程中miR-143-3p的高表达/低表达,发现抑制miR-143-3p后,Glut1、HK2、LDHA mRNA水平及丙酮酸、乳酸分泌较Control组显著升高,反之则明显降低,表明miR-143-3p可以负调控Th17细胞糖酵解。结合该调控机制的研究结果,研究进一步观察了CAT对Th17细胞体外分化过程中糖酵解的影响,结果显示,CAT处理后Th17细胞中糖酵解酶HK2、LDHA的mRNA水平以及代谢产物丙酮酸、乳酸的分泌水平均呈剂量依赖性下降,表明CAT可显著下调Th17分化过程中的细胞糖酵解。结合慢病毒转染诱导miR-143-3p的低表达,发现与miR-143-3p inhibitor组比较,miR-143-3p inhibitor结合CAT给药组HK2、LDHA mRNA水平,丙酮酸、乳酸分泌水平均明显降低,表明CAT可恢复miR-143-3p低表达状态下的糖酵解异常上调和Th17细胞异常分化。
综上所述,本研究证实miR-143-3p可负调控Th17细胞分化及分泌活性,可成为Th17介导的RA疾病治疗的有效靶点,且miR-143-3p对Th17细胞的调控作用可能与其糖酵解有关。CAT可上调miR-143-3p,同时抑制Th17细胞的异常分化和糖酵解异常上调,表明CAT可通过调控miR-143-3p,抑制细胞糖酵解并干预Th17的异常分化,这可能是生地调节机体免疫平衡,发挥抗炎作用的重要机制之一,这为生地在RA等自身免疫病中的合理应用提供了实验基础。
