槲皮素对Aβ25-35诱导的PC12细胞线粒体途径凋亡的雌激素样神经保护作用
2022-07-11赵雨薇戴月英甄艳杰沈丽霞
赵雨薇,戴月英,甄艳杰,李 炜,沈丽霞
(河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口 075000)
阿尔茨海默病(Alzheimer’s disease,AD),以渐进性记忆缺失和行为异常为主要临床表现的中枢神经系统退行性疾病[1]。引起AD的机制尚不明确,主要存在诸如氧化应激、线粒体损伤、Aβ毒性等假说,Aβ沉积、神经炎症的发生和氧化应激等均会引起线粒体损伤[2],线粒体因其能控制细胞的能量状态和细胞凋亡,被认为在调节衰老和与年龄相关的神经元变性中发挥中央细胞器作用[3]。线粒体电子因在衰老组织中的运输效率较低,损害ATP的合成从而导致氧化剂产生增加[4],这种变化可能引起细胞凋亡而致大脑衰老,造成认知功能丧失[5]。以往的研究表明[6],Aβ诱导破坏膜的性质和改变线粒体的动力学,引发线粒体膜电位的崩溃,诱导释放因子透过线粒体膜于细胞质中,发生凋亡级联反应,促进AD的发生和发展[7]。
槲皮素(quercetin,Que)结构与雌二醇类似,是一种天然的植物雌激素,在改善心血管疾病和神经系统方面有一定作用[8]。课题组前期研究表明,Que可通过雌激素受体介导信号通路的激活,减少Aβ25-35毒性损伤的PC12细胞凋亡[9]。根据往期实验结果,本实验继续采用20 μmol·L-1Aβ25-35毒性损伤的PC12细胞作为AD体外模型,17β-雌二醇(17β-estradiol,17β-E2)与50 μmol·L-1金雀异黄素(genistein,Gen)作为阳性对照,进一步探讨Que通过雌激素受体介导线粒体途径的机制而抑制Aβ25-35毒性损伤引起的细胞凋亡。
1 材料与方法
1.1 材料
1.1.1细胞株 PC12细胞,中国科学院昆明细胞库。
1.1.2药物与试剂 槲皮素(100081-201610)和金雀异黄素(111704-201703)购于中国药品生物制品检定研究所;Aβ25-35(Y0044)购于北京博奥森;Rhodamine 123(C2007)购于碧云天生物技术;Bradford蛋白浓度测定试剂盒(BCA法)(BL521A)购于Biosharp公司;琥珀酸脱氢酶(SDH)测试盒(A022)和超微量Na+,K+-ATP酶测试盒(A070-2)购于南京建成生物工程研究所;CyTM3-conjugated Affini Pure Goat Anti-Mouse IgG(101887)购于Jackson Immuno Research 公司;辣根过氧化物酶标记羊抗鼠二抗 IgG(H+L)(4103945)购于 Novus Biologicals 公司;β-action(SC47778)购于联科生物公司;17β-雌二醇(ab120657)、雌激素受体完全拮抗剂ICI182,780(ab120131)、anti-Estrogen Receptor alpha antibody(ab32063)、anti-Estrogen Receptor beta antibody(ab3576)、Anti-Bcl-2 antibody(ab59348)、Anti-Bax antibody(ab182733)、Anti-active caspase-3 antibody(ab49822)、重组Anti-Cytochrome C antibody(ab133504)购于美国Abcam公司;
1.1.3仪器 CO2培养箱(Thermo 公司);超速冷冻离心机(Sigma公司);激光共聚焦显微镜(OLYMPUS公司);荧光倒置显微镜(Nikon公司);体视学显微镜(Leica公司);多功能酶标仪(Tecan公司);化学发光凝胶成像系统(Protein Simple公司)。
1.2 方法
1.2.1线粒体膜电位的测定 细胞以每孔1×104的密度接种于培养皿24 h后。实验分组为Control组、Aβ25-35毒性损伤组、Aβ25-35与17β-E2、Gen、Que(40、60、80 μmol·L-1)分别共孵育组,给药24 h后,加入37 ℃预温育的Rhodamine 123染色液1 mL,作用20 min后;DAPI复染,使用激光共聚焦显微镜进行观察拍照。
1.2.2SDH的测定 细胞以1×108L-1密度将接种于6孔细胞培养板中,实验分组为Control组、Aβ25-35毒性损伤组、Aβ25-35与17β-E2、Gen、Que(40、60、80 μmol·L-1)分别共孵育组和雌激素受体完全拮抗毒性损伤组。按说明书提取分离各组线粒体,获取各组线粒体悬液,按照SDH测试盒测定线粒体SDH活力。
1.2.3Na+,K+-ATP 酶活力的测定 细胞以1×108L-1密度将接种于6孔细胞培养板中,实验分组同“1.2.2”,按照Na+,K+-ATP酶测试盒测定线粒体Na+,K+-ATP酶活力。
1.2.4Western blot检测相关蛋白 细胞分组同“1.2.2”,提取各组细胞总蛋白,BCA法定量各组蛋白,制胶,上样,BIO-RAD凝胶电泳和转膜,室温封闭液封闭2 h后,加入一抗 β-actin(1 ∶500)、雌激素受体 α / β(1 ∶500)、Bcl-2(1 ∶1 000)、Bax(1 ∶2 000)、caspase-3(1 ∶600)、Cytochrome C(1 ∶5 000),4 ℃孵育过夜。TBST进行清洗3次(每次10 min)。室温孵育二抗(Goat anti-mouse IgG/HRP,1 ∶4 000)2 h。TBST 进行清洗3次(每次10 min),使用ECL曝光显影后,分析各组条带灰度值。

2 结果
2.1 Que 对线粒体膜电位的影响与正常对照组相比,毒性损伤组荧光较强,差异具有统计学意义(P<0.01);与毒性损伤组相比,Aβ25-35+17β-E2、Aβ25-35+Gen、Aβ25-35+Que(60 μmol·L-1)组荧光强度均明显降低(P<0.01)(Fig 1A,B)。表明Que 可改善Aβ25-35毒性损伤造成的PC12细胞内线粒体膜电位降低,作用与阳性药17β-E2和Gen效果相似。
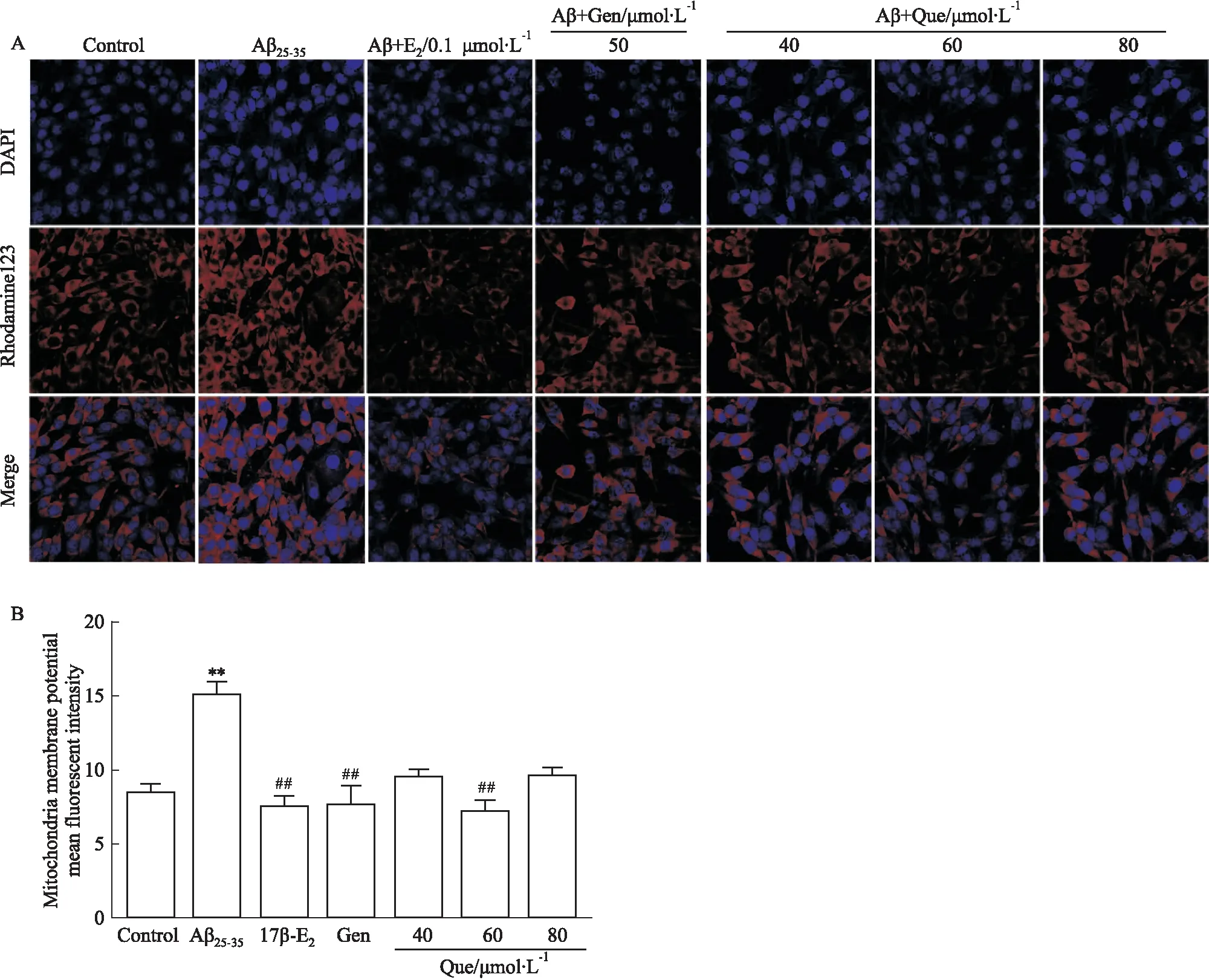
Fig 1 Effect of Que and Aβ25-35 on mitochondrial membrane potential in PC12 cells(×600)A:Fluorescence of mitochondrial membrane potential of PC12 cells; B: Quantification of the mitochondrial membrane potential mean fluorescent n=4). **P<0.01 vs control; ##P<0.01 vs Aβ25-35
2.2 Que对毒性损伤的PC12细胞线粒体影响
2.2.1Que对线粒体SDH酶活力的影响 如Fig 2A中所示,与正常组相比,Aβ25-35毒性损伤组 SDH 活力水平明显减少(P<0.01)。低中高剂量浓度的 Que(40、60和80 μmol·L-1)和 Aβ25-35共孵育24 h后的细胞 SDH 活力水平与毒性损伤组相比明显增加(P<0.01)。提示Que可提高PC12损伤细胞的线粒体琥珀酸脱氢酶活力,效果与17β-E2和Gen相似。

Fig 2 Effect of Que on SDH activity on PC12 n=4)A: Effect of Que on PC12 cell SDH activity injured by Aβ25-35 toxicity. B: Effect of Que on PC12 cell SDH activity pretreated with ICI182,780. *P<0.05,**P<0.01 vs control; ##P<0.01 vs Aβ25-35; △△P<0.01 vs Aβ25-35+Que(60 μmol·L-1)
含有ICI182,780抑制剂预处理组中,Aβ25-35+ICI182,780+Que组细胞的线粒体琥珀酸脱氢酶活力与Aβ25-35+Que相比明显被抑制(P<0.01)(Fig 2B),表明在Que提高PC12损伤细胞的线粒体 SDH 酶活力过程中,具有ER受体通路的参与。
2.2.2Que对线粒体Na+,K+-ATP酶活力影响 如Fig 3A中所示,Aβ25-35+Que(40、60和80 μmol·L-1)组Na+,K+-ATP活力分别为(1.38±0.03)U·mgprot、(1.71±0.04)U·mgprot和(1.28±0.05)U·mgprot,与毒性损伤组相比差异有统计学意义(P<0.01)。结果表明,Que 可提高毒性损伤的PC12细胞内线粒体Na+,K+-ATP酶活力,效果与17β-E2和Gen相似。

Fig 3 Effect of Que on Na+,K+-ATPase activity on PC12 n=4)A: Effect of Que on PC12 cell Na+,K+-ATPase activity injured by Aβ25-35 toxicity. B: Effect of Que on PC12 cell Na+,K+-ATPase activity pretreated with ICI182,780. **P<0.01 vs control; ##P<0.01 vs Aβ25-35; △△P<0.01 vs Aβ25-35+Que(60 μmol·L-1)
含有ICI182,780抑制剂预处理组中,Aβ25-35+ICI182,780+Que 组细胞线粒体的Na+,K+-ATP 酶活力与Aβ25-35+Que组相比被明显抑制(P<0.01)(Fig 3B),表明ER受体通路的阻断影响了Que 对 Na+,K+-ATP酶活力的保护。
2.3 Western blot 检测 ERα、ERβ 以及 Bcl-2、Bax、active-caspase-3 与 Cytochrome C蛋白表达与正常对照组相比,毒性损伤组明显下调ERα表达(P<0.01),阳性药(17β-E2、Gen)和Que分别与Aβ25-35共同孵育后,均明显升高了ERα表达(P<0.01),而毒性损伤组和药物(17β-E2、Gen和Que)+Aβ25-35共同孵育后ERβ蛋白组间表达差异无显著性(P>0.05)(Fig 4A,B,C)。药物(17β-E2、Gen和Que)+Aβ25-35组与毒性损伤组相比,上调了Bcl-2表达(P<0.05)(Fig 5A,B),下调Bax、active-caspase-3 与Cytochrome C蛋白的表达(P<0.05)(Fig 5A、C,Fig 5A、E,Fig 5A、F),提高了Bcl-2 / Bax蛋白表达比率(P<0.01)(Fig 5A、D)。使用ICI182,780抑制剂进行干预进一步探讨Que神经保护作用机制。结果发现,Aβ25-35+Que(60 μmol·L-1)组与毒性损伤组相比,Bcl-2蛋白表达上调(P<0.01)(Fig 6A,B),Bax、active-caspase-3与Cytochrome C蛋白表达下调(P<0.01)(Fig 6A、C,Fig 6A,E,Fig 6A,F),且Bcl-2 / Bax比率上升(P<0.01)(Fig 6A、D);而ICI182,780+Aβ25-35组和ICI182,780+Aβ25-35+Que组与毒性损伤组相比线粒体凋亡关键蛋白表达差异无统计学意义(P>0.05)。提示Que可通过激活经典雌激素受体,抑制线粒体凋亡途径关键蛋白的表达。

Fig 4 Effect of Que and Aβ25-35 on protein levels of ERα and ERβ in PC12 n=3)A: Detection of protein levels of ERα and ERβ by Western blot; B: Quantification analysis of ERα level; C: Quantification analysis of ERβ level. *P<0.05 vs control; ##P<0.01 vs Aβ25-35
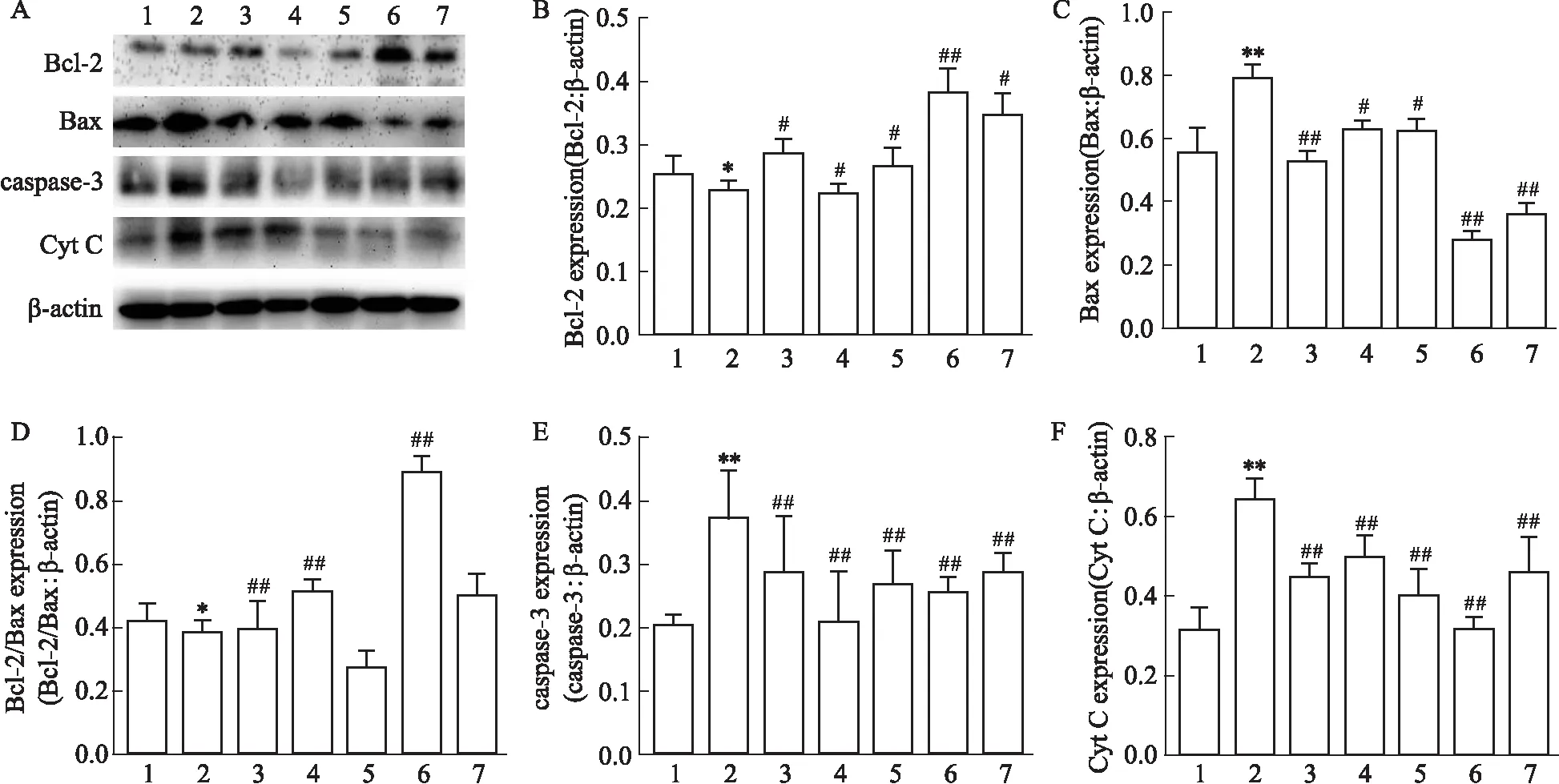
Fig 5 Effect of Que and Aβ25-35 on protein levels of Bcl-2, Bax, active-caspase 3 and cytochrome C in PC12 n=3)1: Control; 2:Aβ25-35; 3:17β-E2; 4: Gen; 5: Que/40 μmol·L-1; 6: Que/60 μmol·L-1; 7: Que/80 μmol·L-1. A: Detection of protein levels of Bcl-2, Bax, active-caspase 3 and Cytochrome C by Western blot; B: Quantification analysis of Bcl-2 level; C: Quantification analysis of Bax level; D: Quantification analysis of Bcl-2/Bax level; E: Quantification analysis of active-caspase- 3 level; F: Quantification analysis of cytochrome C level. *P<0.05,**P<0.01 vs control; #P<0.05,##P<0.01 vs Aβ25-35
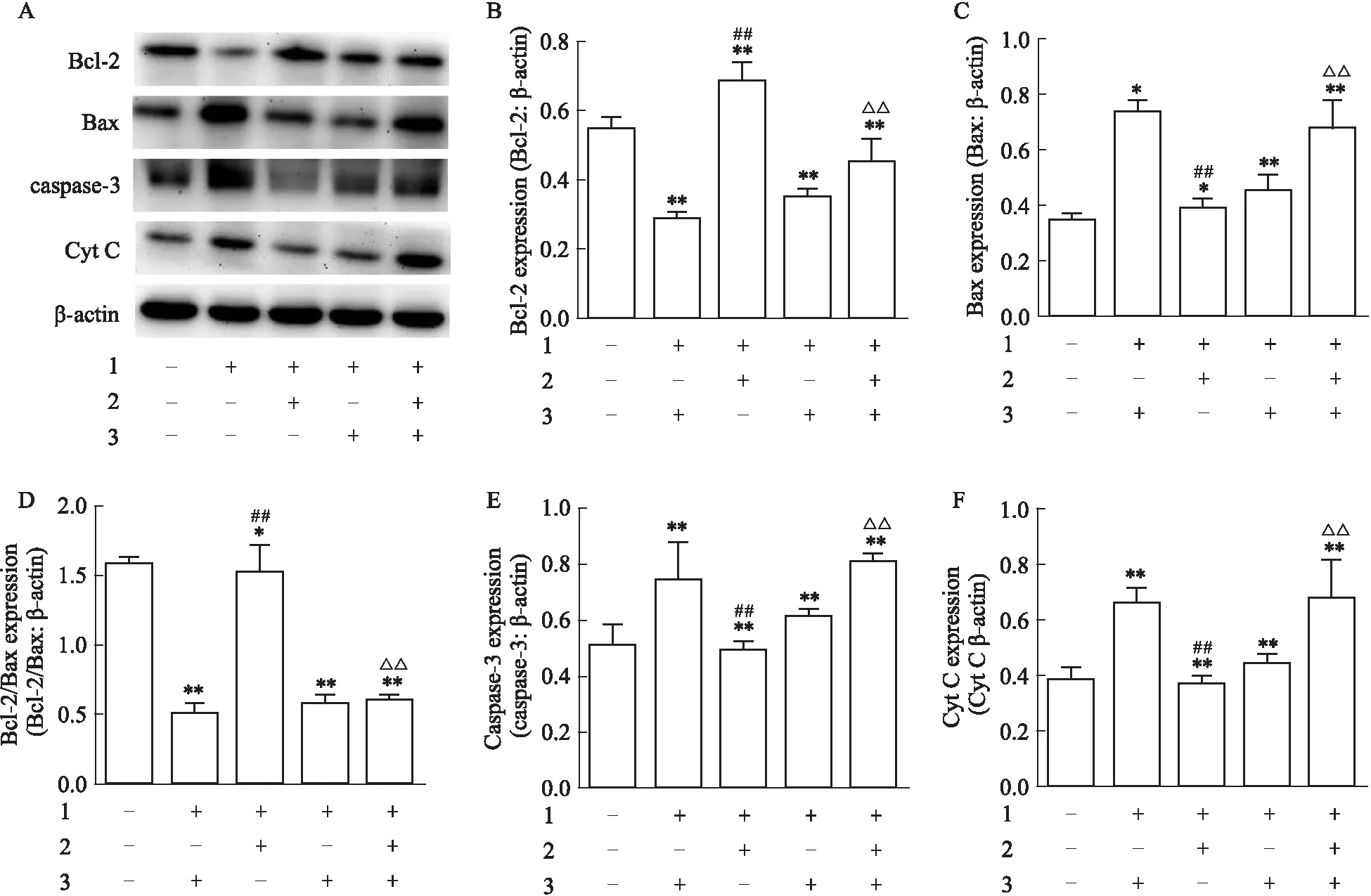
Fig 6 Effect of Que and Aβ25-35 on protein levels of Bcl-2, Bax, active-caspase- 3 and cytochrome C in PC12 cells pretreated with ICI182,7801: Aβ25-35/20 μmol·L-1; 2: Que/60 μmol·L-1; 3: ICI/1 μmol·L-1. A: Detection of protein levels of Bcl-2, Bax, active-caspase- 3 and cytochrome C by Western blot; B: Quantification analysis of Bcl-2 level; C: Quantification analysis of Bax level; D: Quantification analysis of Bcl-2/Bax level; E: Quantification analysis of active-caspase- 3 level; F: Quantification analysis of cytochrome C level. *P<0.05,**P<0.01 vs control; ##P<0.01 vs Aβ25-35;△△P<0.01 vs Aβ25-35+Que(60 μmol·L-1)
3 讨论
大量研究表明,雌激素通过多种机制发挥神经保护作用,但由于雌激素的不良反应造成临床应用存在争议,研究探讨雌激素神经保护作用的靶点,进一步认识神经系统疾病发生与发展机制,开发防治神经退行性疾病的雌激素受体调节剂,从而有可能为临床上AD等神经系统疾病的防治提供新的策略和思路。越来越多的证据表明,AD患者脑内细胞淀粉样蛋白沉积出现之前,线粒体功能障碍是认知老化和AD发病的早期事件,线粒体损伤又进一步诱导细胞凋亡和神经元丢失,加剧AD的进展。减轻线粒体功能障碍并提供神经保护作用的药物有望用于AD治疗。因此,改善线粒体损伤成为AD防治需要关注的问题。我们实验研究揭示了Que可通过介导ERα作用于线粒体靶点起到神经保护作用,从分子角度为 Que 在治疗AD和线粒体途径凋亡相关的神经退行性疾病的潜在应用提供实验依据。
由线粒体主导的细胞凋亡过程中关键环节为Cytochrome C的释放,当细胞受到外界刺激产生凋亡信号,促进Bax过表达,并移位到线粒体膜上,打破线粒体膜电位的平衡,建立释放因子通道,释放Cytochrome C,与胞质中caspase-9前体结合形成凋亡体,增强caspase-3活性,促进细胞凋亡。而激活Bcl-2可以抑制各种刺激引起的caspase-3凋亡途径和Cytochrome C的释放,并且Bcl-2 / Bax表达比值与线粒体膜通透性成正相关。本实验表明,Que能够明显促进Bcl-2蛋白表达,升高线粒体膜电位,下调Bax、active-caspase-3的表达,减少Cytochrome C的释放,调控Aβ25-35造成的细胞凋亡。另外,实验发现Que还可提高毒性损伤的细胞内线粒体琥珀酸脱氢酶(SDH)活力和线粒体Na+,K+-ATP酶活力,保证胞内能量代谢正常运行,维持线粒体环境稳态。
研究发现Bcl-2基因序列上含有雌激素反应位点,雌激素抑制细胞凋亡作用可能通过与ER结合直接促进Bcl-2的表达[10]。有证据已表明雌激素可通过介导ER调节线粒体功能障碍,以线粒体为靶向抑制H2O2诱导的神经元凋亡[11]。为探讨Que保护PC12细胞免受Aβ25-35造成的线粒体损伤是否通过介导雌激素受体,采用Aβ25-35毒性损伤处理PC12,Western blot 检测到毒性损伤组ERα表达与对照组相比明显下调,Que、17β-E2、Gen和Aβ25-35分别共同孵育后,与Aβ25-35毒性损伤组相比ERα表达量明显升高,ERβ 表达量组间无差异,表明Que可通过与17β-E2、Gen相似的保护作用机制,减少Aβ25-35毒性损伤造成的细胞凋亡;加入ICI182,780抑制剂进行干预后发现ICI182,780预孵育可减弱Que的抗凋亡作用,以及扭转Que对线粒体功能的保护和线粒体凋亡相关蛋白表达的影响。
