三七总皂苷通过调节TLR4/TLR2-NF-κB信号通路对再生障碍性贫血小鼠骨髓造血功能的影响
2022-07-11陈姗姗吴泽彬张小敏朱玲玲
陈姗姗,吴泽彬,张小敏,马 坤,朱玲玲,3
(南方医科大学 1. 中医药学院,2. 广州中医药大学金沙洲医院血液科,广东 广州 510000; 3. 南方医科大学南方医院中医科,广东 广州 510515)
再生障碍性贫血(aplastic anemia,AA)是一种由多种原因引起,以全血细胞减少、骨髓增生减低为特征的骨髓衰竭综合征。AA发病主要涉及造血干细胞缺陷、造血微环境异常、免疫功能紊乱等因素,其中,免疫功能紊乱是AA发病的关键环节[1]。既往研究主要集中于T细胞亚群异常及细胞因子水平紊乱,近年来,作为启动和调控T细胞免疫应答的树突状细胞(dendritic cell,DC)在AA发病中的作用不断被发现且重视[2],SAA患者骨髓中异常活化的DC数量增加和细胞表面共刺激分子异常表达,诱导骨髓中T细胞异常活化,进而引起一系列免疫亢进反应。T淋巴细胞亚群异常、细胞因子紊乱,以及Fas/Fasl凋亡通路和Toll样受体4(toll-like receptor 4,TLR4)/核转录因子-κB(nuclear factor-κB,NF-κB)促炎信号通路[3]等多条信号通路的异常激活共同参与AA免疫异常,其中TLR4/NF-κB信号通路的激活还与DC异常活化关系密切[4],且Toll样受体2(toll-like receptor 2,TLR2)能和TLR4共同介导跨细胞膜免疫信号[5]。然而,TLR4与TLR2激活后涉及多条下游信号通路,其中影响AA发病的具体作用靶点尚不清楚。
临床治疗AA的主要手段包括造血干细胞移植、免疫抑制疗法和对症治疗等,环孢素(cyclosporine A,CsA)是治疗AA的主要药物之一,具有免疫抑制作用,可抑制异常活化的T细胞,降低TNF-α、IFN-γ、IL-2等炎症细胞因子水平,一定程度上能够改善AA病理状态,可作为AA小鼠模型的阳性对照药物,用于抗AA药物的筛选[6]。CsA作为AA免疫抑制治疗的主要药物,然而其反应率约为70%,仍有30%患者对免疫抑制治疗无反应,并且患者复发率较高。中医药治疗AA疗效确切,并且具有改善药物不良反应、提高患者生存质量等优点,挖掘能够改善或扭转AA免疫紊乱的中药及其有效成分对改善AA疗效具有重要意义。《本草纲目》记载:“三七止血、散血、定痛。”三七总皂苷(Panaxnotoginsengsaponins,PNS)是中药三七的主要活性成分,主要包括皂苷单体Rb1、Rg1、Re及三七皂苷R1SE等,在心脑血管疾病、肿瘤、器官间质性疾病等方面具有广泛应用,现代药理研究表明,PNS具有改善微循环、抗凝、抗炎、抗氧化等作用[7],能够通过调节NF-κB、MAPKs、TGF-β/Smad以及Fas/Fasl等信号通路和细胞因子水平发挥免疫调节作用[8]。有研究发现PNS能够通过调节T细胞亚群和外周血清TNF-α、IFN-γ水平来改善AA小鼠造血功能[9],然而,PNS调节AA骨髓造血功能的具体信号通路尚不完全清楚,本文旨在通过建立再生障碍性贫血小鼠模型,观察PNS对AA小鼠造血及免疫功能的调节作用,并探索具体机制,进一步明确AA发病机制和PNS作用靶点,从而为PNS的临床应用提供一定的理论依据。
1 材料与方法
1.1 实验动物C57BL/6♀小鼠,SPF级,8~10周龄,体质量(18~20)g,共49只,购自浙江维通利华实验动物技术有限公司,合格证号:SCXK(浙)2019-0001,饲养在SPF级动物房内。FVB ♀小鼠,SPF级,8周龄,共10只,购自广东省医学实验动物中心,动物合格证号:SYXK(粤)2016-0167。
1.2 药物与试剂PNS(生产批号:18101001,上海源叶公司);CsA(注册证号:H20140288,Novartis Pharma Schweiz AG);白介素2(interleukin-2,IL-2)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素10(interleukin-10,IL-10)ELISA试剂盒(宏清生物科技,货号分别为:HQ-20010、HQ-20220、HQ-20005);CD11c、MyD88、Akt、NF-κB、MAPK、β-actin一抗(批号分别为:97585S、4283S、4691T、6956S、8690T、8457S、CST),TLR4、TLR2一抗(批号分别为:A17436、A11225,Abclonal),二抗(33101ES60,Yeasen/翊圣)。
1.3 仪器辐照仪(Multi Rad);轮转石蜡切片机(Leica);血细胞计数仪(迈瑞BC-5000全自动血细胞分析仪);光学显微照相系统(日本Olympus);全自动成像仪(ProteinSimple)。
1.4 方法
1.4.1动物分组与AA模型建立 按随机数字表法,将受体C57BL/6小鼠分为正常组(Control)、单纯辐照组(TBI)、模型组(Model)、环孢素治疗组(CsA)、PNS低剂量(PNS-L)、中剂量(PNS-M)、高剂量(PNS-H)组,每组7只。颈椎脱位法处死供体FVB小鼠,于体积分数75%乙醇中浸泡5 min,无菌操作取颈部、腋下、肠系膜淋巴结及胸腺,加PBS缓冲液轻轻研磨后,200目筛网过滤,按胸腺细胞 ∶淋巴结细胞=1 ∶2制成淋巴细胞混悬液(浓度为2×1010·L-1),台盼蓝测定细胞活性(活性>95%)。TBI组、模型组和给药组小鼠经5.0 Gy X-ray全身均匀照射,模型组和给药组小鼠于辐照后4 h内经尾静脉输入FVB小鼠淋巴细胞混悬液0.2 mL/只,含4×106个淋巴细胞。造模后d 1开始给药,PNS低、中、高剂量组小鼠分别灌胃50、100、200 mg·kg-1的PNS,CsA治疗组小鼠灌胃25 mg·kg-1的CsA,正常组、TBI组和模型组小鼠灌胃等体积的生理盐水,连续给药/生理盐水15 d。
1.4.2外周血细胞检测与骨髓单个核细胞(BMCs)计数 在连续给药或等剂量生理盐水15 d后,摘眼球取血法收集外周血于EDTA抗凝管中,取0.2 mL外周血用全自动细胞分析仪检测外周血细胞中白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)数量。取右侧股骨,用PBS缓冲液反复冲洗骨髓腔直至股骨发白,留取骨髓细胞悬液,各组配平至同等体积,取0.2 mL细胞悬液裂解红细胞后,自动细胞计数仪计数BMCs数量。
1.4.3骨髓病理学检查 取小鼠胸骨浸泡于脱钙液中至股骨软化后,用自来水浸泡2 h后,置于4%多聚甲醛固定72 h,经乙醇梯度脱水、石蜡包埋、半薄切片及苏木精-伊红染色后,光学显微镜下观察各组骨髓病理学变化。
1.4.4体质量变化情况、胸腺比、脾脏比 各组小鼠于造模后每2 d称量体质量,观察体质量变化情况,麻醉前称重,处死后取小鼠脾脏和胸腺,分别称量质量,计算脾脏指数及胸腺指数,脏器指数=脏器质量(mg)/体质量(g)。
1.4.5小鼠外周血清中IL-2、TNF-α、IL-10水平测定 小鼠摘眼球取血,EDTA抗凝管收集外周血,4 ℃、3 000 r·min-1离心15 min,收集上清,采用ELISA试剂盒检测小鼠外周血清IL-2、TNF-α、IL-10水平,通过吸光度-浓度曲线计算质量浓度,单位ng·L-1。
1.4.6骨髓中TLR4/TLR2-NF-κB信号通路相关蛋白检测 取左侧股骨,用PBS缓冲液反复冲洗骨髓腔直至股骨发白,留取骨髓细胞悬液,4 ℃、1 000 r·min-1离心5 min,弃上清,细胞沉淀加入RIPA裂解液,4 ℃充分裂解20 min,4 ℃、12 000 r·min-1离心15 min,取上清液,采用BCA蛋白定量试剂盒检测骨髓蛋白浓度,蛋白变性后各取20 μg蛋白进行SDS-PAGE电泳,转膜至PVDF膜,4 ℃孵育一抗过夜,TBST洗膜后4 ℃孵育二抗2 h,TBST洗膜,ECL显色在全自动成像仪上曝光检测条带,用ImageJ软件进行条带灰度分析。

2 结果
2.1 各组小鼠一般情况各组小鼠均无死亡,TBI组和模型组小鼠体质量无明显增加,表现为倦怠、食欲及精神状态较差,活动减少等,d 15,正常组和模型组小鼠出现明显的平均体质量差异(P<0.01),见Fig 1。给药前后相比,与正常组比较,模型组和PNS高剂量组小鼠体质量明显降低(P<0.05);与模型组相比,PNS中剂量组小鼠体质量增加明显(P<0.05);CsA组和PNS低剂量组小鼠体质量一定程度增加,但差异无统计学意义(P>0.05),PNS高剂量组小鼠体质量明显降低(P<0.05)。见Tab 2。

Fig 1 Mice body weight change curve over time ##P<0.01 vs Control group; *P<0.05 vs Model group.
2.2 各组小鼠外周血WBC、RBC、Hb、PLT水平及骨髓BMCs数量水平与正常组比较,TBI组和模型组小鼠外周血WBC、RBC、Hb、PLT及BMCs水平明显降低(P<0.05);与模型组比较,PNS中剂量组小鼠外周血RBC、Hb、PLT水平明显升高(P<0.05),PNS各剂量组小鼠外周血WBC升高,但差异无统计学意义(P>0.05)。PNS低、中、高剂量组小鼠BMCs数量均明显升高(P<0.05),CsA组小鼠BMCs水平增加,但差异无统计学意义(P>0.05);不同剂量PNS组间比较差异无统计学意义(P>0.05),见Tab 1。
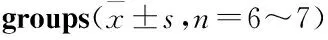
Tab 1 Number of WBC,RBC,HGB,PLT and BMCs levels of mice in various
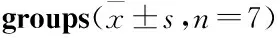
Tab 2 Body weight change,body weight,spleen indexes and thymus indexes of mice in various
2.3 各组小鼠胸骨骨髓病理形态学变化正常组小鼠胸骨骨髓腔内造血组织结构完整,造血细胞分布均匀,未见明显脂肪细胞,造血细胞增殖旺盛;TBI组和模型组小鼠骨髓有核细胞明显减少,巨核细胞缺如,大量脂肪空泡代替造血细胞及组织。与模型组相比,CsA组和PNS各剂量组小鼠骨髓有核细胞均有不同程度增加,非造血组织面积减小;其中,中剂量的PNS对AA小鼠骨髓抑制情况改善程度最明显。见Fig 2。

Fig 2 Bone marrow pathology in various groups (HE staining×200)A:Control group; B:TBI group; C:Model group; D:CsA treatment group; E:PNS low-dose group; F:PNS medium-dose group; G:PNS high-dose group.
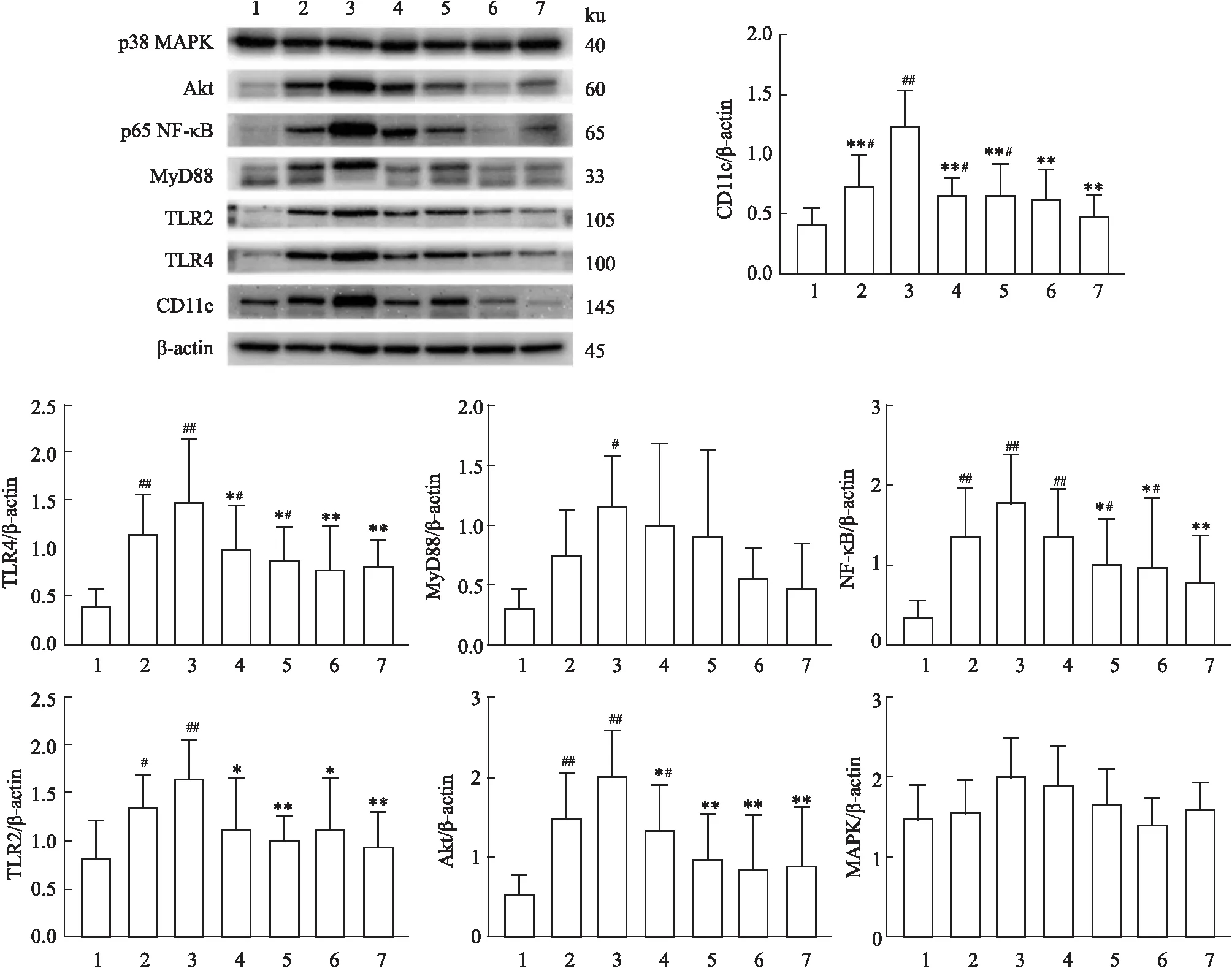
Fig 3 Protein expression and quantitative analysis of CD11c,TLR4,TLR2,MyD88,NF-κB,Akt and MAPK in bone 1:Control group; 2:TBI group; 3:Model group; 4:CsA treatment group; 5:PNS low-dose group; 6:PNS medium-dose group; 7:PNS high-dose group. #P<0.05,##P<0.01 vs Control group; *P<0.05,**P<0.01 vs Model group.
2.4 各组小鼠脾脏指数和胸腺指数变化与正常组比较,TBI组和模型组小鼠胸腺指数明显降低(P<0.01),模型组小鼠脾脏指数明显升高(P<0.01);与TBI组相比,模型组小鼠脾脏指数明显升高(P<0.01);与模型组比较,PNS中剂量组小鼠胸腺指数明显升高(P<0.05),PNS低、高剂量组胸腺指数升高,但差异无统计学意义(P>0.05);CsA组和PNS各剂量组脾脏指数均明显降低(P<0.05),见Tab 2。
2.5 各组小鼠血清TNF-α、IL-2、IL-10水平与正常组比较,模型组小鼠血清中TNF-α、IL-2水平明显升高(P<0.05),IL-10水平明显降低(P<0.05);与模型组比较,CsA组和PNS各剂量组小鼠外周血清IL-2水平均明显降低(P<0.05);CsA组和PNS中剂量组TNF-α明显降低(P<0.05),PNS低、高剂量组无明显变化;CsA组和PNS高剂量组IL-10水平明显升高(P<0.05),PNS低、中剂量组IL-10升高,但差异无统计学意义(P>0.05);与CsA组相比,PNS各剂量组IL-2水平明显降低(P<0.05),PNS各剂量组IL-10水平明显升高(P<0.05);随着PNS剂量增加,PNS降低外周血清IL-2、TNF-α水平和升高IL-10水平均未见明显剂量依赖性,见Tab 3。
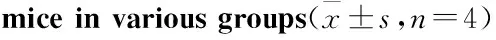
Tab 3 Levels of IL-2,TNF-α and IL-10 in serum of
2.6 各组小鼠骨髓中CD11c及TLR4/TLR2-NF-κB通路相关蛋白表达情况与正常组相比,TBI组CD11c、TLR4、TLR2、NF-κB、Akt和模型组小鼠骨髓中CD11c、TLR4、TLR2、MyD88、NF-κB、Akt蛋白表达明显升高(P<0.05);与TBI组相比,模型组CD11c表达显著升高(P<0.01);与模型组相比,CsA组CD11c、TLR4、TLR2、Akt和PNS各剂量组小鼠骨髓中CD11c、TLR4、TLR2、NF-κB、Akt蛋白表达均明显降低(P<0.05),但不同剂量PNS组间比较差异无统计学意义(P>0.05),并且MAPK蛋白表达无明显变化;与阳性对照药CsA组相比较,PNS治疗后蛋白表达不存在明显统计学差异(P>0.05)。见Fig 3。
3 讨论
AA是一种致病因素多、致病机制复杂的难治性骨髓衰竭性疾病,阐明AA的致病机制和挖掘有效治疗药物对于其临床诊疗具有重要意义。AA的主要特征是骨髓造血障碍和全血细胞减少,同时伴有免疫功能异常。既往研究表明,AA因各种因素出现骨髓造血缺陷,外周三系降低,机体贫血状态可引起骨髓祖细胞大量迁出骨髓,在脾脏中聚集,导致脾脏增大,脾脏中红细胞聚集和机体异常的免疫状态也会进一步加重贫血[10],因此,脾脏肿大的程度可在一定程度上反映骨髓造血障碍和机体贫血水平。IL-2、TNF-α是具有抗造血作用的细胞因子[11],研究表示AA患者骨髓上清液TNF-α、IL-2水平均升高,且骨髓中免疫亢进和造血功能破坏程度和IL-2水平呈正相关;IL-10降低和Treg数量减少也参与AA的发生与发展[12],均可作为检验AA严重程度和治疗预后的指标。本实验中,我们通过X射线辐照结合混合淋巴细胞输注造模[13]15 d后,单纯辐照和模型小鼠外周血三系、BMCs水平和胸腺指数明显降低,骨髓正常造血组织破坏,另外,模型小鼠还表现出脾脏指数明显升高,外周血清IL-2、TNF-α、IL-10水平紊乱等,表明我们成功建立免疫介导的AA小鼠模型,这与国内外大量文献报道相符[14]。
CD11c常作为DC的特异性标记分子[15],成熟的DC表面高表达CD11c,能提供T淋巴细胞活化所必须的信号分子,从而打破自身免疫耐受状态,激发自身免疫反应[16]。因此,CD11c表达水平在一定程度上能够反映成熟DC的数量。TLR4作为经典的模式识别受体之一,对于DC成熟活化和机体特异性免疫应答都具有重要作用,TLR4可通过MyD88依赖途径或TRIF依赖途径,促进Akt、MAPK生成,引起NF-κB释放[17],进而参与造血功能调节和淋巴系及髓系等增殖分化,并调节多种造血调控因子的分泌,如IL-2、TNF-α等,TLR2与TLR4具有协同作用,TLR4/TLR2-NF-κB促炎信号通路的过度激活与AA造血障碍密切有关。那么PNS能否通过调节TLR4/TLR2-NF-κB信号通路从而减轻免疫介导AA小鼠骨髓免疫亢进,值得深入探索。
本实验发现,单纯辐照和模型小鼠均出现骨髓中CD11c及TLR4/TLR2-Akt-NF-κB信号通路相关蛋白过度表达,但免疫介导的AA模型小鼠CD11c、TLR2、MyD88蛋白表达增加更为明显,且伴有外周血清细胞因子分泌紊乱,说明辐照和造模后都会引起免疫状态异常,但AA模型小鼠免疫亢进则更为明显。给予PNS或CsA干预15 d后,骨髓造血组织和功能均有所恢复,外周血三系及BMCs水平升高,贫血状态改善,血清细胞因子紊乱和脾脏肿大等免疫异常状态有所改善,且PNS降低IL-2水平的效果优于CsA。另外,PNS干预后,AA小鼠骨髓中CD11c、TLR4、TLR2、Akt、NF-κB蛋白表达明显下降,而MyD88和MAPK无明显下降,且其抑制作用与阳性对照药CsA相当。说明PNS对AA小鼠的治疗作用,可能通过调节TLR4/TLR2-NF-κB信号通路部分蛋白的活化,而不依赖MyD88途径,以及降低骨髓中成熟DC的数量,并改善IL-2、TNF-α等造血负调控因子水平,从而减轻异常免疫亢进对造血干/祖细胞的破坏,缓解AA小鼠的造血功能。
综上所述,PNS对免疫介导的AA小鼠模型骨髓破坏具有一定改善作用,并能减轻造血负调控因子的水平,使AA从免疫亢进趋于免疫稳态,其作用机制可能涉及对骨髓中TLR4/TLR2-Akt-NF-κB信号通路和专职抗原提呈细胞DC数量及活化的调控。
