双表型鼻窦肉瘤1例并文献复习
2022-07-11王志颐王天友
张 婷,王志颐,程 友,王天友,吴 楠
(1.东部战区总医院耳鼻咽喉—头颈外科,江苏 南京 210002;2.东部战区总医院病理科,江苏 南京 210002)
双表型鼻窦肉瘤(biphenotypic sinonasal sarcoma,BSNS)为低度恶性肿瘤,伴有神经及肌源性分化特征,主要侵犯前组鼻窦,特别是鼻腔和筛窦。Lewis等[1]于2012年对28例患者的临床表现、病理学特点、免疫组化结果以及2例患者的细胞遗传学和分子遗传学结果进行综合分析后,首次将该类疾病命名为“低级别鼻腔鼻窦肉瘤伴有神经和肌源性特征”。Wang等[2]于2014年提出了“BSNS”的概念。2017年世界卫生组织将该肿瘤写入第4版头颈部肿瘤分类[3]。BSNS术前诊断困难,主要依靠病理学确诊,易与梭形细胞肿瘤混淆;其治疗方法以手术为主,但易复发,目前对该病的诊疗认识不够充分。我院收治1例BSNS患者,现通过分析其临床资料并结合文献复习,总结该病的临床特征、病理学特点、治疗及预后,以期为其诊疗提供参考。
1 资料与方法
患者,女,66岁,于2018年8月因“头晕、头痛1个月”至我院就诊。患者自诉24年前及16年前因右鼻反复出血于外院行右侧鼻腔新生物切除术,术后病理提示右鼻血管瘤梭形细胞肿瘤。患者曾于2011年9月因“右侧鼻腔反复出血”至我院就诊,查体发现右侧鼻腔红色血管瘤样新生物,嗅觉初测减退,术前鼻窦CT提示右侧上颌窦、筛窦及蝶窦腔见软组织密度影,右侧筛窦及蝶窦可见囊状液性密度影,右侧上颌窦内侧壁及右侧蝶窦下壁受压,窦壁骨质破坏(图1a);行右侧鼻腔鼻窦新生物切除术,术中见右侧嗅区、后组筛窦表面红色血管瘤样新生物,质韧,易出血,右侧蝶窦腔内黏膜肿胀,术后病理示:右鼻血管梭形细胞肿瘤。本次入院后行鼻窦CT检查发现右侧筛窦及蝶窦占位(图1b)。行手术治疗,术中见右侧后组筛窦、蝶窦表面红色新生物,质韧,易出血,蝶窦腔内有大量黏稠分泌物。术后HE染色检查提示鼻腔鼻窦(肿瘤):低级别梭形细胞肿瘤(图2a、b);免疫组化染色提示:肿瘤细胞β-catenin(细胞浆3+),S-100(2+),TLE1(2+),SMA(1+),MyoD1(散+),CD34(-,血管+),Desmin(-),SOX10(-),STAT6(-),CD117(-),Dog-1(-),CKpan(-),Ki-67(约10%+),见图2c、d;分子病理FISH检测提示:未见SYT基因断裂,SYT基因断裂阴性(图2e)。结合该患者病史、HE染色、免疫组化染色及分子病理学检查结果,考虑诊断为BSNS。
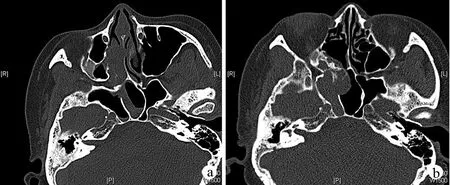
a:第3次术前CT;b:术前CT水平位示右侧后筛及蝶窦占位图1 术前鼻窦CT
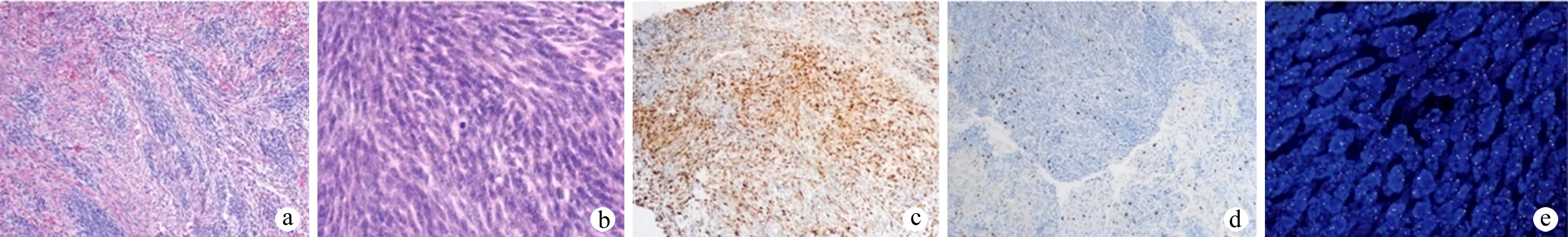
a:肿瘤细胞核细长,呈束状排列,局部呈波浪状,形态温和(HE染色×100);b:肿瘤细胞核局部见核分裂(HE染色×400);c:S-100呈弥漫阳性(免疫组化染色×100);d:Ki-67散在阳性(免疫组化染色×100);e:分子病理FISH检测提示SYT基因断裂阴性(×400)图2 术后病理
2 结果
患者术后鼻窦CT示:鼻窦肉瘤术后改变,右侧上颌窦、右侧筛窦及蝶窦局部黏膜增厚,伴局部右侧筛板骨质密度增高(图3a)。术后1个月鼻内镜复查见术腔较多血性干痂附着(图3b);术后2个月鼻内镜复查见右侧蝶窦及筛窦开放良好,术腔黏膜光滑,未见明显新生物(图3c);术后2年鼻内镜复查见术腔黏膜上皮化良好(图3d)。

a:术后鼻窦CT;b:术后1个月鼻内镜检查;c:术后2个月鼻内镜检查;d:术后2年鼻内镜检查图3 术后鼻窦CT及鼻内镜检查
3 讨论
BSNS是一种低度恶性肿瘤,好发于中年女性。本例患者于第4次手术后确诊为BSNS,但根据患者既往的临床表现及第3次手术病理结果,我们推测该患者可能前3次诊断均为BSNS,即前3次可能为误诊,但由于前3次手术时间间隔较远,无法获得确切的临床及病理资料,因此无法验证该推测。Lewis等[1]在提出BSNS的概念时就认为该肿瘤可能并不是一种罕见的恶性肿瘤,以往的大多数病例可能被误诊为纤维肉瘤或低度周围神经鞘瘤,在纳入的28例患者中,有3例曾被诊断为纤维肉瘤,2例诊断为周围神经起源的神经鞘瘤。BSNS患者通常先出现鼻窦炎的症状,包括鼻塞、面部胀满感和充血,有时会出现面部疼痛、轻度溢泪或嗅觉减退,甚至是头晕、头痛等,还可能反复出现鼻出血,所以易被误诊为血管瘤。BSNS好发于鼻腔和筛窦,偶发于额窦、蝶窦及上颌窦,可涉及鼻腔鼻窦的一个或多个区域[4],肿瘤组织会向周围结构延伸和扩展,包括鼻中隔、鼻咽部、口咽部等,有时会侵犯眼眶,甚至是颅穹窿,严重者会导致颅内出血。Fudaba等[5]报道了1例复发性BSNS侵犯左侧额颅窝导致脑叶出血及硬膜下血肿的患者,该患者第1次手术后曾被诊断为滑膜肉瘤。BSNS呈缓慢进行性生长,伴有局部结构的侵袭性和复发性,BSNS局部复发率为 44%~50%;目前尚无远处转移的案例,仅有2例死亡的案例报道,1例患者第2次复发时侵犯至颅穹窿,由于持续性颅内肿瘤于复发后8个月死亡[6],另1例患者在颅内肿瘤根治手术后死于术后并发症[7]。
影像学上,CT显示BSNS相应部位软组织占位,涉及一个或多个窦腔,随着肿瘤的侵袭生长伴有不同程度的骨质破坏和周围软组织占位。MRI可以比较清晰地显示病变侵及的范围,但目前尚无相关文献对其MRI表现作具体描述,仅Fudaba等[5]的报道中提及BSNS肿瘤组织MRI的T2加权像与脑实质相比,表现为稍高信号。BSNS的影像学表现并无明显特异性,其诊断依赖于病理学检查。
BSNS肿块呈红色、棕褐色或灰白色息肉样新生物,有时表现为红色血管瘤样肿块[8],肿瘤直径最大可达6.5 cm[9],表面可有黏液性或脓性分泌物,质软,触之不易出血[1,10]。本病例表现为质韧、易出血,可能是多次复发及手术导致大体形态有所改变。组织学上,BSNS由梭形细胞组成,呈浸润性生长,肿瘤细胞显示出高度均匀的细长核;在少数情况下,细胞核局部可呈波浪状弯曲,罕见有丝分裂,常见由表面型呼吸上皮组成的良性上皮增生,在黏膜表面形成小腺体和囊性空腔。免疫组化为S-100、SMA或calponin呈共同阳性表达,以及较少见的Desmin和myogenin(后者仅在个别细胞中表达),部分案例也有TLE1表达,大多数BSNS中β-catenin呈弥漫或局灶性核表达,而SOX10呈阴性表达[1,11-12]。同时,Fudaba等[5]发现与第1次手术后病理结果相比,BSNS复发肿瘤的有丝分裂数和Ki-67指数略有增加。分子病理学上,BSNS多表现为PAX3-MAML3基因融合,少数表现为PAX3-FOXO1或PAX3-NCOA1基因融合[13]。
鉴别诊断:BSNS需与纤维肉瘤、滑膜肉瘤、恶性周围神经鞘瘤以及其他良恶性梭形细胞肿瘤相鉴别,临床表现及影像学并无明显特异性,主要依靠病理学确诊。
我们对目前已报道的99例病例及本病例进行分析发现,患者发病年龄为24~87岁,69%(69/100)为女性,男女比例约为1∶2,其中,女性发病年龄大多集中于40~60岁,中位年龄为47岁。在有随访资料的50例患者中,随访时间为1个月至28年,16例患者术后出现复发,最短复发时间为11个月,最长为11年。BSNS目前尚无统一及规范的治疗方法,大多数病例行鼻内镜下完整的肿物切除术,3例患者肿瘤侵犯眼眶行眼眶内容物摘除术,3例患者行扩大颅颌面联合切除术,1例因肿瘤侵犯颅内导致脑出血而行颅骨成骨开颅术,切除颅内肿瘤及血肿,并于鼻内镜下完整切除鼻腔鼻窦肿瘤后通过颅骨瓣进行颅底重建。部分患者行术后放疗或联合放化疗,但目前并没有明确的证据证明其对预后有影响,1例患者虽行术后放疗,但于第1次手术后11、21、24个月均出现复发,其后随访40个月并未出现再次复发,其他行术后放疗或联合放化疗的患者在随访期间未复发。因此,我们认为,由于BSNS的疾病特点,早期诊断,早期完整切除肿瘤及术后积极的随访是目前比较合适的治疗方法,但是否在术后进行放化疗有待进一步研究。
BSNS的发病、治疗及预后目前并不清楚,且多数患者没有完整的随访资料,因此,为了进一步明确BSNS的病因及预后,需要进行多中心大样本的研究及长期有效的随访。
