迷迭香酸通过FOXO3a/VEGF信号通路对高糖环境下人视网膜微血管内皮细胞的保护作用及机制研究
2022-07-09王化湘刘光化简唯求彭辉灿李姣
王化湘 刘光化 简唯求 彭辉灿 李姣
近年来,随着人们生活水平的提高,糖尿病在全球范围内的发病率逐年上升[1]。作为一种严重危害人类健康的慢性代谢性疾病,糖尿病在发展过程中可能伴随着肾功能衰竭、心血管疾病、视力损害等一系列并发症[2,3],给糖尿病患者带来极大的负担。其中糖尿病视网膜病变是糖尿病患者出现视力损害最严重的并发症[4],其病理改变是由于人视网膜微血管内皮细胞(Human retinal micro- vascular endothelial cells,HRMEC)过度增殖导致的新血管生成,严重者甚至会导致视力完全丧失[5]。有研究发现,其可能与视网膜组织血管内皮生长因子(Vascular endothelial growth factor,VEGF)异常表达有关,过度的VEGF表达能够刺激血管内皮细胞,提高其增殖与迁移能力,从而形成新的血管[6]。叉头框转录因子O3a(Forkhead box O3a,FOXO3a)是近些年来发现的一种新的转录因子,在动物中参与生长发育、细胞分化、代谢凋亡、信号转导、转录和免疫等多种生物学进程,近期在血管生成过程中同样发现FOXO3a发挥了一定的作用[6]。迷迭香酸是一种多酚酸,在现代药理学研究中发现其具有抗炎、抗肿瘤、抗氧化、抗病毒等多种功能[7]。目前有研究表明迷迭香酸能够抑制VEGF的表达,对肿瘤细胞的增殖有抑制作用[8],但对于糖尿病视网膜病变影响的相关研究较少。因此本实验以HRMEC为研究对象,以高糖培养基模拟糖尿病高糖环境[9],通过分子生物学技术分析迷迭香酸对高糖环境下HRMEC的影响及与FOXO3a/VEGF信号通路相关的可能机制,以期为糖尿病视网膜病变的临床治疗提供新的思路与理论依据。
1 材料与方法
1.1 实验试剂 人视网膜微血管内皮原代细胞购自上海中科院细胞库;迷迭香酸购自上海恒斐生物科技有限公司;VEGF、FOXO3a、PCNA、CDK2、Cyclin A1抗体及辣根过氧化物酶标记的山羊抗鼠IgG二抗购自北京博奥森生物技术有限公司;β-actin抗体购自美国贝博生物科技有限公司;PCR引物合成自上海生工生物工程股份有限公司;Trizol Reagent总RNA提取试剂盒购自美国英杰公司;MTT分析试剂盒购自艾博抗(上海)贸易有限公司;细胞周期检测试剂盒购自上海碧云天生物技术有限公司;DMSO购自北京索莱宝生物科技有限公司;DMEM培养基购自赛默飞世尔科技(中国)有限公司;Western Blot相关试剂购自上海碧云天生物技术有限公司;胎牛血清购自美国Sigma公司;蛋白电泳仪与转膜仪购自美国Bio-Rad公司。
1.2 细胞培养 将HRMEC置于加入了青霉素(100U/ml)、链霉素(0.1mg/ml)及10%胎牛血清的DMEM培养基的培养皿中,设置培养箱培养条件:37℃,含5%CO2;传代条件:细胞密度>80%,以1:3的比例进行传代培养。当细胞处于对数生长期时进行试验。
1.3 实验分组及处理 将处于对数生长期的HRMEC分为6组。空白组:在原培养基中进行培养;低糖组:在加入低糖培养液(0.5mmol/L)的培养基中进行培养;高糖组:在加入高糖培养液(25mmol/L)的培养基中进行培养;低剂量迷迭香酸组:在高糖培养液中加入12.5μmol/L迷迭香酸进行培养;中剂量迷迭香酸组:在高糖培养液中加入25μmol/L迷迭香酸进行培养;高剂量迷迭香酸组:在高糖培养液中加入50μmol/L迷迭香酸进行培养。
1.4 MTT检测HRMEC增殖活性 取处于对数生长期的各组HRMEC,使其解离后以5×103细胞/孔的密度在96孔细胞培养板上进行培养,每组细胞设置5个复孔,在培养板边缘孔中加入无酶水防止液体蒸发。将细胞继续培养24、48、72h后取出,随后向每孔中避光加入20μl的MTT粉剂溶液,继续培养4h后取出用PBS溶液洗涤,加入DMSO溶液20μl,使用酶标仪在490nm波长下测量光密度(OD值),OD值越大代表细胞数量越多,细胞增殖活性越强。
1.5 流式细胞术检测HRMEC周期 将经处理后的HRMEC悬液离心后弃去上清液,加入预冷70%乙醇固定细胞2h,之后弃去上清液。使用细胞周期检测试剂盒在避光环境下溶解,并恒温孵育30min后使用流式细胞仪进行周期检测,使用流式软件CytExpert对细胞周期分布结果进行处理。
1.6 Real-time PCR 将收集到的处理后的HRMEC悬液离心后弃去上清液,向沉淀中加入适量Trizol试剂,在冰上孵育5~10min后加入预冷过的氯仿0.2ml。继续冰上孵育5min后1 200r/min离心15min,转移水相,加入等体积异丙醇后再次离心10min,弃上清液。加入预冷75%乙醇溶液洗涤,弃上清液后风干,加入40~200μl的无酶水溶解制成RNA备用。通过制备的RNA反转录成cDNA,然后加入SYBR Green染料与VEGF的上下游引物混合离心(VEGF基因上游引物为5'-TCGAGACCCTGGTGGACATC-3',下游引物为5'-CACACAGGACGGCTTGAAGA-3';β-actin基 因上游引物为5'-TCAGGTCATCACTATCGGCAAT-3',下游引物为5'-AAAGAAAGGGTGTAAAACGCA-3')。随后于PCR仪上进行扩增,循环完成后做溶解曲线。以采集到的荧光信号值(Ct值)进行相对定量分析。
1.7 蛋白免疫印迹试验(Western Blot) 将收集到的处理后的HRMEC悬液离心后弃去上清液,然后加入RIPA裂解液和PMSF蛋白酶抑制剂提取总蛋白,提取出的总蛋白放入10ml EP管中,加入十二烷基磺酸钠混匀后放入95℃~100℃沸水中水煮变性后备用。将提取的总蛋白进行电泳、封闭及转膜操作。转膜后分别孵育VEGF(1:1000)、FOXO3a(1:1000)、PCNA(1:1000)、CDK2(1:1000)、Cyclin A1(1:1000)及β-actin(1:500)抗体与相对应的辣根过氧化物酶标记的二抗,最后将含有蛋白标记的膜洗净,涂上化学发光显影液后通过显影仪拍照,对结果用ImageJ软件对各组HRMEC中不同因子的相对灰度值进行系统性分析。
1.8 统计学方法 采用SPSS 22.0软件进行数据分析,结果以均数±标准差(±s)表示,数据符合正态分布,两组间均数差异比较采用t检验,多组间均值差异比较采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MTT检测在高糖环境下不同浓度迷迭香酸对HRMEC增殖活性的影响 经过MTT检测OD值发现,低糖组中各时间段HRMEC数量均少于高糖组,高糖环境下培养的HRMEC经不同浓度的迷迭香酸处理后,其细胞数量均有所降低,且随着迷迭香酸浓度的增加以及干预时间的延长,HRMEC数量显著下降,差异具有统计学意义(P<0.05)。见表1。

表1 不同时间点HRMEC数量的比较
2.2 流式细胞术检测在高糖环境下不同浓度迷迭香酸对HRMEC周期分布的影响 用CytExpert软件分析结果可发现与空白组及低糖组相比,高糖环境下HRMEC分布于S期的细胞数量显著增加,G0/G1期数量显著降低;与高糖组相比,HRMEC经不同浓度的迷迭香酸处理后分布于S期细胞数量减少,G0/G1期的细胞数量明显增加,差异具有统计学意义(P<0.05);且随着迷迭香酸浓度的增加,阻滞于G0/G1期的细胞数量明显增加。见图1。
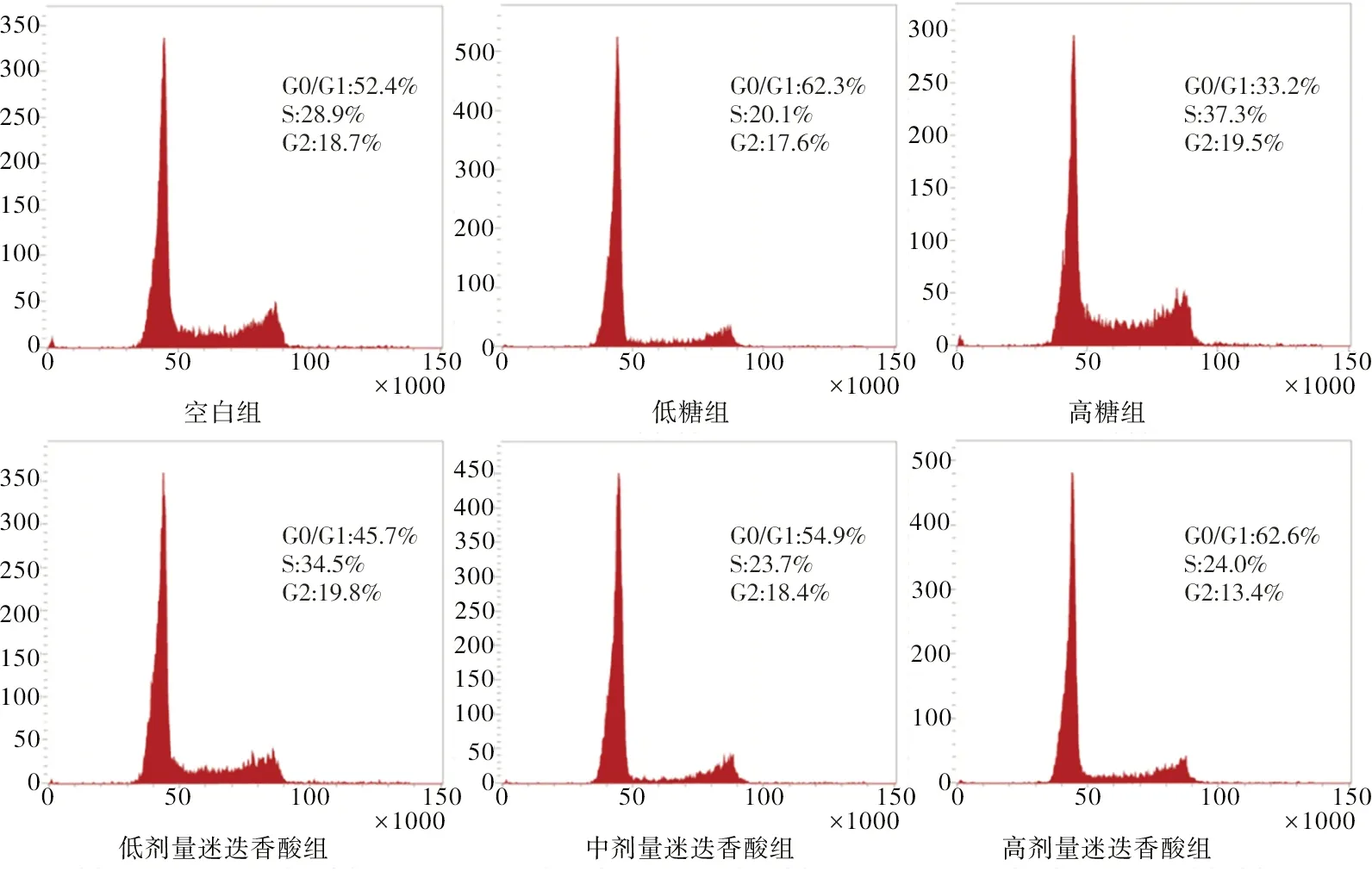
图1 各组HRMEC周期分布
2.3 Real-time PCR检测高糖环境下不同浓度迷迭香酸对HRMEC中VEGF mRNA水平的影响 RT-PCR结果显示,与空白组及低糖组相比,高糖环境下HRMEC中VEGF mRNA水平明显上升,当经过不同浓度的迷迭香酸处理后,其VEGF mRNA水平明显下降,且迷迭香酸各剂量组上述指标呈剂量依赖性降低,差异具有统计学意义(P<0.05)。见图2。

图2 各组HRMEC中VEGF mRNA水平
2.4 Western Blot检测在高糖环境下不同浓度迷迭香酸对HRMEC中VEGF蛋白表达的影响 与空白组及低糖组相比,在高糖环境下HRMEC中VEGF、FOXO3a、PCNA、CDK2、Cyclin A1各蛋白相对表达水平均明显上升(均为P<0.05);与高糖组相比,经不同浓度的迷迭香酸处理后HRMEC中 VEGF、FOXO3a、PCNA、CDK2、Cyclin A1各蛋白相对表达水平均显著受到抑制,且迷迭香酸各剂量组上述蛋白水平呈剂量依赖性降低,差异具有统计学意义(P<0.05)。见图3、4。

图3 各组HRMEC中VEGF、FOXO3a、PCNA、CDK2、Cyclin A1蛋白水平

图4 各组HRMEC中VEGF、FOXO3a、PCNA、CDK2、Cyclin A1蛋白电泳图
3 讨论
据流行病学统计,全世界范围内糖尿病的患病率目前已经超过10%[10],而在此基础上发生血管并发症的患者同样在逐年增加,其中糖尿病视网膜病变是与糖尿病患者视力相关的最严重的特征性病变,是以血管通透性增强、微血管闭塞、组织缺氧、局部缺血为特征,刺激VEGF的形成与释放,最终引起视网膜新生血管形成[11]。当发生视网膜病变时,由于新生血管内皮结构不稳定,易出现视网膜出血、水肿、积血等情况,如果不及时治疗,50%的患者将在确诊3~5年内完全丧失视力[12]。HRMEC在高糖环境下的氧化-抗氧化系统会出现紊乱,产生大量的活性氧[13],从而破坏细胞的正常功能,同时其机体炎症指标IL-1β、IL-6、TNF-α也会过表达[14]。目前临床多通过药物、激光及手术治疗糖尿病视网膜病变,但由于其病理机制复杂,常用的治疗方法难以满足全部患者的需求,因此,目前仍迫切需要进行糖尿病视网膜病变的机制研究及靶向治疗药物的开发。
迷迭香酸是一种多酚酸,广泛分布于唇形科、紫草科、葫芦科等植物中,是多种药材和中成药的主要成分,具有抗氧化、抗炎、抗肿瘤、抗病毒等多方面药理学活性,且能够在机体内相互联系,共同发挥治疗作用[15]。本研究结果发现,迷迭香酸能够明显抑制高糖环境下HRMEC的增殖活性,且随着迷迭香酸浓度的增加,其抑制效果同样增加。VEGF是参与视网膜损伤的主要标志指标,参与视网膜血管内皮连接与调节血管屏障功能[16],本研究通过在高糖环境下培养HRMEC以模拟糖尿病视网膜病变微环境,RT-PCR结果显示高糖环境下HRMEC中VEGF表达水平显著上升,这与很多研究中高血糖能够诱导HRMEC中VEGF过表达导致产生新生血管的结果一致[17,18]。此外,在一些关于神经系统的研究中发现,VEGF与神经元损害同样具有紧密联系[19],可能加重糖尿病视网膜病变患者视力的进一步损害。FOXO3a转录因子已被证实具有抑制内皮细胞增殖分化成熟、迁移及新生血管形成的作用,且FOXO3a可以对血管内皮细胞中VEGF的表达从蛋白、mRNA和基因启动子水平上发挥负调节作用,这一过程可能与FOXO3a通过与VEGF共同竞争转录激活因子FOXM1有关[20],但当其发生磷酸化时会失去转录活性[21]。在本研究中,迷迭香酸能够降低HRMEC中VEGF与FOXO3a的表达水平,且呈剂量依赖性,这可能与迷迭香酸能够抑制FOXO3a磷酸化,从而抑制VEGF的促血管形成功能有关。
细胞周期在各个时期由不同周期蛋白调控,其中G0/G1期向S期转化过程中主要由Cyclin A1与CDK2结合作用于检查点,其结合复合物具有调节DNA合成与促进细胞分裂的作用[22]。流式细胞术结果显示,高糖环境下HRMEC中周期调控蛋白Cyclin A1与CDK2的表达量显著上升,且细胞周期多分布于S期,细胞增殖循环处于活跃状态。PCNA在增殖细胞中于S期表达最高,G0/G1期表达量极低,因此能够作为细胞增殖指标[23]。在本研究中,迷迭香酸能够显著降低高糖环境下HRMEC中Cyclin A1、CDK2与PCNA的表达,且将细胞周期进程阻滞于G0/G1期,使细胞增殖受到抑制,从而降低新的血管生成。
综上所述,本研究通过建立高糖环境模拟糖尿病视网膜病变HRMEC微环境并应用迷迭香酸进行治疗,发现迷迭香酸能够通过对周期与增殖相关蛋白进行调控影响细胞周期进程,从而抑制HRMEC增殖导致的新生血管生成。本研究为开展糖尿病视网膜病变的中药治疗提供了新的思路与研究证据。
