草莓枯萎病拮抗细菌的筛选及其防治效果
2022-07-09宋新娜梅凤珍李香风朱英波史凤玉刘建斌
宋新娜,梅凤珍,李香风,朱英波,史凤玉,2*,刘建斌
(1.河北科技师范学院农学与生物科技学院,昌黎 066004;2.河北科技师范学院河北省作物逆境生物学重点实验室,昌黎 066004;3.北京市农林科学院植物营养与资源环境研究所,北京 100097;4.河北省邯郸市园林局,邯郸 056000)
草莓枯萎病是由尖孢镰刀菌草莓专化型Fusariumoxysoporumf.sp.fragariae引起的一种土传真菌病害[1],感病植株表现为全株枯黄萎蔫,最终枯死,在草莓的整个生育期内均可发生,给莓农造成巨大的经济损失。目前生产上防控草莓枯萎病多用化学杀菌剂,如百菌清、代森锰锌、甲基托布津和多菌灵等。化学杀菌剂防效虽好,但同时带来了食品安全、生态环境等问题,并且出现土壤微生态失衡、盐渍化和酸化等一系列严重问题。因此,化学防治方法越来越难以满足草莓产业健康发展的需求,寻找有效控制草莓枯萎病发生的措施刻不容缓。
生物防治对人畜安全、环境友好且不易引发抗药性[2,3],尤其芽胞杆菌Bacillussp.能够产生多种抑菌蛋白和脂肽类抗生素[4],这些物质能够抑制病原真菌的细胞壁和细胞膜合成[5]、造成细胞壁破裂[6],同时能促进作物生长和诱导植株系统抗性[7,8],利用芽胞杆菌防治植物病害已成为农业生产上最常用的生物防治技术之一[9-14]。已有研究表明,解淀粉芽胞杆菌可用于多种植物病害防治,如番茄根腐病[15]、烟草黑胫病[16]、辣椒灰霉病[17]和马铃薯黄萎病[18]等,并有一定的促生[19]和提高抗逆性作用[20]。乔欣蕾等[21]研究发现枯草芽胞杆菌对尖孢镰刀菌呈现显著的拮抗活性,而且对番茄灰霉病[22]、黄瓜白粉病[23]、巴西蕉枯萎病[24]等多种病原真菌、细菌表现出很好的抑菌活性,同时可促进番茄和辣椒植株生长,增强植物体内超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性[25]。利用生防芽胞杆菌或其代谢产物抑制病原菌,符合草莓绿色健康种植及消费者对食品安全的要求,为植物病害防治提供了新的研究方向。但由于单一生防菌在实际应用及生产中适应环境能力相对较弱,拮抗和促生作用结合较难,导致防治效果不甚理想,而通过生防菌优势互补有可能解决这些问题[26]。
本试验旨在以草莓枯萎病为靶标,从实验室已保存的细菌中筛选出生防菌,并对生防菌的相容性和防治效果进行评价,以期为草莓枯萎病的生防菌剂开发提供依据。
1 材料与方法
1.1 供试材料
1.1.1 供试品种 草莓品种为“红颜”,由北京市农林科学院植物营养与资源环境研究所提供。
1.1.2 供试病原菌 尖孢镰刀菌[27]由本实验室分离并长期保存。
1.1.3 供试拮抗菌 从土壤中分离获得且对草莓根部病害[27]和葡萄灰霉病[28]有一定拮抗效果的 15株细菌,以上菌株皆由北京市农林科学院植物营养与资源环境研究所保存并提供。
1.1.4 供试培养基 牛肉膏蛋白胨固体培养基:牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂18 g,去离子水定容至1000 mL,用于细菌的平板培养。牛肉膏蛋白胨液体培养基:不加琼脂,其他与牛肉膏蛋白胨固体培养基成分相同,用于细菌液体培养。马铃薯葡萄糖固体培养基:马铃薯200 g、葡萄糖20 g、琼脂粉20 g,去离子水定容至1000 mL,用于尖孢镰刀菌的平板培养和初筛试验。马铃薯葡萄糖液体培养基:不加琼脂,其他与马铃薯葡萄糖固体培养基成分相同,用于尖孢镰刀菌液体培养。
1.2 拮抗菌株筛选
1.2.1 菌株生物量 15株细菌活化后,分别以1%接种量接入牛肉膏蛋白胨液体培养基中,28 ℃、120 r/min振荡培养,于培养6、12、24、36、48、72 h时,取样并稀释涂布平板检测其生物量,每个菌株3个重复。
1.2.2 初筛 在90 mm的马铃薯葡萄糖固体培养基平板中央,接入直径6 mm的尖孢镰刀菌菌饼,同时于菌饼两侧分别接入1 μL供试细菌(7×108cfu/mL),以不接细菌的培养基作为对照。待对照菌落长满平板时进行测量,测量病原菌菌落直径,计算抑菌率,抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
1.2.3 复筛 从温室采集草莓根际土壤,称取150 g放入250 mL三角瓶中,121 ℃、20 min灭菌后,接入尖孢镰刀菌发酵液1 mL(1×106cfu/mL),同时接入各供试菌株发酵液(108cfu/mL)3 mL,搅拌均匀后放入光照培养箱中模拟温室日夜变化培养(28 ℃、70%光照12 h;20 ℃、黑暗培养12 h)。于培养第5、15和35 d时,取样并稀释涂布记录尖孢镰刀菌的生物量。设置清水为对照,每个处理3个重复。
1.3 菌株相容性试验
参考Barbosa等[29]的测定方法,在牛肉膏蛋白胨固体培养基一侧接入供试菌株SA-1,同时在另一侧接种菌株SV-2,其中SA-1和SV-2为1.2所得目标拮抗菌,试验重复3次,28 ℃培养24 h。两菌株之间若产生明显的抑菌带即为不相容,无明显抑菌带即为相容。
1.4 菌株鉴定
1.4.1 形态学观察 挑取活化好的SA-1和SV-2单菌落在牛肉膏蛋白胨平板培养基上进行划线,置于28 ℃培养箱中培养24 h后取出观察其菌落的颜色、形态和大小,并进行革兰氏染色。
1.4.2 Biolog微生物自动分析鉴定 挑取活化好的SA-1和SV-2单菌落在BUG培养基中“米”字划线培养24 h,用无菌棉签轻擦下菌苔于GN/GP-IF接种液中,制成菌悬液,用浊度计调整至浊度为(95±3)%,再用8孔移液器将菌悬液分加在GNⅢ鉴定板的各孔中。每孔各100 μL,共96孔。盖上鉴定板盖,置于28 ℃的培养箱中培养,16~24 h时读数[30],自动检索数据库,比较鉴定结果。
1.4.3 分子鉴定及系统发育树构建 采用上海生工细菌基因组DNA快速抽提试剂盒提取菌株SA-1和菌株SV-2的 DNA,PCR 扩增采用细菌通用引物 27F(5′-AGAGTTTGATCCTGGCTCA-3′)和 1492R(5′-GGTTACCTTGTTACGACTT-3′)。反应总体系为 25 μL:TaqMIX 12.5 μL,引物 27F 和 1492R 各 1 μL,模板1 μL,ddH2O 9.5 μL。反应程序为:95 ℃预变性10 min;93 ℃变性60 s,50 ℃退火60 s,72 ℃延伸90 s,25个循环;72 ℃延伸90 s;4 ℃保存。将PCR扩增产物交由北京诺赛生物技术有限公司测序,将测得的菌株SA-1和SV-2序列在NCBI官网数据库进行Blast比对,进化距离的计算采用邻接法,进化树分支模式的稳定性用MEGA7.0软件分析,采用bootstrap法,重复次数为1000,构建系统发育树。
1.5 盆栽促生及防效试验
将健康的、长势一致的草莓幼苗移栽于花盆中(口径12 cm,0.5加仑),盆中加入500 g无菌土(121 ℃高压灭菌20 min),每盆移栽1株草莓苗。试验共设8个处理(表1),每个处理3株,重复3次。草莓移栽后第10 d和第20 d分别进行生防菌(7×108cfu/mL)灌根7 mL,移栽13 d后通过灌根方式接入尖孢镰刀菌(1×106孢子/mL)2.5 mL,移栽40 d后调查病情指数并计算防治效果,同时统计株高、叶片数、最大叶叶面积、叶绿素、丙二醛(MDA)活性、过氧化氢酶(CAT)活性。草莓枯萎病的病情分级标准以叶片为单位,分为5级[31]:0级,无症状;1级,病株有1/4以下的叶片出现萎蔫状;2级,有1/4~1/2的叶片出现萎蔫状;3级,有1/2以上的叶片出现萎蔫状;4级,病株死亡或接近死亡。病情指数=∑(各级病叶数×代表数值)/(调查总叶数×最高病级值)×100,防治效果(%)=∑(对照病情指数-处理病情指数)/对照病情指数×100。最大叶叶面积=最大叶叶长×最大叶叶宽×0.98[32];叶绿素测量采用SPAD502plus叶绿素仪;并采用试剂盒(北京索莱宝科技有限公司)测定草莓叶片中丙二醛(MDA)和过氧化氢酶(CAT)活性。

表1 田间试验设计Table 1 Field experiment design
1.6 数据统计与分析
统计分析采用SPSS 24(One-way ANOVA)软件进行数据的分析处理。
2 结果与分析
2.1 拮抗菌株筛选
2.1.1 菌株生物量分析 从表2可以看出,供试15株细菌,培养时间不同,菌株生物量呈现明显差异。培养6 h菌株S5、S4、S14、S15、和S7生长较快,且依次减弱;培养12 h菌株S5、S4、S15、SA-1和SV-2生长较快,且依次减弱;培养24 h菌株S5、S4、S15、S12、S14、SA-1、S3、S7和SV-2生长较快,且依次减弱;培养36 h菌株S5、S4、SA-1、S15和SV-2生长较快,且依次减弱;培养48 h菌株S5、S4、SA-1、S3、SV-2和S14生长较快,且依次减弱;培养72 h菌株S5、S4、SA-1、S3、S13、S15和SV-2生长较快,且依次减弱。综上,S5、S4、SA-1、S3、S15和SV-2生长较快。

表2 不同菌株72 h内生物量变化Table 2 Biomass changes of different strains within 72 h
2.1.2 初筛 从表3和图1可以看出,菌株SV-2和SA-1对草莓枯萎病原菌的抑制效果较好,抑制率分别为66.67%和64.39%,与其他菌株间存在显著性差异。其次是菌株S2、S3、S1,抑制率为59.19%、57.47%和54.60%。其他菌株对草莓枯萎病原菌的抑制效果相对较低,抑制率不足50%。因此,菌株SV-2、SA-1、S2、S3、S1对草莓枯萎病菌有抑制作用。
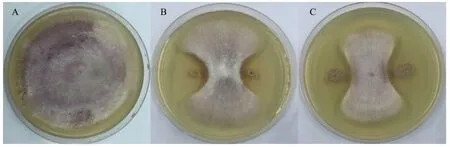
图1 菌株SA-1和SV-2对草莓枯萎病原菌的抑菌效果Fig.1 The effect of strain SA-1 and SV-2 on F.oxysporium

表3 拮抗菌对尖孢镰刀菌的抑菌效果Table 3 Effect of antagonistic bacterium on F.oxysporum
2.1.3 复筛 从表4可以看出,不同菌株处理土壤后,土壤中病原菌数量存在明显差异。处理第5 d时,菌株S7、SV-2、SA-1、S2、S4、S3、S9和S13表现出抑制效果较好,且依次减弱,处理间差异不显著,但与空白对照间存在显著差异。处理第15 d时,菌株S2、S7、SV-2、S1、SA-1、S3、S4、S12表现出较好抑制效果,且依次减弱,处理间差异不显著,但与空白对照间存在显著差异。第35 d时,菌株SV-2和SA-1处理土壤中病原菌数量表现为较低,与空白对照存在显著差异。综上表明,菌株SV-2和SA-1对尖孢镰刀菌抑制效果最好。

表4 拮抗菌对土壤尖孢镰刀菌数量的影响Table 4 Effects of antagonistic bacterium on total F.oxysporum population in soil
2.2 菌株SA-1和SV-2相容性
如图2所示,菌株SA-1和SV-2间未产生明显抑菌带,表明两菌株无拮抗作用,相容性良好。

图2 SA-1和SV-2相容性Fig.2 Compatibility of SA-1 and SV-2
2.3 菌株鉴定
2.3.1 形态学观察 菌株SA-1菌落呈白色,表面粗糙不透明,常形成褶皱,伴有多处隆起。单个细胞(0.7~0.8)μm×(2~3)μm,着色均匀,鞭毛周生,能运动,无隔膜,革兰氏阳性菌,产芽胞,芽胞(0.6~0.9)μm×(1.0~1.5)μm 位于菌体中央或稍偏,芽胞形成后菌体不膨大,初步确定为芽胞杆菌属。菌株SV-2菌落呈淡黄色,表面粗糙不透明、边缘不规则,产芽胞,芽胞两端钝圆、长短不一,革兰氏阳性,初步确定为芽胞杆菌属。
2.3.2 Biolog鉴定 菌株培养22 h时读数可知,SA-1的 Biolog系统显示SIM为0.598,大于0.5,PROB为0.916,DIST为5.055,被初定为枯草芽胞杆菌(图3A),SV-2的 Biolog系统显示SIM为0.603,大于0.5,PROB为0.603,DIST为5.728,被初定为解淀粉芽胞杆菌(图3B)。
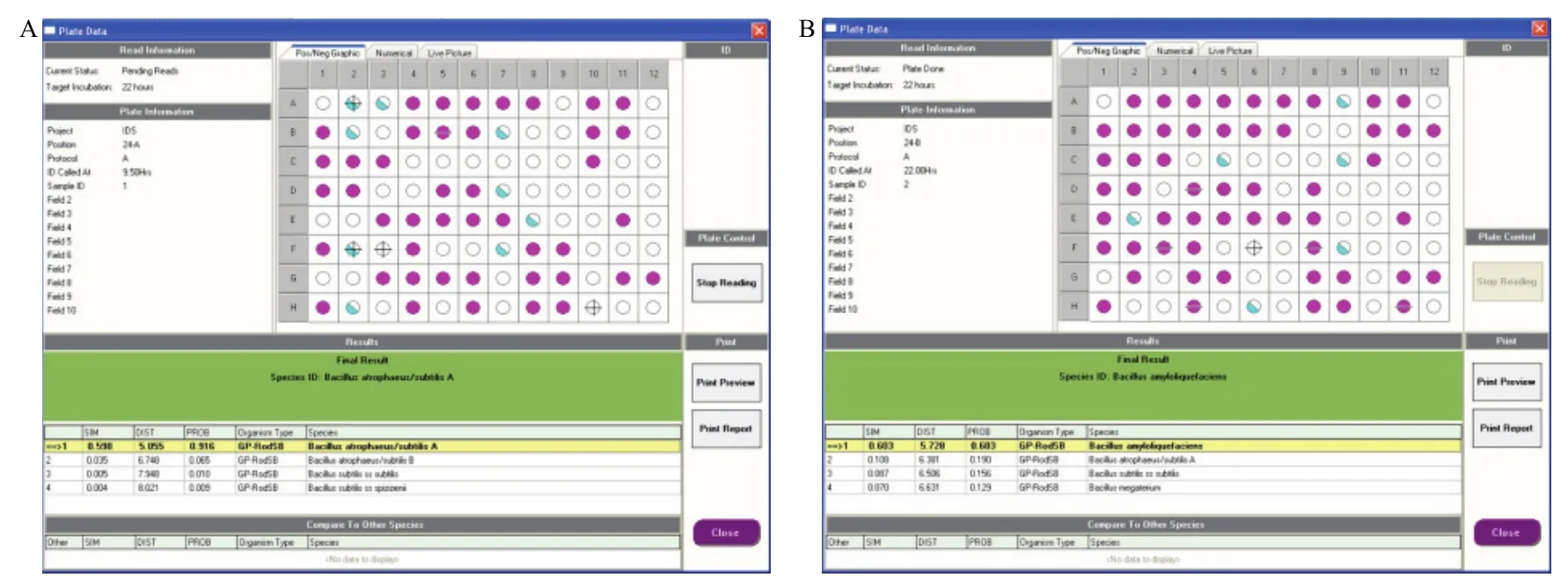
图3 菌株SA-1(A)和SV-2(B)的微平板图谱Fig.3 Microplate of strain SA-1 (A) and SV-2 (B)
2.3.3 系统发育树的构建 以菌株SA-1和SV-2的基因组DNA为模板,细菌通用引物27F/1492R对其16S rDNA片段进行PCR扩增,获得1400 bp左右的单一特异性片段。将所测序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中进行Blast序列检索。选取比对结果较靠前部分的同源序列,构建系统进化树,结果如图4。SA-1与Bacillussubtilisstrain N-11(MW345828.1)的16S rDNA序列处于同一分支。菌株SV-2与Bacillusamyloliquefaciensstrain W9(MH188056.1)的16S rDNA序列处于同一分支。该结果与Biolog的鉴定结果相吻合。

图4 菌株SA-1和SV-2的系统发育树Fig.4 Phylogenetic trees of strain SA-1 and SV-2
2.4 拮抗菌对草莓枯萎病的盆栽防效
由图5所示,生长40 d后,病原菌处理(T5)的草莓植株表现为矮小,茎基部萎蔫,叶片萎蔫,地上部逐渐干枯,出现明显的枯萎病发病症状,草莓病情指数为49.56(表5)。单一拮抗菌处理后草莓植株长势与清水对照相近,SA-1、SV-2处理(T6、T7)后草莓病情指数分别为21.18和19.94,防效分别为57.27%和59.77%,而复合拮抗菌处理(T8)后草莓植株长势最好,草莓病情指数和防效分别14.21和71.33%。显著性分析表明,单一拮抗菌处理、复合拮抗菌处理与病原菌处理间草莓病情指数和防治效果均存在显著差异(P<0.05)。
2.5 拮抗菌对草莓的促生作用
由图5所示,在盆栽促生试验中,拮抗菌处理组草莓长势旺盛(T2、T3和T4),与清水对照(T1)处理相比,SA-1、SV-2、复合拮抗菌处理后(T2、T3和T4)草莓株高、叶绿素、最大叶叶面积均增加(表5),最大叶叶面积增加幅度较大,SA-1、SV-2、复合拮抗菌(T2、T3和T4)分别增加1.94、1.93、2.89倍。单一拮抗菌处理后叶片数有所减少,但复合拮抗菌处理后叶片数增加。

图5 病原菌和拮抗菌处理草莓长势对比Fig.5 Growth comparison of strawberry treated by pathogen and antagonistic bacterium
2.6 拮抗菌对草莓叶片中MDA含量和CAT活性的影响
由表5可知,与清水对照(T1)处理相比,病原菌处理(T5)后草莓叶片MDA含量明显增加(P<0.05),MDA含量提高1.41倍,差异显著。其他处理(除T5)的MDA含量与清水对照(T1)处理间无明显差异。病原菌处理(T5)后草莓叶片CAT活性,与清水对照(T1)处理相比,明显减少,降低了1.91倍,差异达到显著水平。拮抗菌处理(T2、T3和T4)后草莓叶片CAT含量略有增加,与清水对照(T1)处理间差异不显著。而拮抗菌与病原菌联合处理(T6、T7和T8)后草莓叶片CAT活性,与病原菌处理(T5)明显增加,其中T6和T8处理差异达到显著水平,尤其复合拮抗菌处理(T8)较之单一菌液处理(T6和T7)效果更好。
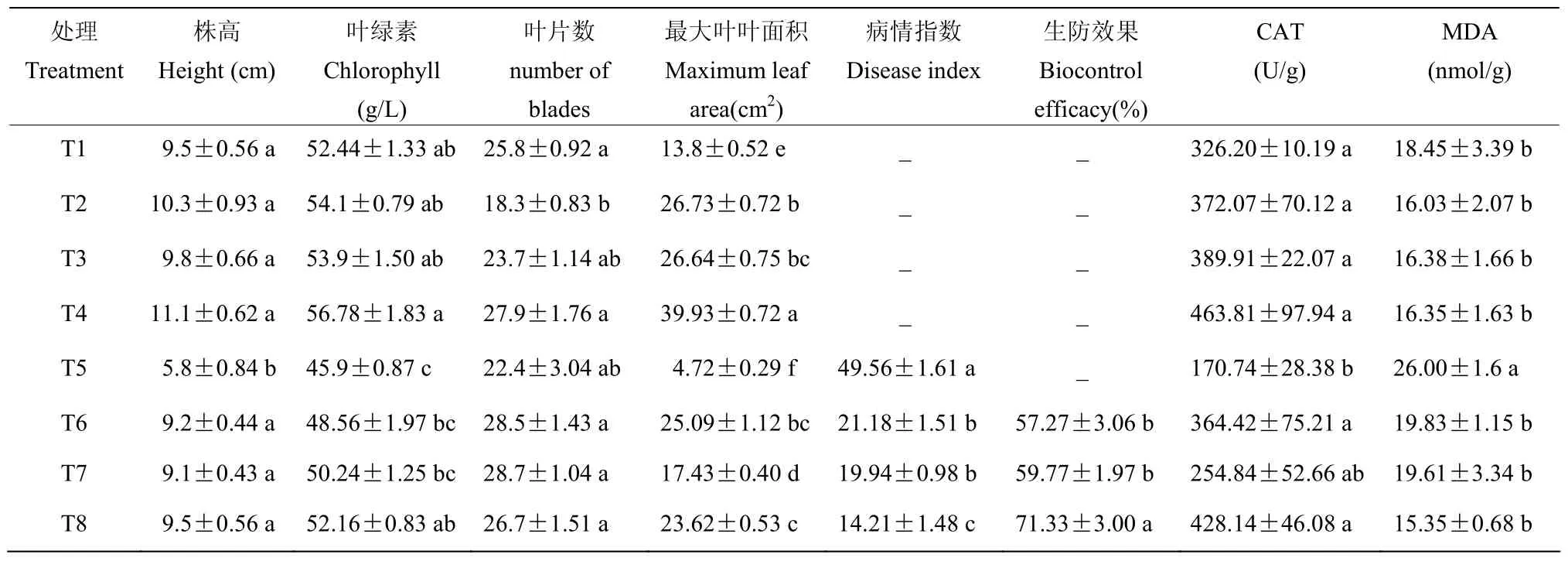
表5 拮抗菌对草莓生长和枯萎病的影响Table 5 Effects of antagonistic bacterium on plant growth and Fusarium wilt of strawberry
3 讨论
芽胞杆菌属细菌能够产生耐热且抗逆性的芽胞,分布广泛,是植物根际和土壤微生态区系的优势种群,并且抑菌谱广,同时能促进作物生长和诱导植株系统抗性[8,9]。近年来,芽胞杆菌属被认为是最成功的一类生防菌,尤其是枯草芽胞杆菌和解淀粉芽胞杆菌,已有研究表明其具有拮抗多种枯萎病病原菌的能力,如枯草芽胞杆菌能够防治香蕉[33]、黄瓜[34]、向日葵[35]和马铃薯[36]等枯萎病,解淀粉芽胞杆菌能够防治番茄[37]、西瓜[38]、香蕉[39]、苦瓜[40]和棉花[41]等枯萎病,均取得较好的防治效果。然而目前对于生防芽胞菌株的应用研究主要集中单一菌株,对2株或更多株芽胞杆菌混用效果的研究相对较少,在一定程度上影响了此类生防细菌的应用。
本试验以筛选草莓枯萎病的高效生防菌株为出发点,筛选出2株对草莓枯萎病有较强抑制效果的芽胞杆菌菌株SA-1和SV-2,并且这两株菌相容性良好,通过平板对峙法进行初筛时,2株菌的抑制率分别为64.37%和66.67%。复筛试验第5 d能将土壤中尖孢镰刀菌的数量从5.95×106cfu/g分别降到2.25×106cfu/g和2.1×106cfu/g,第35 d分别降为3.5×105cfu/g和3×105cfu/g。根据形态观察、Biolog和分子鉴定,将菌株SA-1和SV-2分别鉴定为枯草芽胞杆菌Bacillussubtilis和解淀粉芽胞杆菌Bacillusamyloliquefaciens。盆栽试验进一步表明菌株SA-1和SV-2联合发酵液防治效果比单一菌株更佳,防效达70%以上。这一结果表明生防菌混用在草莓枯萎病防治上具有一定的应用潜力。
过氧化氢酶活性可作为细菌是否成为潜在生物防治剂的重要特征,因为过氧化氢酶能够分解代谢过程中产生的活性氧,减少植物的氧化损伤,从而增强植物抗病能力。而丙二醛能够反应植物衰老和逆境中受伤程度,从而判断植株抗逆性高低。本试验分析了盆栽促生及防效试验草莓叶片中过氧化氢酶以及丙二醛活性变化,发现枯草芽胞杆菌和解淀粉芽胞杆菌处理后草莓叶片中过氧化氢酶活性增强,丙二醛含量下降,而且2株生防细菌混合使用较之单一菌液处理的草莓叶片过氧化氢酶活性更强,丙二醛含量更低。这一结果表明草莓植株内过氧化氢酶和丙二醛含量变化可能是生防细菌混用效果提高的机制之一,SA-1与SV-2联合使用抑制草莓枯萎病的生防机制有待于进一步深入研究。
