不同西瓜品种枯萎病抗性鉴定方法比较
2015-06-24张屹刘建雄梁志怀等
张屹 刘建雄 梁志怀 等
摘 要:以20个不同类型的西瓜品种为试验材料,采用室内苗期人工接种鉴定方法和分子标记检测方法进行比对,研究不同西瓜品种对枯萎病的抗性差异及不同鉴定方法之间的关系。试验结果表明,人工接种鉴定与分子检测方法鉴定结果基本吻合,CAPS标记(7716_fon)可以将西瓜抗、感枯萎病的界限有效定性为病株率70%。
关键词:西瓜;枯萎病;分子标记检测;人工接种鉴定
中图分类号:S651 文献标识码: A 文章编号:1001-3547(2015)12-0050-03
西瓜枯萎病是由西瓜枯萎病菌(Fusarium oxysporum f. sp. niveum,FON)侵染所致的土传维管束病害,是严重制约西瓜生产的病害之一[1~3]。已有文献报道,尖孢镰刀菌西瓜专化型生理小种有4个,0、1、2和3,其中,1号生理小种在我国致病力最强、存在范围最广[4]。因此,以1号生理小种为病原菌株,开展西瓜品种枯萎病抗性评价具有很强的代表性。随着分子生物学的发展,研究者们已对西瓜枯萎病病菌1号生理小种的抗病基因(Fon-1)进行定位[5~8],并利用已开发的分子标记开展不同西瓜新品种Fon-1基因的分布调查,为西瓜新品种抗性鉴定提供了重要的依据。本文通过对20份不同类型西瓜品种进行抗枯萎病室内人工接种鉴定与分子检测分析,以期为西瓜抗病分子育种和抗源筛选提供参考。
1 材料与方法
1.1 试验材料
供试西瓜为湖南省西瓜甜瓜研究所引进的杂交品种20个,其中包括有籽西瓜、无籽西瓜和小果型西瓜3类。
供试病原菌为西瓜枯萎病菌1号生理小种(FON-1),由北京农林科学院蔬菜研究中心西瓜课题组许勇老师惠赠。
1.2 试验方法
①接种鉴定方法 参照耿丽华等[9]报道的西瓜苗期接种鉴定方法,于2014年5~7月在湖南省西瓜甜瓜研究所基地大棚内进行。供试西瓜材料按编号播种于灭菌的沙子中,当西瓜幼苗长至2叶1心时,置于孢子浓度为5×106个/mL的西瓜枯萎病病菌悬浮液中接种15 min。每个品种设置3个重复,分别调查病株率。
②DNA提取 待接种后7 d进行单株取样,采取CTAB法提取基因组DNA[10]。
③PCR反应体系 均采用12 μL,包括1.2 μL 10×Buffer(含 Mg2+),1 μL 2.5 mmol/L dNTPs,1 μL 10 μmol/μL引物,0.2 μL 5 U/μL Taq DNA聚合酶,2 μL 30 ng/μL模板DNA,用去离子水补足至12 μL。引物7716_fon为张屹等[8]已发表的西瓜抗枯萎病基因分子标记,由上海生工生物技术公司合成。
7716_fon引物序列为:5'-TTAAAAATCATCTCCTCTTTAAAACTATT-3',5'-ATATATTTGGTCTCCGAGTGTTCAA-3'。
2 结果与分析
2.1 枯萎病抗性分析
用中国西瓜主产区当前分布最广的尖孢镰刀菌西瓜专化型1号生理小种(FON-1)对供试的20个西瓜品种进行苗期枯萎病接种鉴定,结果表明(表1),20个品种对枯萎病表现出不同抗性。其中,9个品种表现为高抗(HR,枯萎病病株率0~20%),占总数的45%;2个品种表现为中抗(MR,枯萎病病株率21%~50%),占总数的10%;5个品种表现为轻抗(LR,枯萎病株率51%~80%),占总数的25%;而表现为感病(S,枯萎病病株率80%以上)的品种有4个,占总数的20%。
2.2 抗病基因分子检测
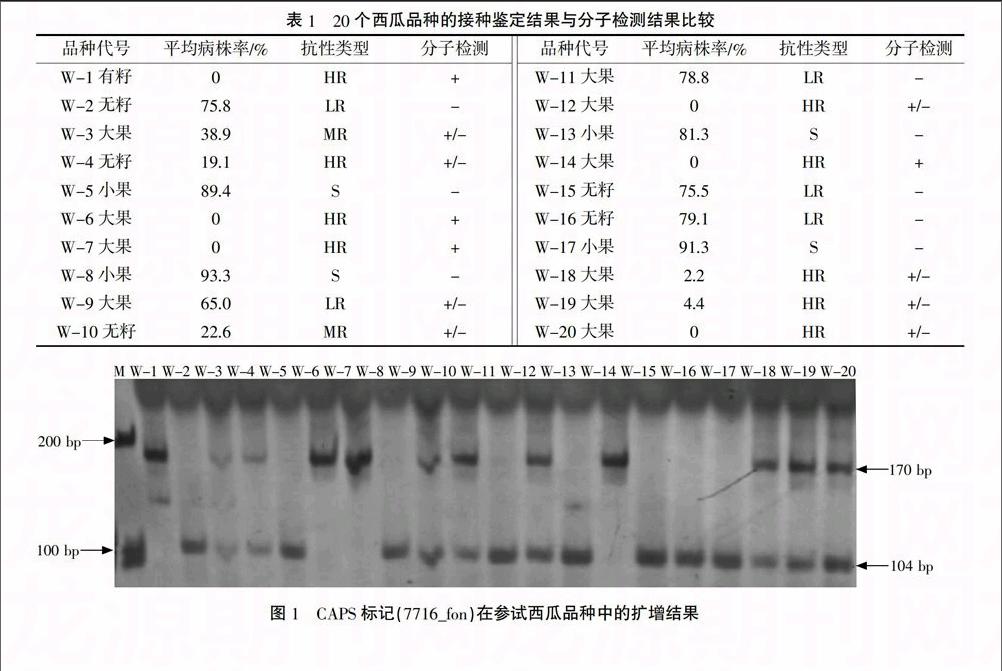
利用CAPS标记7716_fon对20个西瓜品种Fon-1基因进行分子检测。结果表明(图1),有12个品种能扩增出170 bp的特异带,基因型鉴定表现为抗枯萎病品种;8个品种仅能扩增出104 bp的特异带,基因型鉴定表现为感枯萎病品种。
2.3 田间枯萎病接种鉴定与分子鉴定结果比对
利用国内西瓜枯萎病病菌优势小种对引进的20个西瓜品种进行抗性鉴定及分子检测结果对比,结果显示(表1、图1),CAPS标记7716_fon可以有效区分抗、感枯萎病材料,其结果与抗性鉴定结果吻合,并将病株率70%定性为感抗界限。
3 讨论与结论
西瓜抗枯萎病育种工作早在1902年即开展,第一个抗病品种Conqueror是通过对枸橼西瓜的抗性转育育成,此后,Calhoun Gray、Jubilee、Crimson Sweet、Summit、Smokylee等抗病性强的品种相继问世[11]。近年来,随着设施农业的迅速推广,连作障碍成为西瓜生产的主要制约因子。因此,西瓜育种家把抗枯萎病作为了最重要的选育性状之一。本研究中所引进的品种包括了5个无籽西瓜、11个有籽西瓜和4个小果型西瓜品种。通过枯萎病苗期接种鉴定发现,4个小果型西瓜品种均感枯萎病;无籽西瓜中1个表现为高抗、1个表现为中抗、3个表现为轻抗;而有籽西瓜中8个表现为高抗、1个表现为中抗、2个表现为轻抗。不同类型的西瓜品种抗性差异明显,推测原因是,现今小果型西瓜品质与枯萎病性状并存的抗性亲本材料依然偏少,未能在育种中得到很好的运用。因此,利用分子标记辅助选择技术对优良性状基因进行聚合,选育优良性状材料是重要的趋势。
张国良等[12]研究指出,西瓜枯萎病抗性遗传可能受多基因控制,不同资源材料其抗病基因可能各不相同。随着西瓜全基因组信息的公布[13],西瓜在进化过程中也丢失了部分抗病基因。本研究利用与西瓜枯萎病抗性基因(Fon-1)紧密连锁的CAPS标记7716_fon进行验证发现,该标记的检测结果与苗期接种鉴定结果吻合,而且以病株率70%为界限对抗、感枯萎病进行了有效区分。但是,7716_fon能检测含有Fon-1基因的品种对病原菌表现的抗病性程度差异,我们初步认为是由于西瓜的抗源不同,导致与其相关联的生长势、生物量存在差异,进而影响其抗性反应表现。本研究首次利用分子标记对西瓜枯萎病发病率进行了定性分析,并将病株率70%定义为感抗界限,可以加快西瓜抗性育种的进程,为快速进行栽培品种的抗性分子改良提供了一条有效的技术途径。
参考文献
[1] 徐润芳,杨鼎新.我国西瓜抗枯萎病育种的进展与前景[J]. 中国西瓜甜瓜,1992(1):2-5.
[2] 周凤珍,康国斌.西瓜部分抗枯萎病材料的抗性遗传研究[J].中国西瓜甜瓜,1996(2):17-18.
[3] Zhang Z G, Zhang J Y, Wang Y C, et al. Molecular detection of Fusarium oxysporum f. sp. niveum and Mycosphaerella melonis in infected plant tissues and soil[J]. FEMS Microbiol Lett, 2005, 249(1): 39-47.
[4] 张兴平,王鸣.我国西瓜枯萎病生理小种分化研究初报[J].中国西瓜甜瓜,1991(1):39-43.
[5] Xu Y, Ou Y X, Zhang H Y, et al. Identification of a RAPD marker linked to Fusarium wilt resistant gene in wild watermelon germplasm (Citrullus lanatus var. citroides) [J]. Acta Botanica Sinica, 1999, 41(9): 952-955.
[6] 许勇,张海英,康国斌,等.西瓜抗枯萎病育种分子标记辅助选择的研究[J].遗传学报,2000,27(2):151-157.
[7] Leigh K, Fenny D. Draft of RAPD map of watermelon[J]. American Society for Horticultural Science, 2001, 126(3):344-350.
[8] 张屹,张海英,郭绍贵,等.西瓜枯萎病菌生理小种1抗性基因连锁标记开发[J].中国农业科学,2013,46(10):
2 085-2 093.
[9] 耿丽华,郭绍贵,吕桂云,等.西瓜枯萎病菌生理小种鉴定技术体系的建立和验证[J].中国蔬菜,2010(20):52-56.
[10] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research, 1980, 8(19): 4 321-4 325.
[11] 张屹,魏林,许勇,等.西瓜枯萎病的研究进展[J].湖南农业科学,2013(5):67-70.
[12] 张国良,王春生,杨坤,等.西瓜枯萎病抗性材料的转育及其遗传规律的研究[J].安徽农业科学,1999,27(6):616-618.
[13] Guo S G, Zhang J G, Sun H H, et al. The draft genome of watermelon (Citrullus lanatus) and resequencing of 20 diverse accessions[J]. Nature Genetics, 2012, 45: 51-58.